黏液黏蛋白的药动学研究进展
刘韦鋆, 崔云峰
黏液是黏膜表面的黏弹性保护层,由一些特殊的上皮细胞合成,如杯状细胞。黏液分布在身体所有暴露在外部环境下的器官,如眼睛、呼吸系统、消化系统和阴道等(图1)[1-2],但其特性(组成、结构、厚度)不尽相同,如在小肠中仅有一个疏松单层,而在大肠中却是两层结构(疏松的外层和致密的内层)(图2)[3]。
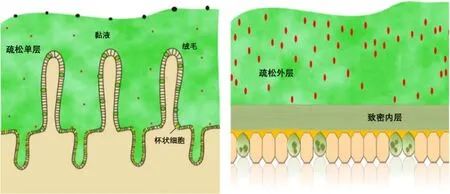
图2 小肠和大肠中的黏液
1 黏液的生理功能
黏液的结构不同,有疏松层和致密层的区别。疏松层呈现单分子状态,致密层呈现聚合物状态。由此决定着黏液的功能也有差别。致密层黏液被认为是阻止病原体、有害物质接触底层组织的天然屏障。细菌的脂多糖和肽聚糖刺激黏膜,促使黏液分泌增加。其与病原体的作用方式有:黏液网络的诱捕,黏液结构的疏水,黏液聚糖的结合,黏液的空间阻隔,黏液流动和更新的清除。此外,潘氏细胞和肠上皮细胞分泌抗菌肽、溶菌酶、分泌型免疫球蛋白(SIgA)到黏液层[4],黏液可为其提供结合位点,将其逐渐浓集在上皮表面,减慢其稀释和排入肠腔的速度(抗菌作用从上皮细胞到肠腔呈梯度下降)[5],辅助发挥肠屏障作用。同时,黏液也会阻隔药物的跨膜扩散过程或黏附药物[6-10]。而益生菌则可以利用疏松层黏液作为它们优选的定植部位,利用黏蛋白高数量的寡聚糖链结构作为附着点。黏液为益生菌的新陈代谢提供能量。其次,黏液还有许多生理功能:润滑腔道,维持上皮细胞上水分层,作为交换气体和营养物质的可渗透凝胶层和转导细胞信号等。
2 黏液的组成
黏液含有90%~95%的水、2%~5%的糖蛋白、脂质(如脂肪酸、磷脂和胆固醇等)、蛋白质(如溶菌酶、免疫球蛋白、防御素和生长因子等)、电解质、生长因子和DNA等,但主要成分是一种糖蛋白,称作黏蛋白。它是黏液的框架,反映黏液的特征。
3 黏蛋白的分子结构
黏蛋白是一类高分子量(200 kDa~200 mDa)和大量糖基化(高达80%)的蛋白质。其分子由蛋白质核心和糖基组成。蛋白质核心称作“apo黏蛋白”,有两个区域,一个是中央糖基化区域,由大量富含丝氨酸、苏氨酸和脯氨酸的串联重复序列组成;另一个是以球状蛋白为代表的氨基酸区域(非糖基化区域),位于氨基和羧基末端,有时穿插在STP重复之间。糖基存在于蛋白质核心周围,由大量的碳水化合物(N-乙酰半乳糖胺、N-乙酰葡糖胺、岩藻糖、半乳糖、N-乙酰神经氨酸)和少量的甘露糖、硫酸盐组成。以O-低聚糖和N-聚糖链结合于蛋白质核心(图3)[11]。
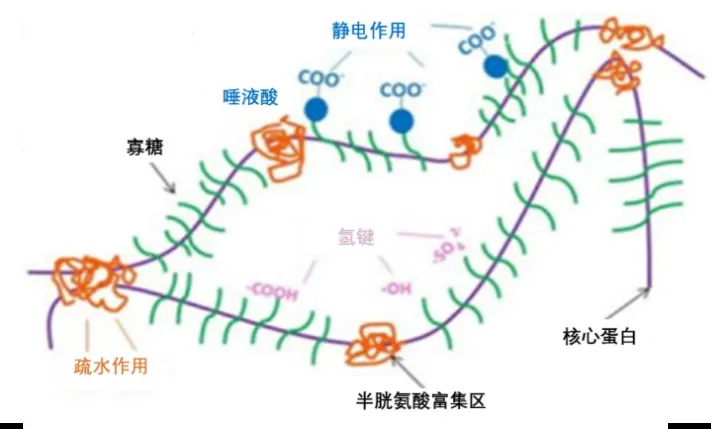
图3 黏蛋白分子结构
4 黏蛋白的基因亚型及分类
将近二十多种黏蛋白基因亚型已经被发现存在于人体。在大鼠和小鼠中也存在部分同源染色体[12]。黏蛋白的基因亚型包括:MUC1、MUC2、MUC3A、MUC3B、MUC4、MUC5AC、MUC5B、MUC6、MUC7、MUC12、MUC13、MUC15、MUC16、MUC17、MUC19、MUC20等。这些基因亚型分为两类:分泌型黏蛋白和膜结合型黏蛋白(图4)[13]。分泌型黏蛋白可形成巨大聚合物网络,表达于整个腔道;膜结合型黏蛋白结合于上皮细胞膜表面,是分泌型网络的锚[14],有黏附、信号通路转导、修复上皮和愈合黏膜等作用[15]。大多数黏蛋白基因家族定位于染色体7q22和11p15.5[16-17]。一些小的膜结合型黏蛋白并不被看作是真正的黏蛋白,它们与其他黏蛋白共享某些区域[18]。不同种属间同种黏蛋白基因亚型高度相似[12]。不同部位所包含的基因亚型不同,如小肠主要表达MUC2[19-20],胆囊主要表达MUC5B[21]。
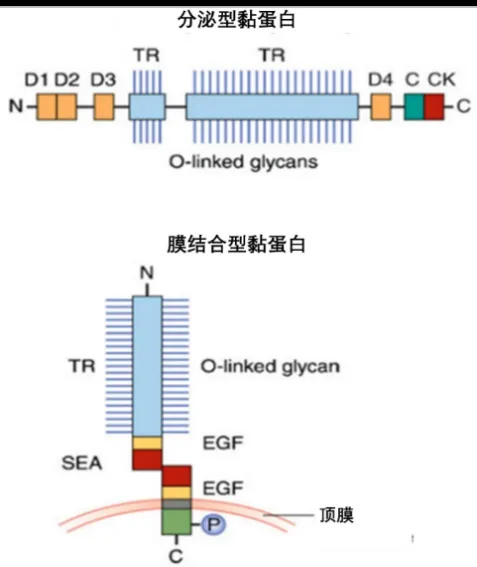
图4 黏蛋白分类
5 黏蛋白的理化特性
黏蛋白作为一种聚合物,呈现两种构象,等向折叠的无规则螺旋状和非等向延伸的无规则螺旋状。糖基是维持延伸构象的关键[22]。黏蛋白构象同样取决于pH值和离子强度,而不是盐浓度和温度。低pH值中呈现延伸构象,高pH值中呈现折叠构象[23]。黏蛋白之间可以相互作用,也可以与黏液的其他成分相互作用[24]。在一定条件下,黏蛋白有聚集和成胶的潜在趋势。随着pH值的减少,黏蛋白相互聚集,逐渐成胶,黏度与浊度增大,发生单分子-聚合物的分子状态变化[22,25]。其分子机制可能是当带负电荷的羧酸盐在低pH值的情况下被质子化时,盐桥(由带负电的羧酸盐和带正电的氨基酸侧链组成)的破坏导致黏蛋白纤维的聚集[26-27]。此外,随黏液与上皮细胞距离的变化和肠道细菌的影响,黏蛋白的分子状态也发生变化[28-29]。黏蛋白与脂质存在静电、疏水、氢键的相互作用[30],易于吸附疏水物质表面[31]。
6 黏蛋白变化的诱因
黏蛋白状态的改变,尤其是糖基化模式和表达水平的改变,可引起黏蛋白数量、结构、功能或分泌的异常化。这和特殊的生理变化或疾病相关。在感染、炎症、囊性纤维化、支气管炎、哮喘、胆结石和癌症中,黏蛋白表达过度[32-37]。在干眼综合征和溃疡中,黏蛋白表达不足[38-39]。这些可以被看作病理学标志物。年龄和饮食也可以改变黏液的厚度和组成[40-43]。小儿和老人的黏液层薄于成人,黏蛋白合成和分泌少。食物因素(如纤维素、蛋白、抗营养因子等)会影响来自杯状细胞的黏蛋白合成和分泌。在以上变化中,黏蛋白的特性和功能取决于离子强度,pH值起重要作用[26]。
7 黏蛋白研究的药动学实验模型
近些年来,黏蛋白的药动学行为研究越来越受到重视,如黏蛋白对药物及其制剂的吸收屏障作用,黏蛋白对药物的溶出稳定作用,黏蛋白对内源性物质的成核作用等。随着研究的深入,相关的实验模型也逐渐成熟起来。
7.1 黏蛋白实验模型天然黏液可以从组织表面收集,直接用于研究,如屏障实验[44-52];稳定性或成核实验[53-57]。虽然天然黏液反映了真实的体内黏液组成和结构,但是由于组成复杂、不确定、高变异性不能解释特定黏蛋白的具体机制[6]。纯化黏蛋白的成分相对确定,可以清楚地解释分子机制。同时,也可以根据目的考察几种特定黏蛋白成分的相互作用。纯化黏蛋白大多是商品化的,批次之间差异不大[58-61]。
7.2 细胞实验模型体内黏液的性质会随与其下上皮细胞距离的变化而变化[28-29]。一些体外培养细胞系可分泌特定黏蛋白,并具有这种性质。他们可应用于不同转运实验装置,如Transwell, Ussing Chamber等(图5)[6]。细胞模型也用于药物调控黏蛋白分泌的研究。同样,也可将制备的黏蛋白加于无黏蛋白分泌的细胞系,进行相关细胞实验[62]。此外,应用多器官细胞混合培养模型研究不同器官黏膜组织的对话[63-64]。
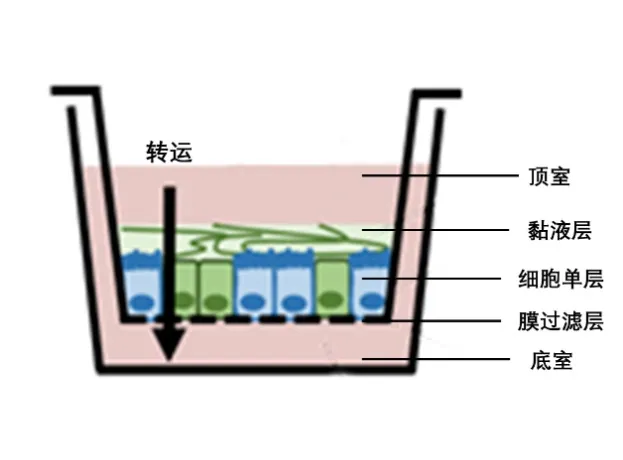
图5 细胞的转运模型
7.3 组织和动物实验模型体内有更复杂的内环境,影响黏蛋白的分子状态;体内有吸收过程,药物不断从肠液移除进入血流,体现动力学特征。因此,体外实验不能完全证明。离体组织模型、在体模型和动物模型可以真实地反映体内不同部位天然黏膜环境的特征,如组成、结构、厚度,动力学。离体组织模型是体内环境的快照,包括离体肠片、离体肠环、外翻肠囊、Ussing Chamber[65-66];在体模型保持动物完整的血循环、神经系统和代谢功能,包括肠灌流和闭合肠环[67-68];动物模型有利于体现各种因素引起的黏液层改变,包括无菌动物模型,基因敲除动物模型,特殊疾病动物模型[69-73]。
8 展望
当前本实验室正在研究黏蛋白对不同结晶行为难溶性药物过饱和溶液稳定性的影响及其机制。该研究可以进一步增进我们关于黏蛋白的认识;提示在生理或病理状态下黏蛋白对过饱和的作用;改进药物传递系统,增强难溶性药物的吸收和生物利用度;启发一些关于控制黏蛋白以增强胃肠道功能的手段。黏蛋白的新功能尚待研究者进一步去发现。

