恩替卡韦联合乳果糖治疗乙型肝炎后肝硬化的临床效果及对血清HBV-DNA、KLF2和TNFSF15的影响
王洪贵,唐仕炜,郑咏池
乙型肝炎后肝硬化是临床常见的肝硬化类型,约25%的乙型肝炎病毒(hepatitis B virus, HBV)感染患者可发展为肝硬化,对人们的生命健康与社会公共卫生造成严重影响[1]。临床治疗乙型肝炎后肝硬化主要以护肝、抗病毒等保守治疗为主,但长期治疗患者耐受性差,效果欠佳[2]。恩替卡韦是治疗乙型肝炎后肝硬化常用的抗病毒药物,能明显改善肝功能,控制疾病的发生、发展[3]。乳果糖是由半乳糖与果糖人工合成的双糖物质,能够在一定程度上辅助治疗肝硬化[4]。本研究探讨恩替卡韦联合乳果糖治疗乙型肝炎后肝硬化的临床效果及对血清HBV-DNA、锌指样转录因子2(krüppel-like factor 2, KLF2)、肿瘤坏死因子超家族成员15(tumor necrosis factor superfamily member 15, TNFSF15)的影响,现报告如下。
1 资料与方法
1.1一般资料 选取2017年1月—2019年1月都江堰市人民医院收治的符合纳入及排除标准的190例乙型肝炎后肝硬化,按照治疗方法的不同,分为观察组与对照组,每组各95例。观察组男58例,女37例;年龄28~75(44.61±8.06)岁;病程2~12(5.54±0.87)年;Child-Pugh分级为A级45例,B级50例;合并糖尿病9例,高血压4例。对照组男63例,女32例;年龄26~71(43.58±7.92)岁;病程1~10(5.36±0.82)年;Child-Pugh分级为A级48例,B级47例;合并糖尿病11例,高血压5例。两组性别、年龄、病程等一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会批准。

表1 采用不同治疗方法的乙型肝炎后肝硬化两组一般资料比较
注:观察组予恩替卡韦+乳果糖+常规治疗,对照组予恩替卡韦+常规治疗
1.2纳入及排除标准 纳入标准:①符合乙型肝炎后肝硬化相关诊断标准[5];②血清乙型肝炎表面抗原检测阳性;③HBV-DNA>104U/ml;④临床治疗符合赫尔辛实验法则;⑤患者及家属知情同意且签署知情同意书。排除标准:①合并人类免疫缺陷病毒感染及其他类型肝炎病毒感染;②有严重心、肝、肾等重要脏器功能障碍;③合并酒精性肝硬化;④合并自身免疫性肝病。
1.3治疗方法 两组均予以保肝等常规治疗,同时口服恩替卡韦(海南中和药业有限公司,国药准字H20100065)0.5 mg/d。在此基础上,观察组予以乳果糖(Fresenius Kabi Austria GmbH公司,国药准字H20160470)口服,每次30 ml、3/d。两组均治疗6个月。
1.4观察指标
1.4.1临床疗效[6]:观察两组治疗后6个月的临床效果:①显效:临床症状完全消失,肝功能恢复正常,肝纤维化评分下降3~4分;②有效:临床症状基本消失,肝功能基本恢复正常,肝纤维化评分下降1~3分;③无效:临床症状及肝功能无明显改善。总有效=显效+有效。
1.4.2肝功能与肝纤维化相关指标检测:两组均于治疗前、治疗后6个月清晨抽取空腹肘静脉血3 ml,选用全自动生化分析仪检测肝功能相关指标[丙氨酸转氨酶(ALT)、总胆红素(TB)]及肝纤维化相关指标[透明质酸(HA)、层黏连蛋白(LN)、Ⅲ型前胶原(PC-Ⅲ)]的水平变化。
1.4.3血清HBV-DNA水平检测:两组均于治疗前及治疗后3、6个月清晨抽取空腹肘静脉血3 ml,离心并留取上清液,采用PCR法定量检测血清HBV-DNA水平变化。
1.4.4细胞因子相关指标检测:两组均于治疗前、治疗后6个月清晨抽取空腹肘静脉血3 ml,采用酶联免疫吸附法检测KLF2、TNFSF15的水平变化,试剂盒购自北京方程佰金科技有限公司,所有操作均按照试剂盒说明书进行。
1.4.5不良反应发生情况:记录两组治疗过程中腹胀、头晕恶心、疲劳等不良反应发生情况。

2 结果
2.1临床疗效比较 与对照组比较,观察组治疗总有效率升高,差异有统计学意义(χ2=5.92,P=0.02)。见表2。

表2 采用不同治疗方法的乙型肝炎后肝硬化两组临床疗效比较[例(%)]
注:观察组予恩替卡韦+乳果糖+常规治疗,对照组予恩替卡韦+常规治疗;与对照组比较,aP<0.05
2.2肝功能与肝纤维化相关指标比较 两组治疗前ALT、TB、HA、LN、PC-Ⅲ水平比较差异无统计学意义(P>0.05);与对照组比较,观察组治疗后6个月ALT、TB、HA、LN、PC-Ⅲ水平下降,差异有统计学意义(t=7.45、P<0.001,t=10.23、P<0.001,t=15.54、P<0.001,t=5.61、P<0.001,t=4.68、P<0.001);与本组治疗前比较,两组治疗后6个月ALT、TB、HA、LN、PC-Ⅲ水平显著下降,差异有统计学意义(观察组:t=34.18、P<0.001,t=24.56、P<0.001,t=36.27、P<0.001,t=26.82、P<0.001,t=29.70、P<0.001;对照组:t=22.99、P<0.001,t=10.71、P<0.001,t=13.83、P<0.001,t=20.11、P<0.001,t=24.71、P<0.001)。见表3。
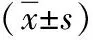
表3 采用不同治疗方法的乙型肝炎后肝硬化两组肝功能与肝纤维化相关指标比较
注:观察组予恩替卡韦+乳果糖+常规治疗,对照组予恩替卡韦+常规治疗;ALT指丙氨酸转氨酶,TB指总胆红素,HA指透明质酸,LN指层黏连蛋白,PC-Ⅲ指Ⅲ型前胶原;与对照组比较,bP<0.01;与本组治疗前比较,dP<0.01
2.3血清HBV-DNA水平比较 两组治疗前血清HBV-DNA水平比较差异无统计学意义(P>0.05);与对照组比较,观察组治疗后3、6个月血清HBV-DNA水平下降,差异有统计学意义(P<0.01);与本组治疗前比较,两组治疗后3、6个月血清HBV-DNA水平下降,差异有统计学意义(观察组:t=93.84、P<0.001,t=100.30、P<0.001;对照组:t=86.41、P<0.001,t=99.67、P<0.001);与本组治疗后3个月比较,两组治疗后6个月血清HBV-DNA水平下降,差异有统计学意义(观察组:t=55.77,P<0.001;对照组:t=5.50,P<0.001)。见表4。

表4 采用不同治疗方法的乙型肝炎后肝硬化两组血清HBV-DNA水平比较
注:观察组予恩替卡韦+乳果糖+常规治疗,对照组予恩替卡韦+常规治疗;HBV指乙型肝炎病毒;与本组治疗前比较,bP<0.01;与本组治疗后3个月比较,cP<0.01
2.4细胞因子相关指标比较 两组治疗前KLF2、TNFSF15水平比较差异无统计学意义(P>0.05);与对照组比较,观察组治疗后6个月KLF2水平下降,TNFSF15水平升高,差异有统计学意义(P<0.01);与本组治疗前比较,两组治疗后6个月KLF2水平下降,TNFSF15水平升高,差异有统计学意义(观察组:t=20.71、P<0.001,t=-36.51、P<0.001;对照组:t=8.28、P<0.001,t=-23.76、P<0.001)。见表5。
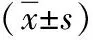
表5 采用不同治疗方法的乙型肝炎后肝硬化两组细胞因子相关指标比较
注:观察组予恩替卡韦+乳果糖+常规治疗,对照组予恩替卡韦+常规治疗;KLF2指锌指样转录因子2,TNFSF15指肿瘤坏死因子超家族成员15;与本组治疗前比较,bP<0.01
2.5不良反应发生情况比较 观察组出现腹胀4例;对照组出现头晕恶心1例,疲劳2例。两组不良反应总发生率比较差异无统计学意义(χ2=0.15,P=0.70),均予对症处理后症状消失。
3 讨论
HBV慢性感染是引起乙型肝炎后肝硬化的根本原因,其通过在肝细胞核内复制病毒核酸部分,在细胞质中包上外壳,不断整合复制,持续刺激免疫系统,破坏肝细胞,同时产生纤维因子,促进肝内纤维组织增生,若不给予及时治疗,可发展为不可逆性肝硬化,甚至肝癌[7-9]。肝纤维化是乙型肝炎后肝硬化的病理基础。有研究显示,慢性炎症反应、血管生成及肝细胞外基质过度沉积共同参与肝纤维化的发生、发展[10-11]。积极的抗病毒治疗能够延缓疾病进程,逆转部分早期肝硬化,防止终末期肝病的发生[12]。乳果糖作为一种双歧杆菌等有益菌的促进因子,具有改善肠道功能、抗氧化、抑制炎性因子释放等作用,在一定程度上可以调节机体免疫功能,保护肝细胞[13]。本文结果显示,观察组治疗总有效率明显高于对照组,提示乳果糖辅助治疗乙型肝炎后肝硬化能够提高抗病毒的治疗效果,与常规抗病毒药物联合使用具有协同作用,与吴亚平[14]报道一致。
有文献报道,肝硬化能够减弱患者肠道动力,增加肠道黏膜通透性,促进内毒素吸收,对肝脏造成严重损伤[15]。本文结果显示,两组治疗后6个月的肝功能相关指标与肝纤维化相关指标的水平较本组治疗前明显降低,同时两组治疗后3、6个月血清HBV-DNA水平较本组治疗前下降,且观察组下降幅度大于对照组,提示乳果糖辅助治疗乙型肝炎后肝硬化能明显改善肝功能,抑制肝纤维化进程,减少HBV复制。
恩替卡韦属于鸟嘌呤核苷类似物,口服后在体内形成的三磷酸盐能够选择性结合HBV多聚酶底物,发挥抗HBV活性的作用[16-17]。乳果糖是一种人工合成的双糖,口服后不易消化,很难被人体吸收,但能够由肠道细菌发酵产生一种具有抗氧化作用的气体,同时其作为一种益生元,能够促进肠道双歧杆菌等有益菌生长,改善肠道微生态,间接发挥抗氧化作用,减轻氧自由基对肝细胞的损伤,还能够降低血清内毒素水平以减少对肝细胞的直接损害[18-19]。若出现肝硬化门静脉高压时,表现为门静脉血流动力学异常,有效血容量减少,进一步促进了肝硬化进程。有学者发现,细胞因子KLF2、TNFSF15等能够参与调控肝硬化血流动力学异常[20-21]。KLF2属于锌指蛋白超家族成员之一,血管内皮可在生理性血流刺激下特异性表达KLF2[20]。TNFSF15属于肿瘤坏死因子家族亚型细胞因子,高表达能够抑制血管生成,进而抑制肝纤维化进展[21]。本文结果显示,两组治疗后6个月KLF2、TNFSF15水平较本组治疗前明显改善,且观察组改善幅度大于对照组,提示乳果糖辅助治疗乙型肝炎后肝硬化能够调节细胞因子的表达水平,从而抑制血管生成与肝纤维化,推测可能与乳果糖降低肠道黏膜通透性有关,即乙型肝炎后肝硬化患者的肠道黏膜屏障破坏,肠道细菌与内毒素易进入血液循环系统,损伤肝功能,促进肝硬化病情进一步加重,而乳果糖通过促进肠道菌群生长,降低了血氨浓度,减少了有毒物质的生成与吸收,从而改善了血液微循环状态,抑制了血管生成,保护了肝功能。此外,本研究两组治疗过程中均无明显不良反应发生,提示联合乳果糖治疗乙型肝炎后肝硬化患者的耐受性好。
综上所述,恩替卡韦联合乳果糖治疗乙型肝炎后肝硬化的临床效果较好,可改善肝功能,抑制肝纤维化,降低血清HBV-DNA水平,调控细胞因子的表达,且不良反应未明显增加。

