核桃炭疽病病原菌越冬方式及场所的研究
王雪菲,樊晓亮,王新茹,霍亚蕾,苏筱雨,朱会营,阎爱华,李会平
(1 河北农业大学 林学院,河北 保定 071000;2 河北雾灵山国家级自然保护区管理中心,河北 承德 067300;3 天域生态环境股份有限公司,上海 200082)
核桃(JuglansregiaL. )为胡桃科(Juglandaceae)胡桃属(Juglans),属多年生落叶乔木,世界四大坚果之一,有“木本油料王”之称[1-2]。因核桃具有很高的营养和药用、经济价值,使得人们对核桃的需求量越来越大,全球核桃种植面积逐年扩大[3-5]。核桃炭疽病是危害核桃的主要病害之一,主要为害果实、叶片等,具有潜伏期长、爆发性强、发病时间短等特点,严重时落果率达85%以上,严重影响核桃的质量和产量[6-8]。河北省是核桃生产大省,面积9.7万hm2,产量97万t[2]。近年来,核桃炭疽病在河北省发生面积逐年增加,造成严重的经济损失。但目前生产上还没有有效的防治方法。
越冬是病害侵染循环中的一个重要环节,掌握病原菌的越冬方式及场所,对搞好预测预报及防治有着重要的意义。前人研究表明核桃炭疽病病原菌以分生孢子和菌丝体的形式在病组织上、土壤中越冬,成为第2年病害的初侵染源[7-9]。因此,以核桃不同部位为试材,计算子实体率,统计孢子萌发率,分离病原菌,确定核桃炭疽病病原菌在河北的越冬场所及方式,为制定核桃炭疽病综合防治措施提供理论依据。
1 材料与方法
1.1 采样
2018年12月和2019年3月,在河北省邢台市临城县核桃园内采样,采集核桃树树上发病的带果柄果实和带芽枝条,树下落果、落叶以及表层土。将采集的材料装入无菌纸袋并做好标记带回实验室。
1.2 方法
1.2.1 越冬病原菌子实体观察 将上述采集的不同部位材料,借助放大镜观察是否有核桃炭疽病病原子实体,做好记录。子实体率计算公式如下:
R=P/S×100
(1)
式中,R为子实体率(%),P为带有实体的果实(果柄、果枝、落果、叶片、芽)数,S为总果实(果柄、果枝、落果、叶片、芽)数。
1.2.2 越冬病原子实体萌发测定 从树上果柄、果壳、落果组织上取下子实体,放入装有无菌水的10 mL离心管内,QL-901漩涡器充分震荡,制成孢子悬浮液,每个视野50~80个孢子。将PD培养液和制备好的孢子悬浮液用移液枪各吸取50 μL先后滴加到载玻片上,轻轻混匀。将载玻片放入大培养皿中,用含无菌水棉球保湿。置于30 ℃、RH=95%培养箱中恒温培养。利用显微镜每隔2 h观察1次孢子萌发情况,一直观察24 h。每个处理设置4次重复,每个重复观察5个视野。孢子萌发标准:芽管长度超过孢子直径长度(直径最小的一边)的一半,确定为已经萌发的孢子。计算公式如下:
G=C/T×100
(2)
式中,G为孢子萌发率(%),C为孢子萌发数,T为孢子总数。
1.2.3 越冬病原营养体的分离培养 植物材料中病原菌的分离:每个部位剪成1 cm×1 cm的组织段,共40段。在超净工作台中参照《植病研究方法》进行分离[10]。具体操作如下:将组织段在75%酒精中浸泡30 s,用0.1%HgCl2消毒3 min,无菌水冲洗3次(为检查消毒是否彻底,取100 μL的第3次洗涤液,均匀涂抹在PDA培养基表面,观察是否有微生物长出)。每皿放入4小段,共10皿,25 ℃培养箱中培养。逐日观察长出菌丝的组织段数量及形成菌落的色泽和形状等,对比核桃炭疽病病菌菌落特征,对其他菌类进行排除,做好详细记录。分离率计算公式如下:
I=M/A×100
(3)
式中,I为分离率(%),M为分离得到的病原菌数,A为总分离数。
土壤中病原菌的分离:称取土壤1 g,无菌水9 mL,置于10 mL离心管中,充分震荡,稀释成10-2、10-3浓度的土壤悬浮液。吸取100 μL土壤悬浮液加入含有抗生素的PDA培养基中,用涂布器涂抹均匀。倒置在25 ℃培养箱中培养。每个处理重复3次。逐日观察菌落生长情况,做好详细记录, 1 g土壤的含菌量计算公式如下:
F=F1×10×D
(4)
式中,F为1 g土壤含菌量,F1为100 μL土壤悬浮液含菌量,D为稀释倍数。
2 结果及分析
2.1 子实体在核桃树不同部位的越冬情况
核桃炭疽病菌的子实体在不同部位的着生情况见表1。
表1 不同部位核桃炭疽病菌的子实体着生率
Table 1 Fruiting body occurrence rate of different parts of walnut anthracnose %

时间Time落叶Fallen leaves落果Fruit drop树上果壳Husk onthe boughs树上果柄Fruit stalkon the boughs芽鳞Bud scale枝条Branches2018年12月099.66100.0071.79002019年3月0100.00100.0090.3400
由表1可得,在越冬季节,核桃炭疽病病原菌的子实体主要在落果、树上果壳、果柄中着生,在叶片、枝条以及芽鳞中没有发现病原菌的子实体。在落果、树上果实中的子实体率接近100%,在果柄上的子实体率为71.79%、90.34%。
2.2 不同部位子实体的萌发结果
不同部位核桃炭疽病菌子实体的萌发结果见表2。
表2 不同部位核桃炭疽病菌的子实体萌发率
Table 2 Germination rate of fruiting body of different partsof walnut anthracnose%
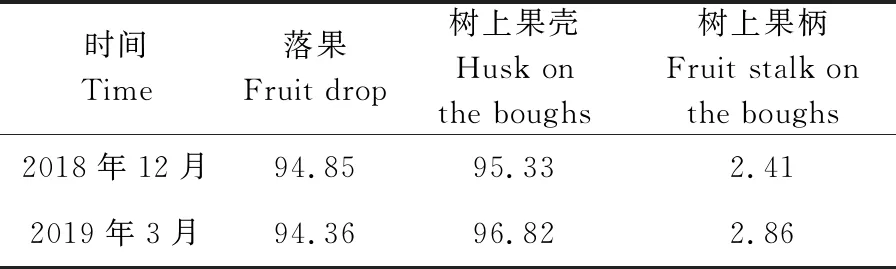
时间Time落果Fruit drop树上果壳Husk onthe boughs树上果柄Fruit stalk onthe boughs2018年12月94.8595.332.412019年3月94.3696.822.86
由表2可知,2018年12月和2019年3月的落果、树上果壳的萌发率在24 h时均为95%左右,果柄萌发率仅有2.5%左右。表明越冬期间子实体内的孢子在落果、树上果壳中保持较高的萌发率,可以作为第2年初侵染源。
2.3 病原菌营养体在不同部位的越冬情况
2.3.1 植物组织中病原菌的分离 不同植物组织中核桃炭疽病菌的分离情况见表3。从表3中可以看出,利用PDA培养基对不同组织进行病原菌营养体的分离,2次采集的组织均可分离出核桃炭疽病菌。2018年12月试验结果表明:果壳、果仁、果柄、芽鳞、枝条、落果果壳与落果果仁的分离率均在90%以上,而叶片和叶柄的分离率较低,分别为5.83%和40.83%。
表3 不同部位病原菌菌丝体的平均分离率
Table 3 Average isolation rate of pathogenic mycelium from different sites %

时间Time叶片Leaf叶柄Petiole树上果壳Husk onthe boughs树上果仁The tree nuts树上果柄Fruit stalkon the boughs树上芽鳞Bud scale树上枝条Branches落果果壳Husk offruit drop落果果仁Kernelof fruit drop2018年12月5.8340.8399.3898.7595.8797.50100.0096.4493.502019年3月2.5027.5961.2568.7562.5078.7567.2268.7581.25
2019年3月试验结果表明:果壳、果仁、果柄、芽鳞、枝条、落果果壳与落果果仁的分离率均在60%以上,叶柄和叶片的平均分离率较低,分别为2.5%和27.59%。2次试验结果表明,核桃炭疽病病原菌以菌丝体形式在果壳、果仁、果柄、芽鳞、枝条、落果、落叶中越冬。2019年3月的病原菌菌丝体的分离率低于2018年12月,说明低温可以杀死部分病原菌。
2.3.2 土壤中病原菌的分离 土壤中核桃炭疽病菌的分离情况见表4。

表4 不同时间下土壤中病原菌数量Table 4 Number of pathogens in soil at different time 个/g
由表4可知,2018年12月、2019年3月2次试验中,核桃炭疽病病原菌可以在土壤中以菌丝体的形式越冬存活,成为新一年的初侵染来源。
3 结论与讨论
研究表明,核桃炭疽病病原菌能够以子实体形式越冬,主要在核桃发病的果壳和落果上越冬,越冬后子实体萌发率分别为94.36%,96.82%。该病原菌能够以菌丝体的形式越冬,主要在果实、果柄、落果、枝条、芽鳞中越冬,越冬后病原菌分离率达60%~82%,其次是叶柄,病原菌分离率为27.59%。该病原菌能够在土壤中越冬,越冬后1 g土壤中病原菌数量为2.0×105个。了解核桃炭疽病病原菌的越冬方式及场所,对该病害的防治具有重要的指导意义。根据上述研究结果,核桃采收后,结合修剪等工作,清除病弱枝、病果及病叶,以减少初侵染源,是核桃炭疽病防治的重要防治措施。
本研究表明核桃炭疽病病原菌越冬后分离率较高,刘霞研究表明核桃炭疽病菌越冬后分离率较低,病原菌的孢子萌发以及菌丝生长的温度范围为10~40 ℃,研究结果与上述研究不同,可能原因是地理位置和气候特点不同,或病原菌种类不同,或其寄主与生长环境不同等[9]。刘金宇等研究表明核桃叶斑病病原菌以菌丝体的形式在土壤中越冬,不同深度土层中病原菌的数量存在差异,随着土层深度的增加病原菌的数量减少[11]。本研究对核桃炭疽病在林下表层土壤中越冬进行研究,尚未对不同深度的土层分别采样研究,因此核桃炭疽病越冬病原菌在不同土层深度的土壤中数量是否不同有待研究。

