泛素化途径在奶牛乳脂生成过程中的调控作用
刘莉莉,郭爱伟,李青青,2,吴培福,杨亚晋,陈粉粉,李素华,郭盘江,张勤
综 述
泛素化途径在奶牛乳脂生成过程中的调控作用
刘莉莉1,郭爱伟1,李青青1,2,吴培福1,杨亚晋1,陈粉粉1,李素华1,郭盘江1,张勤3
1. 西南林业大学生命科学学院,昆明 650224 2. 云南昆明翔昊科技有限公司,昆明 650204 3. 山东农业大学动物科技学院,泰安 271018
泛素化途径是真核细胞中主要的蛋白质降解途径,其中泛素–蛋白酶体途径主要降解细胞质中的蛋白,溶酶体途径主要降解细胞膜蛋白。研究表明,泛素化途径在奶牛乳腺上皮细胞脂肪酸合成过程中起着关键的调控作用。在脂肪酸摄取过程中,泛素化途径调控异常可导致细胞膜上脂肪酸转运蛋白的泛素化降解受阻,使脂肪酸转运增强,进而增加奶牛乳脂的生成。本文综述了泛素化途径在奶牛乳脂生成过程中对相关蛋白的调控作用,以期为奶牛乳脂性状后续相关研究提供参考和新的思路。
泛素化途径;泛素–蛋白酶体系统;溶酶体系统;乳脂生成;脂肪酸
泛素(ubiquitin, Ub)是一种存在于大部分真核细胞中的多肽,由76个氨基酸组成,可以标记待降解的蛋白质,然后通过泛素化–蛋白酶体和溶酶体途径进行降解,即蛋白质的泛素化降解[1]。泛素化介导了真核细胞中约85%的蛋白质降解,维持了细胞内环境的稳态和细胞器的完整性[2]。已有研究表明,泛素化相关组件在奶牛()乳脂合成过程中发挥重要作用[3,4]。例如,在脂肪酸转运过程中,转运膜蛋白的泛素化有助于乳腺上皮细胞外脂肪酸的转入,使细胞利用更多的脂肪酸合成乳脂;乳腺上皮细胞中的高泛素化水平有助于脂肪酸的从头合成[3];在高糖水平促进乳脂合成过程中,蛋白酶体的活性受限并发现乳腺上皮细胞中的泛素化水平显著上升[5]。研究泛素化在奶牛乳脂生成过程中的生物学功能及作用机制,可为奶牛产奶性状分子机理研究和分子育种提供新的理论依据。本文综述了泛素化途径在奶牛乳脂生成过程中的分子机制,以期为后期的奶牛乳脂相关研究奠定基础。
1 泛素化及泛素化系统
泛素化是通过泛素激活酶E1 (ubiquitin-activating enzyme)、泛素结合酶E2 (ubiquitin-conjugating enzyme)及泛素连接酶E3 (ubiquitin-protein ligase)的共同作用,将泛素蛋白共价结合到靶蛋白质的一种翻译后修饰过程[6~8](图1)。泛素分子共含有7个赖氨酸位点(K):K6、K11、K27、K29、K33、K48和K63,泛素既可以直接连接靶蛋白形成单泛素化和多泛素化,也可以通过彼此不同的残基而形成多聚泛素链,形成靶蛋白的多聚泛素化[9,10]。研究表明,K48位点多聚泛素化可以介导靶蛋白进入蛋白酶体被降解[11~13],K63位点多聚泛素化则参与包括细胞抗性、DNA损伤修复和翻译调节等多种生物学过程发挥信号通路功能而不会被降解[14~16]。K63位点的单泛素化则可以通过内体蛋白分选转运装置(endosomal sorting complexes required for transport, ESCRTs)参与胞吞胞吐、蛋白质运输及DNA修复等过程,最终被溶酶体降解[16,17]。泛素化修饰也是可逆的,去泛素化酶(deubiquitinating enzyme, DUB)可以识别泛素化蛋白并将泛素单体或多聚体水解出去,使泛素重新进入循环途径[18,19],因此在免疫调控、基因转录激活和内吞途径中都发挥了重要作用[20~22]。研究表明,泛素化通过泛素–蛋白酶体途径和溶酶体途径在细胞中的蛋白质降解和运输[23,24]、细胞周期调控[25]、免疫应答[26]、细胞增殖和凋亡[27,28]以及外泌体[29]等途径中都发挥着至关重要的作用。
图1 泛素与底物蛋白结合示意图
Fig. 1 The basics of the ubiquitin-conjugation pathway
E1:泛素激活酶;E2:泛素结合酶;E3:泛素连接酶;Ub:泛素蛋白;Substrate:底物蛋白;DUB:去泛素化酶。底物蛋白在泛素激活酶E1、泛素结合酶E2和泛素连接酶E3的作用下连接上泛素蛋白,完成蛋白质的泛素化过程;又可以在去泛素化酶DUB的作用下完成去泛素化,使得泛素蛋白回到循环途径。
1.1 泛素–蛋白酶体系统
泛素–蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要途径,高效地参与了细胞中至少80%的蛋白质降解[30]。26S蛋白酶体存在于细胞核和细胞质中,是由一个20S核心蛋白酶体和两个19S调节蛋白酶体组成的蛋白复合物。其中,20S核心蛋白酶体是起到主要催化作用的复合体,它可以发挥肽基谷氨酰肽水解酶样、胰蛋白酶样和糜蛋白酶样的3种蛋白酶体活性,可将泛素化蛋白质水解为7~9个氨基酸长度的缩氨酸,泛素则在去泛素化酶的作用下进入循环途径[31,32]。泛素–蛋白酶体系统可以降解细胞中调节蛋白,参与细胞凋亡、转录调节及生长代谢途径,以控制细胞的生命活动[27,30,33,34];同时该系统还可以降解细胞中突变、损伤和错误折叠的蛋白质,以维持细胞的稳态[35]。例如,热休克蛋白70 (heat shock protein 70, HSP70)在奶牛应激过程中发挥着非常重要的作用[27,36],该蛋白可以识别并结合到错误折叠的蛋白质上并引导泛素蛋白的连接,以促进其被泛素–蛋白酶体系统降解。此外,热休克蛋白HSP27和HSP90也可以通过引导蛋白质I-κBα (NFKB inhibitor alpha)磷酸化后的泛素化降解,激活NF-κB (nuclear factor kappa B)信号通路,进而在奶牛乳房炎等炎症反应中起到重要作用[ 36]。
1.2 溶酶体系统
溶酶体系统是降解细胞中膜蛋白和细胞器的主要途径,又称为自噬(大自噬),是广泛存在于真核细胞中的生物学过程。泛素化修饰在膜蛋白和细胞器的转运过程中可以标记需要降解的膜蛋白质,然 后内体蛋白分选转运装置ESCRTs挑选出泛素化的膜蛋白并将其转运至多小泡内体(multivesicular endosome, MVE),在与周边的膜结构分离后,最终转运至溶酶体进行降解[37]。ESCRTs复合体是由ESCRT 0、ESCRT І、ESCRT II和ESCRT III共4个复合物构成(图2),其中ESCRT 0、ESCRT I和ESCRT II复合物都含有能与泛素蛋白结合的亚基,因此它们能直接与泛素化修饰的蛋白结合。当ESCRT 0复合物识别泛素化膜蛋白后,即可依次召集ESCRT I和ESCRT II促进内体膜发生内陷并将膜蛋白进行包裹;同时去泛素化酶DUBs也被召集水解膜蛋白上的泛素分子使其循环利用[38,39]。研究表明,ESCRTs复合体联合泛素化共同介导细胞内膜蛋白的降解而参与细胞分化、细胞因子受体激活和细胞代谢等途径[27,40~42]。例如在细胞面临致病菌或病毒的入侵时,溶酶体途径即可通过识别、包裹和融合等过程将其进行降解;对于已经入侵宿主细胞的病毒,宿主细胞则可以通过分泌干扰素来上调细胞内溶酶体系统信号通路,进而加快对其的降解水平[43,44]。因此溶酶体系统在细胞内具有非常重要的作用。
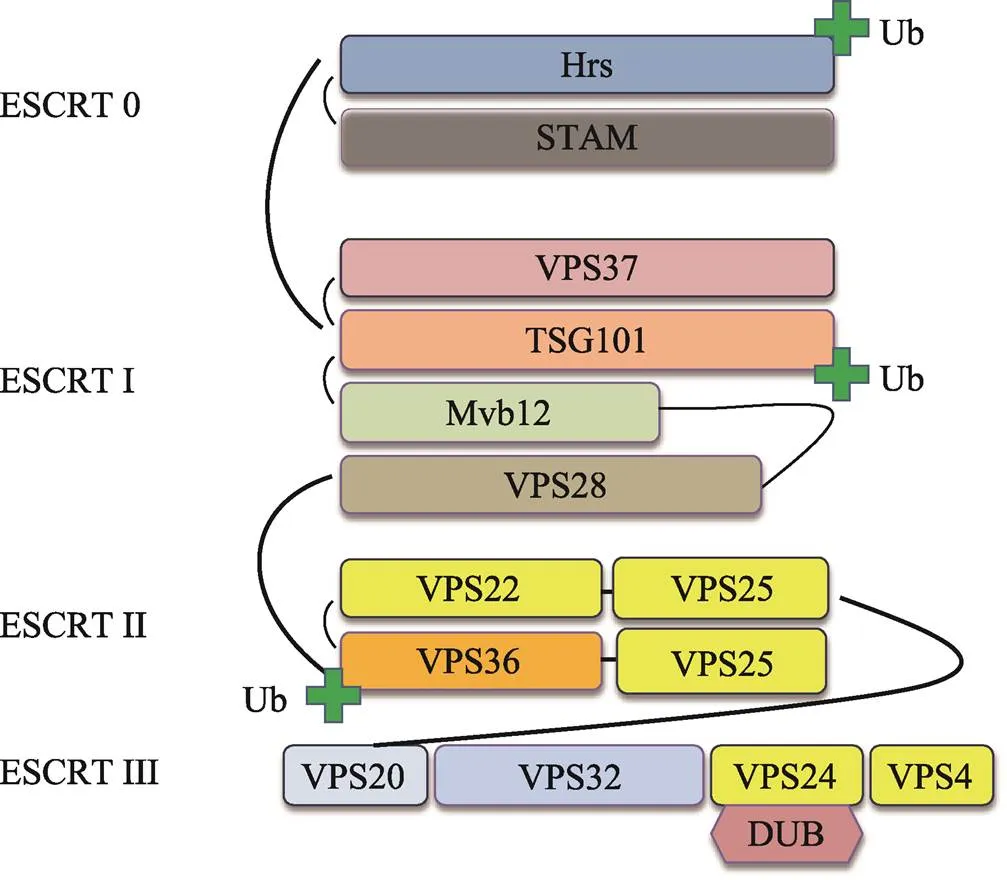
图2 内体蛋白分选转运装置复合体ECSRTs的分子结构
Ub:泛素蛋白结合结构域;DUB:去泛素化酶识别位点;黑色曲线:蛋白质的相互连接。内体蛋白分选转运装置复合体ECSRTs由ESCRT 0、ESCRT І、ESCRT ІІ和ESCRT ІІІ共4个复合体构成。图中用黑色曲线表示4个复合体之间通过蛋白质相互作用而召集在一起,并通过ESCRT 0和ESCR TІ的泛素蛋白结合结构域识别并结合泛素化膜蛋白,通过ESCRT ІІІ的去泛素化酶识别位点识别去泛素化酶。
2 泛素化与乳脂生成
牛奶中乳脂含量约3%~5%,是衡量牛奶品质的重要指标。乳脂的主要成分是甘油三酯(triglyceride, TG) (约99%)[45],是由奶牛乳腺组织的乳腺上皮细胞吸收脂肪酸或者利用前体小分子从头合成脂肪酸后合成脂肪滴,并由磷脂膜包被形成乳脂肪球从乳腺上皮细胞释放到牛奶中[46,47]。乳腺上皮细胞可以直接利用血液中的18~24个碳原子的游离长链脂肪酸合成甘油三酯形成乳脂小球,该过程在奶牛泌乳期前30天占主导位置;也可以利用乙酸和丙酸等前体小分子从头合成4~14个碳原子的短链和中链脂肪酸,合成甘油三酯再形成乳脂小球,该过程在奶牛泌乳期第2个星期开始,并于第30天达到主导位置直至泌乳期结束。除此以外,血液中有少量的短、中链游离脂肪酸可被动扩散进入乳腺上皮细胞,被用于甘油三酯形成乳脂小球[46,48]。无论是直接吸收的脂肪酸还是从头合成的短、中链脂肪酸,都需要经过细胞中一系列酶的作用进行转运、活化、延长和去饱和等作用,最终才能合成甘油三酯。因此,乳脂的生成过程需要一系列受体配体结合、转运载体和酶类的精准调控,而这些分子的激活和降解则需要泛素化过程的调控。
2.1 泛素化与长链脂肪酸转运
奶牛乳腺上皮细胞不能合成大于16碳原子的长链脂肪酸,几乎全部来源于细胞外吸收。血液中的极低密度脂蛋白和乳糜微粒通过脂蛋白脂肪酶LPL (lipoprotein lipase)水解为甘油和游离脂肪酸,其中少量短、中链脂肪酸可通过被动扩散方式进入乳腺上皮细胞,长链脂肪酸则需要经过乳腺上皮细胞上的脂肪酸转运蛋白将其转运进细胞中。反刍动物的长链脂肪酸转运蛋白主要是脂肪酸转运蛋白FAT/CD36,CD36作为细胞膜上的乳脂球膜蛋白,可以通过翻转作用将细胞外游离的长链脂肪酸转运进细胞中[46]。进入细胞中的长链脂肪酸则通过长链酯酰CoA酶ACSL1 (long chain fatty acid CoA ligase 1)与脂肪酸结合蛋白FABP3 (fatty acid binding protein 3)相结合[45,46]。脂肪酸结合酶 FABP3通过将脂肪酸从细胞膜运输内质网中进行甘油三酯和磷脂的合成以参与脂肪酸的细胞内转运过程[46]。在脂肪酸转运过程中,CD36,ACSL1及FABP3在调节长链脂肪酸转运和细胞内长链脂肪酸的浓度时起着至关重要的作用[49]。
研究发现,仓鼠()卵巢细胞CHO和人()胚肾293细胞中脂肪酸的含量可以显著促进CD36蛋白第48和63位赖氨酸的泛素化过程[50],这说明CD36蛋白可直接受泛素化信号通路调控。Liu等[3]证实,敲降内体蛋白分选转运装置复合体ESCRTs中的亚单位VPS28 (vacuolar protein sorting 28),可导致奶牛乳腺上皮细胞中CD36蛋白的泛素化水平升高。这表明蛋白CD36作为细胞膜蛋白是通过溶酶体途径调控降解,同时也说明细胞膜蛋白CD36可以通过溶酶体途径调控长链脂肪 酸的转运。Kan等[51]在肝癌细胞HepG2细胞中发 现花生四烯酸可以促进长链酯酰CoA酶ACSL4 (long chain fatty acid CoA ligase 4)的泛素化和蛋白酶体降解过程。Chung等[52]在小鼠()骨骼肌C2C12细胞中发现脂肪酸结合蛋白FABP3是类泛素化SUMO化(small ubiquitin-like modifier)调控的目标;刘莉莉等[4]发现,抑制奶牛乳腺上皮细胞中蛋白酶体活性而提高细胞中泛素化水平后,和两个基因的mRNA表达水平显著上升(<0.05),同时还发现细胞中长链脂肪酸的含量显著上升。这些研究表明奶牛乳腺上皮细胞中的长链酯酰CoA酶ACSL1和脂肪酸结合蛋白FABP3受泛素–蛋白酶体系统调控,同时也说明ACSL1和FABP3可以通过泛素化途径调节细胞内长链脂肪酸的浓度。因此,在长链脂肪酸的转运过程中,泛素化首先通过溶酶体途径调控长链脂肪酸的转入,再通过泛素–蛋白酶体途径调控细胞内脂肪酸的转运,进而影响长链脂肪酸生成甘油三酯的能力。具体过程见图3泛素化与长链脂肪酸转运部分。
2.2 泛素化与脂肪酸从头合成及脂肪滴形成
乳腺上皮细胞中约50%的中、短脂肪酸是利用乙酸和丁酸等前体小分子进行从头合成的[53]。脂肪酸从头合成主要是在乙酰辅酶A羧化酶ACACA (acetyl-CoA carboxylase)和脂肪酸合成酶FASN (fatty acid synthase)的作用下完成[46]。乙酰辅酶A羧化酶ACACA作为脂肪酸从头合成的限速酶,主要催化乙酰辅酶A羧化合成丙二酸单酰辅酶A,由此开启脂肪酸的合成。脂肪酸合成酶FASN则主要负责将丙二酸单酰辅酶A继续延长合成中/长链饱和脂肪酸(C4:0-C16:0)[54]。这些从头合成的脂肪酸又在酯酰CoA酶ACSL和脂肪酸结合蛋白FABP3等酶系的作用下被转运至内质网中进行甘油三酯和磷脂的合成。甘油二酯酰基转移酶DGAT1 (diacylglycerol acyltransferase 1)和酰基辅酶A去饱和酶SCD (Stearoyl-CoA desaturase)是内质网中合成甘油三酯的限速酶,可以通过变构效应被甘油二酯特异激活[46,55]。在内质网中,脂肪酸逐步通过甘油二酯酰基转移酶DGAT1和酰基辅酶A去饱和酶SCD等酶系的作用合成甘油三酯,随后在内质网小叶中形成并累积成脂肪滴,在质膜包被及脂肪分化相关蛋白ADFP (adipose differentiation-related protein)等协助下被分泌到腺泡中,脂肪分化相关蛋白ADFP是细胞中脂肪滴表面蛋白,不仅是脂质蓄积的特异性标志[56,57],还可以促进脂肪滴与细胞膜上受体的结合,最后通过细胞的顶浆膜将脂肪滴释放到细胞外形成乳脂[46,47,58,59]。
研究表明,乙酰辅酶A羧化酶ACACA和脂肪酸合成酶FASN两个基因的转录因子是固醇调节元件结合蛋白SREBP-1 (sterol regulatory element binding protein 1)[60,61]。固醇调节元件结合蛋白SREBP-1在连接靶基因后,可以通过招募糖原合成酶激酶GSK3 (glycogen synthase kinase 3)发生磷酸化,进而可以招募泛素连接酶SCF-Fbw7,使其被泛素化并通过泛素–蛋白酶体系统进行降解[62~64]。这也提示了泛素化可以间接影响乙酰辅酶A羧化酶ACACA和脂肪酸合成酶FASN的表达而调控脂肪酸的从头合成。脂肪分化相关蛋白ADFP是脂肪滴表面蛋白,在肾透明细胞癌中研究中发现泛素连接酶Mul1可以识别ADFP并调控其进行泛素化降解[65]。Liu等[3]和刘莉莉等[4]发现抑制奶牛乳腺上皮细胞中蛋白酶体活性后,乙酰辅酶A羧化酶的mRNA表达量显著下调(<0.05),但脂肪酸合成酶的mRNA表达量显著上调(<0.05),这也在一定程度上证实了泛素化可以通过影响乙酰辅酶A羧化酶ACACA和脂肪酸合成酶FASN的表达而调控脂肪酸的从头合成;Liu等[3]和刘莉莉等[4]还通过干扰奶牛乳腺上皮细胞中VPS28的表达而影响内体蛋白分选转运装置复合体ESCRTs的稳定性,进而发现细胞中的ADFP有明显的蓄积,同时通过电子显微镜观察到细胞中有大量脂肪滴蓄积,这也说明脂肪分化相关蛋白ADFP是受泛素–溶酶体系统调控降解。因此,在脂肪酸从头合成过程中,泛素化可以通过泛素–蛋白酶体途径调控转录因子SREBP-1而影响乙酰辅酶A羧化酶ACACA和脂肪酸合成酶FASN的表达,从而影响乙酸或丁酸等前体小分子生成脂肪酸的过程,然后再通过泛素–蛋白酶体途径调控细胞内长链脂肪酸的生成和转运,以及最后长链脂肪酸生成甘油三酯的过程。具体过程见图3泛素化与脂肪酸从头合成部分。

图3 泛素化与乳脂合成的分子调控
奶牛乳腺上皮细胞中甘油三酯的合成过程主要有两个过程:长链脂肪酸的直接合成和脂肪酸从头合成。在长链脂肪酸合成乳脂过程中,泛素化通过溶酶体途径调控长链脂肪酸的转入,并通过类泛素化SUMO化影响长链脂肪酸的细胞内转运;在脂肪酸从头合成过程中,泛素化通过泛素–蛋白酶体途径调控乙酸或丁酸等小分子生成脂肪酸的过程,并影响细胞中脂肪酸链的延长和转运;在乳脂生成的最后过程中,泛素化通过泛素–蛋白酶体系统影响乳脂滴的最后形成。
3 结语与展望
泛素化途径在脂肪酸代谢和甘油三酯合成过程中都发挥重要作用。泛素化–蛋白酶体和溶酶体途径中的相关组件或调控发生异常都可导致奶牛乳腺上皮细胞中泛素化水平的改变进而直接影响脂肪酸的转运和从头合成、脂肪滴的形成和乳脂的最后生成。然而,目前对泛素化是如何诱导乳脂相关蛋白质的泛素化降解、这些蛋白质的泛素化类型以及泛素化涉及的酶的生化特性和亚细胞定位及其底物都知之甚少,而这些都是阐明泛素化介导的乳脂生成调控机制的基础,需要大量的研究。因此,深入研究泛素化途径在奶牛乳脂生成过程中发挥的生物学功能及其具体作用方式和机制,有望揭示泛素化信号通路调控乳脂合成的新机制,并为泛素化信号通路在其他奶牛生产性状或其他畜禽生产性状的作用机制研究提供参考。
[1] Metin C, Luccardini C. Neuroscience. Ubiquitination inhibits neuronal exit., 2010, 330(6012): 1754–1755.
[2] Shi Y, Chan DW, Jung SY, Malovannaya A, Wang Y, Qin J. A data set of human endogenous protein ubiquitination sites., 2011, 10(5): M110.002089.
[3] Liu L, Zhang Q. Identification and functional analysis of candidate gene VPS28 for milk fat in bovine mammary epithelial cells., 2019, 510(4): 606–613.
[4] Liu LL, Guo AW, Wu PF, Chen FF, Yang YJ, Zhang Q. Regulation of VPS28 gene knockdown on the milk fat synthesis in Chinese Holstein dairy.,2018, 40(12): 1092–1100.刘莉莉, 郭爱伟, 吴培福, 陈粉粉, 杨亚晋, 张勤. 敲降VPS28基因对中国荷斯坦奶牛乳脂合成的调控. 遗传, 2018, 40(12): 1092–1100.
[5] Liu L, Jiang L, Ding XD, Liu JF, Zhang. The regulation of glucose on milk fat synthesis is mediated by the ubiquitin- proteasome system in bovine mammary epithelial cells., 2015, 465(1): 59–63.
[6] Yu Y, Hayward GS. The ubiquitin E3 ligase RAUL negatively regulates type i interferon through ubiquitination of the transcription factors IRF7 and IRF3., 2010, 33(6): 863–877.
[7] Strack B, Calistri A, Accola MA, Palù G, Göttlinger HG. A role for ubiquitin ligase recruitment in retrovirus release., 2000, 97(24): 13063–13068.
[8] Bhoj VG, Chen ZJ. Ubiquitylation in innate and adaptive immunity., 2009, 458(7237): 430–437.
[9] Ikeda F, Dikic I. Atypical ubiquitin chains: new molecular signals. ‘Protein Modifications: Beyond the Usual Suspects’ review series., 2008, 9(6): 536–542.
[10] Tanno H, Komada M. The ubiquitin code and its decoding machinery in the endocytic pathway., 2013, 153(6): 497–504.
[11] Mallette FA, Richard S. K48-linked ubiquitination and protein degradation regulate 53BP1 recruitment at DNA damage sites., 2012, 22(8): 1221–1223.
[12] Hao ZY, Sheng Y, Duncan GS, Li WY, Dominguez C, Sylvester J, Su YW, Lin GH, Snow BE, Brenner D, You-Ten A, Haight J, Inoue S, Wakeham A, Elford A, Hamilton S, Liang Y, Zúñiga-Pflücker JC, He HH, Ohashi PS, Mak TW. K48-linked KLF4 ubiquitination by E3 ligase Mule controls T-cell proliferation and cell cycle progression., 2017, 8: 14003.
[13] He S, Zhang LQ. Research progress in linear ubiquitin modification.,2015, 37(9): 911–917.何珊, 张令强. 线性泛素化修饰研究进展. 遗传, 2015, 37(9): 911–917.
[14] Tang Y, Tu HL, Zhang J, Zhao XQ, Wang YN, Qin J, Lin X. K63-linked ubiquitination regulates RIPK1 kinase activity to prevent cell death during embryogenesis and inflammation., 2019, 10(1): 4157.
[15] Liu CS, Yang-Yen HF, Suen CS, Hwang MJ, Yen JJY. Cbl-mediated K63-linked ubiquitination of JAK2 enhances JAK2 phosphorylation and signal transduction., 2017, 7(1): 4613.
[16] Zhang QY, Zhang YZ, Shen K, Zhang SY, Cao JP. Histone ubiquitylation and its roles in DNA damage response., 2019, 41(1): 29–40.张卿义, 张樱子, 沈凯, 张舒羽, 曹建平. 组蛋白泛素化修饰及其在DNA损伤应答中的作用. 遗传, 2019, 41(1): 29–40.
[17] Ray DM, Rogers BA, Sunman JA, Akiyama SK, Olden K, Roberts JD. Lysine 63-linked ubiquitination is important for arachidonic acid-induced cellular adhesion and migration., 2010, 88(6): 947–956.
[18] Békés M, Okamoto K, Crist SB, Jones MJ, Chapman JR, Brasher BB, Melandri FD, Ueberheide BM, Denchi EL, Huang TT. DUB-resistant ubiquitin to survey ubiquitination switches in mammalian cells., 2013, 5(3): 826– 838.
[19] Clague MJ. Biochemistry: Oxidation controls the DUB step., 2013, 497(7447): 49–50.
[20] Wright MH, Berlin I, Nash PD. Regulation of endocytic sorting by ESCRT-DUB-mediated deubiquitination., 2011, 60(1–2): 39–46.
[21] Rathaus M, Lerrer B, Cohen HY. DeubiKuitylation: a novel DUB enzymatic activity for the DNA repair protein, Ku70., 2009, 8(12): 1843–1852.
[22] Zhu Y, Carroll M, Papa FR, Hochstrasser M, D'Andrea AD. DUB-1, a deubiquitinating enzyme with growth-suppressing activity., 1996, 93(8): 3275–3279.
[23] Leestemaker Y, Ovaa H. Tools to investigate the ubiquitin proteasome system., 2017, 26: 25–31.
[24] Hao YH, Doyle JM, Ramanathan S, Gomez TS, Jia D, Xu M, Chen ZJ, Billadeau DD, Rosen MK, Potts PR. Regulation of WASH-dependent actin polymerization and protein trafficking by ubiquitination., 2013, 152(5): 1051–1064.
[25] Nakayama KI, Nakayama K. Ubiquitin ligases: cell-cycle control and cancer., 2006, 6(5): 369–381.
[26] Malynn BA, Ma A. Ubiquitin makes its mark on immune regulation., 2010, 33(6): 843–852.
[27] Chen K, Cheng HH, Zhou RJ. Molecular mechanisms and functions of autophagy and the ubiq-uitin-proteasome pathway., 2012, 34(1): 5–18.陈科, 程汉华, 周荣家. 自噬与泛素化蛋白降解途径的分子机制及其功能. 遗传, 2012, 34(1): 5–18.
[28] Pickart CM. Mechanisms underlying ubiquitination., 2001, 70: 503–533.
[29] Villarroya-Beltri C, Baixauli F, Mittelbrunn M, Fernández- Delgado I, Torralba D, Moreno-Gonzalo O, Baldanta S, Enrich C, Guerra S, Sánchez-Madrid F. ISGylation controls exosome secretion by promoting lysosomal degradation of MVB proteins., 2016, 7: 13588.
[30] Pohl C, Dikic I. Cellular quality control by the ubiquitin- proteasome system and autophagy., 2019, 366(6467): 818–822.
[31] Smalle J, Vierstra RD. The ubiquitin 26S proteasome proteolytic pathway., 2004, 55: 555– 590.
[32] Bard JAM, Goodall EA, Greene ER, Jonsson E, Dong KC, Martin A. Structure and Function of the 26S Proteasome., 2018, 87: 697–724.
[33] Chen YJ, Wu H, Shen XZ. The ubiquitin-proteasome system and its potential application in hepatocellular carcinoma therapy., 2016, 379(2): 245–252.
[34] Dong LH, Ran ML, Li Z, Peng FZ, Chen B. The role of ubiquitin-proteasome pathway in spermatogenesis., 2016, 38(9): 791–800.董莲花, 冉茂良, 李智, 彭馥芝, 陈斌. 泛素–蛋白酶体途径在精子生成中的作用. 遗传, 2016, 38(9): 791–800.
[35] Ross JM, Olson L, Coppotelli G. Mitochondrial and ubiquitin proteasome system dysfunction in ageing and disease: two sides of the same coin., 2015, 16(8): 19458–19476.
[36] Garrido C, Brunet M, Didelot C, Zermati Y, Schmitt E, Kroemer G. Heat shock proteins 27 and 70: anti-apoptotic proteins with tumorigenic properties., 2006, 5(22): 2592–2601.
[37] Saksena S, Sun J, Chu T, Emr SD. ESCRTing proteins in the endocytic pathway., 2007, 32(12): 561–573.
[38] Odorizzi G. ESCRTs take on a job in surveillance., 2014, 159(2): 240–241.
[39] Shields SB, Piper RC. How ubiquitin functions with ESCRTs., 2011, 12(10): 1306–1317.
[40] Gutierrez MG, Carlton JG. ESCRTs offer repair service., 2018, 360(6384): 33–34.
[41] Majumder P, Chakrabarti O. ESCRTs and associated proteins in lysosomal fusion with endosomes and autophagosomes., 2016, 94(5): 443–450.
[42] Radulovic M, Stenmark H. ESCRTs in membrane sealing., 2018, 46(4): 773–778.
[43] Zhang S, Yu CM, Yin Y, Chen W. Research progress of the role of autophagy in infectious diseases.,2009, 33(5): 469–472.章晟, 于长明, 殷瑛, 陈薇. 细胞自噬在病原体感染过程中的作用研究进展. 军事医学科学院院刊, 2009, 33(5): 469–472.
[44] Espert L, Codogno P, Biard-Piechaczyk M. Involvement of autophagy in viral infections: antiviral function and subversion by viruses., 2007, 85(8): 811–823.
[45] Walther TC, Farese RV. The life of lipid droplets., 2009, 1791(6): 459–466.
[46] Bionaz M, Loor JJ. Gene networks driving bovine milk fat synthesis during the lactation cycle., 2008, 9: 366.
[47] Reinhardt TA, Lippolis JD. Bovine milk fat globule membrane proteome., 2006, 73(4): 406–416.
[48] Doege H, Stahl A. Protein-mediated fatty acid uptake: novel insights frommodels., 2006, 21: 259–268.
[49] Bionaz M, Loor JJ. ACSL1, AGPAT6, FABP3, LPIN1, and SLC27A6 are the most abundant isoforms in bovine mammary tissue and their expression is affected by stage of lactation., 2008, 138(6): 1019–1024.
[50] Smith J, Su X, El-Maghrabi R, Stahl PD, Abumrad NA. Opposite regulation of CD36 ubiquitination by fatty acids and insulin: effects on fatty acid uptake., 2008, 283(20): 13578–13585.
[51] Kan CF, Singh AB, Stafforini DM, Azhar S, Liu J. Arachidonic acid downregulates acyl-CoA synthetase 4 expression by promoting its ubiquitination and proteasomal degradation., 2014, 55(8): 1657–1667.
[52] Chung SS, Ahn BY, Kim M, Kho JH, Jung HS, Park KS. SUMO modification selectively regulates transcriptional activity of peroxisome-proliferator-activated receptor γ in C2C12 myotubes., 2011, 433(1): 155–161.
[53] Bernard L, Leroux C, Chilliard Y. Expression and nutritional regulation of lipogenic genes in the ruminant lactating mammary gland., 2008, 606: 67–108.
[54] Roy R, Ordovas L, Zaragoza P, Romero A, Moreno C, Altarriba J, Rodellar C. Association of polymorphisms in the bovine FASN gene with milk-fat content., 2006, 37(3): 215–218.
[55] Tao H, Chang GJ, Xu TL, Zhao HJ, Zhang K, Shen XZ. Feeding a high concentrate diet down-regulates expression of ACACA, LPL and SCD and modifies milk composition in lactating goats., 2015, 10(6): e0130525.
[56] McManaman JL, Zabaronick W, Schaack J, Orlicky DJ. Lipid droplet targeting domains of adipophilin., 2003, 44(4): 668–673.
[57] Heid HW, Moll R, Schwetlick I, Rackwitz HR, Keenan TW. Adipophilin is a specific marker of lipid accumulation in diverse cell types and diseases., 1998, 294(2): 309–321.
[58] Heid HW, Keenan TW. Intracellular origin and secretion of milk fat globules., 2005, 84(2–3): 245– 258.
[59] McManaman JL, Russell TD, Schaack J, Orlicky DJ, Robenek H. Molecular determinants of milk lipid secretion., 2007, 12(4): 259–268.
[60] Lopez JM, Bennett MK, Sanchez HB, Rosenfeld JM, Osborne TF. Sterol regulation of acetyl coenzyme A carboxylase: a mechanism for coordinate control of cellular lipid., 1996, 93(3): 1049–1053.
[61] Rudolph MC, Monks J, Burns V, Phistry M, Marians R, Foote MR, Bauman DE, Anderson SM, Neville MC. Sterol regulatory element binding protein and dietary lipid regulation of fatty acid synthesis in the mammary epithelium., 2010, 299(6): E918–E927.
[62] Punga T, Bengoechea-Alonso MT, Ericsson J. Phosphorylation and ubiquitination of the transcription factor sterol regulatory element-binding protein-1 in response to DNA binding., 2006, 281(35): 25278–25286.
[63] Bengoechea-Alonso MT, Ericsson J. A phosphorylation cascade controls the degradation of active SREBP1., 2009, 284(9): 5885–5895.
[64] Han YM, Hu ZM, Cui AY, Liu ZS, Ma FG, Xue YQ, Liu YX, Zhang FF, Zhao ZH, Yu YY, Gao J, Wei C, Li JY, Fang J, Li J, Fan JG, Song BL, Li Y. Post-translational regulation of lipogenesisAMPK-dependent phosphorylation of insulin-induced gene., 2019, 10(1): 623.
[65] Yuan YJ, Li XZ, Xu YY, Zhao HB, Su ZM, Lai DH, Yang WQ, Chen SX, He YZ, Li X, Liu LY, Xu GB. Mitochondrial E3 ubiquitin ligase 1 promotes autophagy flux to suppress the development of clear cell renal cell carcinomas., 2019, 110(11): 3533–3542.
The regulation of ubiquitination in milk fat synthesis in bovine
Lili Liu1, Aiwei Guo1, Qingqing Li1,2, Peifu Wu1, Yajin Yang1, Fenfen Chen1, Suhua Li1, Panjiang Guo1, Qin Zhang3
Ubiquitination signaling is the main pathway of protein degradation in eukaryotic cells. Ubiquitin-proteasome system degrades the ubiquitinated cytoplasmic proteins and lysosome pathway mainly degrades the ubiquitinated membrane proteins. Previous studies have shown that ubiquitination signaling plays a critical role in fatty acids synthesis. In the process of fatty acids import, disruption of ubiquitination could prevent the degradation of fatty acid transport proteins, thereby promoting fatty acids import and milk fat synthesis in bovine primary mammary epithelial cells. In this review, we summarize the signal transduction and regulation mechanism of ubiquitination signaling in milk fat synthesis, which may provide references and new ideas for future research on milk fat traits in dairy cows.
ubiquitination; ubiquitinated-proteasome system; lysosome pathway; milk fat synthesis; fatty acid
2020-02-10;
2020-04-15
国家自然科学基金项目(编号:31902152,31872327)资助[Supported by the National Natural Science Foundation of China (Nos. 31902152, 31872327)]
刘莉莉,博士,讲师,研究方向:动物遗传育种。E-mail: liulily0518@163.com
张勤,博士,教授,研究方向:动物遗传育种。E-mail: qzhang@sdau.edu.cn
10.16288/j.yczz.20-037
2020/5/8 9:58:23
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20200507.1717.004.html
(责任编委: 赵要风)

