载花青素微胶囊的制备及其抗氧化性能
李星宇,刘 港,高逸飞,郭庆中,吴江渝,郑华明
武汉工程大学材料科学与工程学院,湖北 武汉 430205
花青素(anthocyanin,Cy)又名花色素,是一种水溶性天然色素,广泛存在于自然界的各种植物中[1]。目前已知的Cy 有20 多种,如矢车菊素、飞燕草素、牵牛Cy 等。Cy 具有非常强的抗氧化清除自由基的能力,并且作为一种食品添加剂,不仅没有传统食品添加剂的副作用,而且还能软化血管,降低血糖,具有一定的保健功能[2]。但是,Cy 在具有抗氧化性的同时,自身难免易于被空气中的氧气氧化导致活性降低,为了能够提高Cy 的稳定性,利用微胶囊技术对Cy 进行包封是一种很好的途径。
多糖、蛋白质作为天然高分子材料,无毒、易降解,已成为制备微胶囊最广泛使用的壁材[3]。Rutz 等[4]以壳聚糖和果胶为壁材,采用复凝聚法制备了棕榈油微胶囊,在酸乳的生产上得到了很好的应用。Yuan 等[5]以大豆分离蛋白和壳聚糖为原料制备了包封海藻油的微胶囊,发现壳聚糖有助于提高海藻油的包封率和抗氧化稳定性。Svanberg 等[6]以乳清分离蛋白为乳化剂,在越桔油的乳液中加入Cy,发现Cy 对脂肪的氧化具有极强的保护作用。
本文采用天然高分子材料海藻酸钠和壳聚糖对Cy 进行包封,控制氯化钙、海藻酸钠、壳聚糖的质量分数,制备了海藻酸钠-壳聚糖载花青素微胶囊(anthocyanin-loaded microcapsules,CyMCs),分析了CyMCs 的包封率、抗氧化性及形貌特性等。
1 实验部分
1.1 试剂与仪器
海藻酸钠(Medium viscosity)、壳聚糖(low viscosity)(sigma-aldrich 公司);Cy(纯度为25%,以矢车菊-3-葡萄糖苷计),自提取;大孔树脂(AB-8,北京索莱宝科技有限公司);其它用于实验的试剂(分析纯,国药集团试剂有限公司)。
紫外分光光度计(Lambda35,Perkin Elmer),冷冻干燥机(Alpha1-4Dplus,Christ 公司),恒流泵(BT-100-4,上海青浦沪西仪器厂),傅里叶变换红外光谱仪(L1600301,Perkin Elmer)。
1.2 实验方法
1.2.1 微胶囊的制备 取一定量的海藻酸钠和壳聚糖分别加入到去离子水和醋酸水溶液(体积分数1.0%)中,室温条件下,600 r/min 磁力搅拌2 h,得到透明黏稠状溶液,于4 ℃冰箱储存24 h,备用。将一定量的氯化钙加入壳聚糖的醋酸溶液中,搅拌使氯化钙完全溶解。将海藻酸钠溶液经恒流泵通过25G(内径为0.26 mm)的针头,维持针头与液面距离为10 cm,逐滴滴入到壳聚糖/氯化钙溶液中,磁力搅拌(400 r/min)反应30 min,使微胶囊固化成型。布氏漏斗过滤后,冷冻干燥,得到海藻酸钠-壳聚糖空白微胶囊(blank microcapsules,BMCs);取一定量的Cy 溶于海藻酸钠溶液中,搅拌使其分散均匀,制备过程与BMCs 相同,得到海藻酸钠-壳聚糖CyMCs。
1.2.2 材料表征 将样品在105 ℃真空干燥箱中干燥24 h,用溴化钾压片进行傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析。
1.2.3 CyMCs 包封率的测定 采用间接测量法[7],测量未包封的Cy 含量来计算微胶囊的包封率。取制备CyMCs 时的滤液,将其pH 值分别调节至1.0和4.5,在λmax=524 nm 和λ=700 nm 时测吸光度值,根据标准曲线拟合方程y=0.014 6x+0.008 9(x 为Cy 的质量浓度,μg/mL;R2=0.999 02)计算包封率。1.2.4 CyMCs 的抗氧化性测定 配制硫酸亚铁溶液(9.0 mmol/L)、乙醇-水杨酸溶液(9.0 mmol/L)和过氧化氢溶液(8.8 mmol/L)。采用水杨酸法[8]测定包封率最佳条件下的CyMCs 对羟基自由基的清除效果。
2 结果与讨论
2.1 FT-IR 分析
图1 是BMCs,Cy 及CyMCs 的FT-IR 图。由BMCs 的谱线可 见,3 447 cm-1处 是-OH 和-NH2的伸缩振动峰,2 919 cm-1和2 850 cm-1处是-CH和-CH2的伸缩振动峰(此图中省略),1 629 cm-1处是壳聚糖的-NH3+(1 651 cm-1)与海藻酸钠的-COO-(1 613 cm-1)通过静电吸附作用所产生的吸收峰[9];在Cy 的谱线中,1 516 cm-1处是Cy 的B环上2 个-OH 伸缩振动峰,由此可见紫甘蓝富含矢车菊素[10],1 630 cm-1和1 454cm-1处是Cy 苯环中的C=C 伸缩振动[11-12],1 075 cm-1处是Cy 的C 环中C-O-C 的特征吸收峰[12];在CyMCs 的谱线中,可以看到不仅海藻酸钠和壳聚糖对应的吸收峰没有消失,而且还保留了Cy 在1 454 cm-1处的特征吸收峰,说明Cy 被成功包封且未与壁材发生反应。

图1 BMCs、Cy 和CyMCs 的FT-IR 图Fig.1 FT-IR spectra of BMCs,Cy and CyMCs
2.2 影响CyMCs 包封率的因素
2.2.1 海藻酸钠质量分数对包封率的影响 保持壳聚糖质量分数为0.5%,氯化钙质量分数为3%,Cy 加入量为10 mg,搅拌温度为35 ℃,搅拌速率为300 r/min,海藻酸钠的质量分数为0.6%,0.8%,1.0%,1.2%和1.4%的条件下制备微胶囊,并测定其包封率,如图2(a)所示。

图2 不同因素质量分数对包封率的影响:(a)海藻酸钠,(b)氯化钙,(c)壳聚糖Fig.2 Effects of different mass fractions on encapsulation efficiency:(a)alginate,(b)calcium chloride,(c)chitosan
由图2(a)可以看出,当海藻酸钠的质量分数由0.6%增加到1.0%时,包封率相应地从78.8%增加到93%。其原因可能是随着海藻酸钠质量分数的增加,与壳聚糖反应机率上升,形成的微胶囊变得紧实,有利于Cy 的包埋。同时,当Cy 海藻酸钠溶液黏度增加时,增大了溶液对Cy 的束缚作用,使得Cy 流失减少;继续增大海藻酸钠的质量分数,此时参与反应的氯化钙和壳聚糖相对不足,所制备的微胶囊结构比较蓬松而且多孔,容易破裂,在成型过程中造成Cy 过多流失[13],导致包封率从93%下降到84%。同时,当海藻酸钠质量分数过高时,容易造成Cy 海藻酸钠溶液体系黏度过大,不利于与壳聚糖和氯化钙进行反应,导致包封率降低[14]。
2.2.2 氯化钙质量分数对包封率的影响 钙离子作为一种螯合剂,其原子直径为1.14×10-10m,可以与海藻酸钠分子中的古罗糖醛酸残基在海藻酸钠基质内部形成二维的键合结构[15]。当钙离子质量分数较小时,可以形成絮状的无规结构,当钙离子质量分数过高时,可以形成凝胶。实验过程中,保持海藻酸钠质量分数为1.0%,壳聚糖质量分数为0.5%,Cy 添加量为10 mg,搅拌温度为35 ℃,搅拌速率为300 r/min,在氯化钙质量分数为0.25%,0.5%,1.0%,2.0%,3.0%,4.0%和5.0%的条件下制备微胶囊,测定微胶囊的包封率,如图2(b)所示。
由图2(b)可知,当氯化钙质量分数较低时,与海藻酸钠形成的络合点较少,此时虽能成球状微胶囊,但是微胶囊的机械强度偏小,在搅拌和干燥过程中微胶囊容易破裂,导致Cy 的包封率普遍不高;然而,当氯化钙的质量分数从1%增加到5%时,其包封率从97%下降到67%。其原因可能是溶液中的钙离子与海藻酸钠络合的位点越多,形成的海藻酸钙微胶囊的结构越紧密,球形度越好。同时,微胶囊内部空腔的体积也会减小,对微胶囊内部的Cy 溶液形成一定的挤压,导致包封的Cy 被排斥,造成包封率偏低[15]。通过钙离子滴定实验发现,钙离子始终处于过量,不能完全参与海藻酸钠与钙离子的络合反应,因此海藻酸钙微胶囊的包封率与钙离子的质量无关,只与钙离子的质量分数存在一定的关联。
2.2.3 壳聚糖质量分数对包封率的影响 保持海藻酸钠质量分数为1.0%,氯化钙质量分数为1.0%,Cy 添加量为10 mg,搅拌温度为35 ℃,搅拌速率为300 r/min,在壳聚糖质量分数为0.1%,0.3%,0.5%,0.7%和0.9%的条件下制备微胶囊,并测定其包封率,如图2(c)所示。
由图2(c)可知,当壳聚糖质量分数低于0.7%时,体系中可参与反应的壳聚糖处于不饱和状态,此阶段中随着壳聚糖质量分数的增大,更多的与海藻酸钠的-COO-结合,微胶囊壁逐渐变厚,强度增加,使其包封率增加。此后,再增加壳聚糖的质量分数,会有部分壳聚糖分子进入到微胶囊的内部,形成更多的交联点[13],此时微胶囊的机械强度会有一些增加,但是对Cy的包封会出现不利影响。
2.3 CyMCs 的抗氧化特性
取在海藻酸钠质量分数为1.0%,氯化钙质量分数为1.0%,壳聚糖质量分数为0.5%的条件下制备的最佳包封率的CyMCs 进行抗氧化实验,制备样品的包封率为97.42%,载药率为5.4%。CyMCs对羟基自由基的清除率如图3 所示。
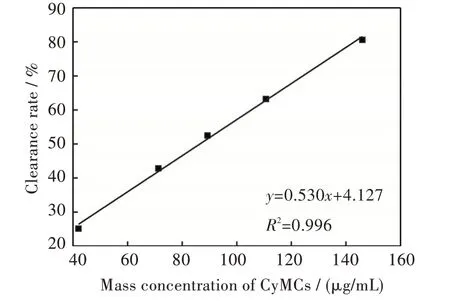
图3 CyMCs 对羟基自由基的清除率Fig.3 Scavenging rate of hydroxyl radical by CyMCs
由图3 可以看出,CyMCs 对羟基自由基存在清除作用,且随着CyMCs 的质量浓度增加,对羟基自由基的清除效果也不断增强,通过拟合曲线y=0.530x+4.127(x 为CyMCs 的质量浓度,μg/mL;R2=0.996)计算得出CyMCs 对羟基自由基的半数清除质量浓度为84 μg/mL。由此可见,实验中所制备的CyMsC 对羟基自由基的清除能力明显要优于食品工业中常用的抗氧化剂抗坏血酸(半数清除质量浓度为622.3 μg/mL)[16]。
2.4 形貌分析
CyMCs 的形貌如图4 所示。由图4 可以看出,CyMCs 与无色透明的空白微胶囊相比,具有鲜艳的色泽,说明微胶囊对Cy 成功进行了包封;从形貌上看,制备的CyMCs 呈球形,表面光滑,大小均一。在湿态情况下,微胶囊的直径约为3 mm;在干态情况下,微胶囊的直径约为1.3 mm。冷冻干燥后的CyMCs 有所收缩,表面变得有些粗糙,其原因是海藻酸钠和壳聚糖聚电解质复合膜形成了不规则的纤维化表面[17]。但囊壁结构维持完整,保持了一定的机械强度,实现了微胶囊对Cy 的包封。

图4 CyMCs 微胶囊的形貌:(a)湿态,(b)冻干后Fig.4 Morphologies of CyMCs:(a)wet state,(b)after freeze-drying
3 结 论
利用微胶囊技术对Cy 成功进行了包封,通过单因素实验,确定在海藻酸钠质量分数为1.0%,氯化钙质量分数为1.0%,壳聚糖质量分数为0.5%时,制备的CyMCs 包封率最高可达97.42%;对CyMCs 进行了抗氧化性实验表明,CyMCs 对羟基自由基清除率达50%时的质量浓度为84 μg/mL。将Cy 微囊化达到了提高Cy 稳定性的目的,可延长易氧化食品的保质期。

