四氢生物蝶呤与恶性肿瘤关系的研究进展
朱彩云, 陈 勇
(1. 扬州大学, 江苏 扬州, 225000; 2. 扬州大学临床医学院 肿瘤科, 江苏 扬州, 225000)
恶性肿瘤严重威胁人类的生命健康,已成为人类死亡的第二大原因[1]。恶性肿瘤的发生机制复杂,是一个多因子、多步骤的复杂过程,分致癌、促癌、演进3个阶段,与吸烟、感染、职业暴露、环境污染、不合理膳食、遗传等因素密切相关,在分子机制上涉及DNA损伤,原癌基因活化,抑癌基因抑制,DNA修复基因及凋亡调节基因异常表达[2-3], 免疫检查点分子异常表达[4]等过程。恶性肿瘤机制的相关研究一直是临床热点,近年来有研究[5]表明四氢生物蝶呤(BH4)在促进肿瘤血管生成中起作用。BH4是芳香族氨基酸羟化酶及一氧化氮合酶的辅酶,参与机体一系列生理和病理过程[6], 如单胺类神经递质的合成[7]、血管内皮细胞功能调节[8]、疼痛传导[9]、心血管疾病[10]、肿瘤发生发展等。目前关于BH4在血管内皮功能障碍[11]、心肌损伤[12]、高血压[13]、糖尿病[14]等疾病中作用机制的研究众多,但关于BH4与恶性肿瘤关系的报道则较少。现将BH4与恶性肿瘤关系的相关研究进展综述如下,旨在为深入探讨恶性肿瘤新型治疗途径提供一定的理论依据。
1 BH4的合成及生物学功能概述
1.1 BH4的合成
BH4是一类低分子量(241.25 Da)的非蛋白质有机化合物,通过从头合成、补救合成途径及循环途径在细胞浆内合成[15-16]。生理条件下, BH4主要通过从头合成途径合成[17]。从头合成途径有3个限速酶,分别是三磷酸鸟苷环化水解酶1(GTPCH1或GCH1)、6-丙酮酰四氢蝶呤合成酶(PTPS)及墨蝶呤还原酶(SPR)。底物三磷酸鸟苷(GTP)被GTPCH1催化形成7, 8-二氢三磷酸新蝶呤,随后被PTPS转化为6-丙酮-5, 6, 7, 8-四氢蝶呤,最后在SPR的作用下被还原为BH4。BH4也可通过补救途径合成,即以墨蝶呤为底物在SPR作用下转化为7, 8-二氢生物蝶呤(BH2), 再进一步被二氢蝶呤还原酶(DHFR)还原为BH4。BH4还可以通过循环途径合成,即BH4在酶促反应过程中被氧化成4α羟-四氢生物蝶呤,再被蝶呤-4α-二甲醇胺脱水酶(PCD)还原成BH2, 最后被DHFR还原成BH4。见图1。
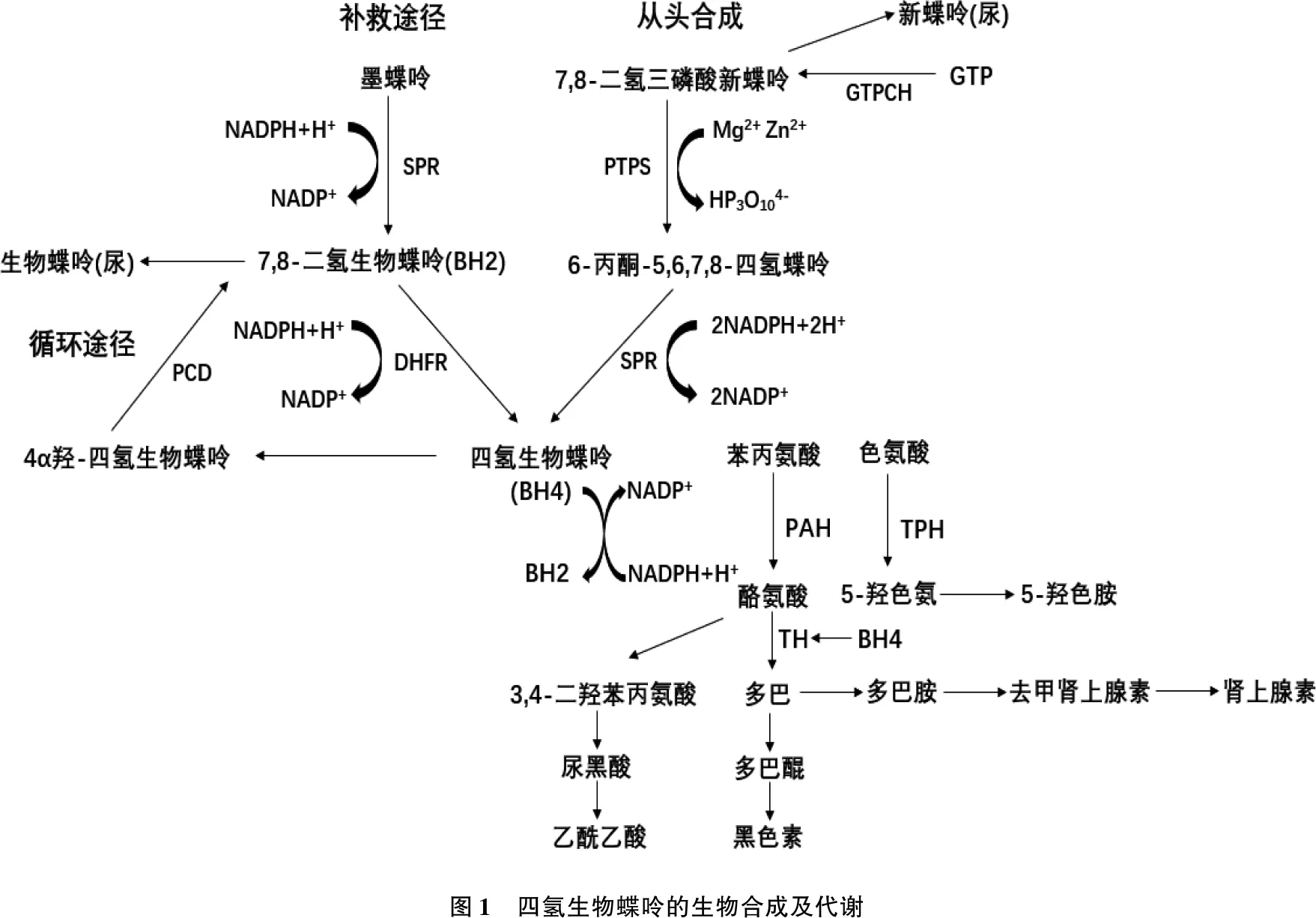
图1 四氢生物蝶呤的生物合成及代谢
1.2 BH4的生物学功能
BH4最早作为芳香族氨基酸羟化酶(AAAH)的辅酶被认知,其不仅是苯丙氨酸羟化酶(PAH)、烷基甘油单加氧合酶(AGMO)、酪氨酸羟化酶(TH)及色氨酸羟化酶(TPH)的重要辅酶,还是一氧化氮合酶(NOS)的重要辅助因子,在酶促反应中作为递电子体起还原剂的作用,具有抗氧化和清除活性氮氧化物的功能,在体内一系列生理和病理过程中起关键作用[4]。BH4不仅参与苯丙氨酸代谢和多巴胺、5-羟色胺、去甲肾上腺素、肾上腺素及一氧化氮(NO)等的生物合成[18-19], 也能够在改善糖尿病性血管内皮功能障碍[20]、抵抗心肌缺血/再灌注损伤[21]、治疗疼痛[22]、改善肺动脉高压[23]等方面发挥作用。
2 BH4与恶性肿瘤的关系
2.1 BH4的促瘤作用
2.1.1 BH4通过促进NO生成来促进肿瘤血管形成: Chen LY等[5]进行的小鼠实验显示,墨蝶呤能够促进内皮型一氧化氮合酶(eNOS)及蛋白激酶B(Akt)的磷酸化,此磷酸化依赖PI3K信号通路的激活,而PI3K信号通路的激活则需要通过调节野生型ras基因的表达来完成,同时,野生型ras基因蛋白表达及PI3K/Akt信号通路的激活可被NO调控。表达三磷酸鸟苷环化水解酶(GTPCH)基因的小鼠的移植瘤体积较对照组显著增大, Ki-67及CD34的表达水平均较对照组显著增高(P<0.05)。由此说明,BH4的合成代谢可以促进内皮细胞的增殖、迁移及小管形成,并在异种移植瘤中诱导血管生成。这些效应与eNOS介导的NO生成有关,而NO的生成又促进了野生型ras及下游PI3K/Akt/eNOS信号通路效应分子的激活从而进一步促进NO的生成,形成正反馈。Dai YG等[24]探讨了BH4在促进肝癌细胞血管生成中的作用。已有研究[25]证实, NO可以促进血管内皮细胞增殖、迁移和分化,从而促进肿瘤新生血管形成。Dai YG等[24]给予实验组小鼠BH4进行细胞培养及腹腔内注射治疗,对照组小鼠则给予生理盐水进行细胞培养及腹腔内注射治疗,结果显示,实验组的细胞微血管形成率、肿瘤体积、肿瘤组织微血管密度、肿瘤组织BH4水平、肿瘤组织中NO水平、K-ras基因的 mRNA 表达水平、eNOS和Akt蛋白磷酸化水平以及GTPCH蛋白表达水平均较对照组显著更高(P<0.01)。由此表明, BH4可以促进ras基因的激活,并促进eNOS和Akt磷酸化,促进NO产生,诱导肝脏肿瘤新生血管生成。
2.1.2 BH4通过促进组织内转化生长因子β结合蛋白1(LTBP1)的亚硝基化来促进肿瘤细胞生长: Zhao Q等[26]发现PTPS蛋白表达水平在早期大肠癌中明显升高。低氧环境下腺苷酸活化蛋白激酶(AMPK)介导了PTPS的磷酸化,此磷酸化促进PTPS与LTBP1的结合,并且PTPS与LTBP1的结合及相互作用进一步促进诱导型一氧化氮合酶(iNOS)与LTBP1的结合。在PTPS-LTBP1-iNOS复合物中,PTPS介导的BH4的产生促进了iNOS的活化即NO的产生,而NO有效促进了LTBP1蛋白的S-亚硝基化,增强LTBP1蛋白的不稳定性,导致其降解增加,从而减少转化生长因子β(TGF-β)的分泌。人体内NO除了作为神经递质传递信号外,还通过介导蛋白S-亚硝基化参与细胞信号通路的调节[27]。蛋白质的S-亚硝基化影响其稳定性、活性以及蛋白质间的相互作用[28]。TGF-β是细胞因子超家族成员,在细胞增殖、分化及血管形成、胚胎发育、免疫调节等生理或病理过程中起着重要作用[29]。TGF-β具有早期抑瘤和晚期促瘤的双重功能[30-31]。LTBP1的主要生物学功能是促进TGF-β的分泌[32-33]。在早期结肠癌组织中,PTPS/iNOS介导的LTBP1的下调最终抑制了TGF-β的分泌并解除TGF-β诱导的细胞生长抑制,从而维持并促进了肿瘤细胞的生长。
2.2 BH4的抑瘤作用
Cronin SJF等[34]报道了GCH1、SPR及BH4对T细胞免疫的调节作用。GCH1的失活和SPR的抑制会阻碍小鼠和人T细胞的增殖。体内阻断BH4的合成可消除T细胞介导的自身免疫和过敏性炎症反应。通过GCH1过表达导致的BH4合成水平的升高可增强CD4+和CD8+T细胞的免疫应答并增强其在体内的抗肿瘤活性。接受BH4给药的小鼠的移植瘤体积显著减小,其瘤内效应T细胞数量明显增多。由此表明,BH4的合成代谢能够通过增强T细胞免疫起到抑制肿瘤的作用。
2.3 BH4的早期抑瘤及晚期促瘤作用
Melo F等[35]进行了BH4与黑色素瘤的相关研究,结果显示黑色素瘤细胞较正常黑色素细胞有更高水平的GCH1基因转录及蛋白表达,并且只在转移性Wm983黑色素瘤细胞中观察到高水平的BH4。Wm1552黑色素瘤细胞系中BH4的水平降低,此与放射生长的黑色素瘤细胞相关。在Wm1552和Wm983细胞系中观察到氧浓度升高,而在Wm1552细胞系中观察到NO水平下降。BH4处理过的Wm1552细胞系以及2, 4-二胺-6-羟基嘧啶(DAHP)处理过的Wm983细胞系的活性及克隆能力均降低。由此表明,在黑色素瘤的早期阶段BH4起到抑癌作用,在晚期转移阶段则起到促癌作用。
3 小 结
综上所述,调控NO产生的BH4的合成代谢能够促进肿瘤生长,但BH4也能通过增强细胞毒性T细胞的活性起到抑制肿瘤的作用。BH4显示出抑癌与促癌的双重作用,此相悖结论提示BH4在恶性肿瘤发生发展中所扮演的角色仍需进一步探讨,未来亟待启动更多有关BH4代谢机制的实验研究,而干扰BH4合成代谢途径有望成为治疗恶性肿瘤的一个新手段。

