临床药师参与1例肺淋巴管平滑肌瘤病合并癫痫的药物治疗
卢克鹏 金美玲 蔡映云 吕迁洲 叶晓芬
摘 要 1例40岁女性患者因肺淋巴管平滑肌瘤病合并癫痫就诊呼吸科门诊。门诊予西罗莫司片治疗1.5月后,测西罗莫司血药浓度偏低。临床药师从该患者癫痫发作情况、抗癫痫药物特点和患者自身因素三方面综合分析后,认为引起该药血药浓度偏低的原因是其与卡马西平之间存在相互作用,但不建议调整西罗莫司的给药剂量,可将卡马西平更换为对西罗莫司药动学影响较小的丙戊酸,同时需在丙戊酸剂量增加至治疗水平后再逐渐减少卡马西平的剂量,以防止在换药期间出现突然癫痫发作或癫痫持续状态。最后该患者在继续服用卡马西平片的基础上,开始服用丙戊酸钠片,在丙戊酸剂量增加至治疗水平后逐渐递减卡马西平剂量直至完全停用卡马西平片。
关键词 肺淋巴管平滑肌瘤病 癫痫 西罗莫司 卡马西平 丙戊酸
中图分类号:R971.6; R969.2 文献标志码:C 文章编号:1006-1533(2020)11-0080-03
Clinical pharmacists participate in the drug therapy of a patient with lymphangioleiomyomatosis and epilepsy
LU Kepeng1*, JIN Meiling2, CAI Yingyun3, LYU Qianzhou3, YE Xiaofen3**
(1. Department of Pharmacy, the First Hospital affiliated to Henan University of Science and Technology, Henan Luoyang 471000, China; 2. Department of Respiratory, Zhongshan Hospital, Fudan University, Shanghai 200032, China; 3. Department of Pharmacy, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT A 40-year-old female patient was admitted to the respiratory clinic for pulmonary lymphangioleiomyomatosis with epilepsy. After 1.5 months of treatment with sirolimus, the blood concentration of sirolimus was low. After comprehensive analysis of the patients seizure condition, anti-epileptic drug characteristics and patients own factors, the interaction between sirolimus and carbamazepine was found to be responsible for the low blood concentration of sirolimus. The clinical pharmacist proposed that dose adjustment of sirolimus is not recommended and carbamazepine could be replaced with valproic acid, which has less effect on the pharmacokinetic parameters of sirolimus. It is necessary to gradually reduce carbamazepine dose after the dose of valproic acid is increased to the therapeutic level to prevent sudden seizures or epilepticus during the dressing change. Finally, on the basis of continuing to take carbamazepine tablets, the patient started taking sodium valproate tablets and gradually decreased the dose of carbamazepine after the dose of valproic acid was increased to the therapeutic level until the carbamazepine tablets were completely discontinued.
KEy WORDS lymphangioleiomyomatosis; epilepsy; sirolimus; carbamazepine; valproic acid
淋巴管平滑肌瘤病(lymphangioleiomyomatosis, LAM)是一種以双肺弥漫性囊性变为主要特征的、罕见的多系统低度恶性肿瘤性疾病,主要发生于女性[1-2]。西罗莫司是治疗LAM的首选药物[1],其在LAM长期治疗过程中需要根据治疗反应、血药浓度、不良反应、临床特征、治疗阶段及合并用药来调整药物剂量。本文分析了1例肺淋巴管平滑肌瘤病合并癫痫患者应用西罗莫司治疗期间,发生西罗莫司血药浓度下降的原因及处理思路,以期为此类患者的临床治疗提供参考。
1 病史摘要
患者,女性,49岁,身高166 cm,体重55 kg。
2018年11月因受凉后出现胸闷、咳嗽、咳黄痰,咳嗽时伴有胸痛,无咽痛、周身酸痛,无气急、心慌。于当地医院就诊,查血常规:白细胞计数(WBC)10.14×109/L;C-反应蛋白(CRP) 15 mg/L;胸部CT提示两肺弥漫囊样低密度影,两肺广泛间质增厚,两肺散在斑点、结节影,考虑“①淋巴管肌瘤病,②多发泡性气肿”。为求进一步诊治,于我院呼吸科门诊就诊。查体发现脸面部可见皮疹,指甲可见疣状凸起。发现双肾血管平滑肌脂肪瘤(AML)。实验室检查:白细胞计数(WBC) 4.54×109/L,中性粒细胞百分比(N)41.4%,血小板计数(PLT)372×109/L,嗜酸性粒细胞计数(EOS%)21.4%;g-谷氨酰基转移酶(γ-GT)58 U/L,乳酸脱氢酶(LDH) 269 U/L,余未见异常;肾功能未见异常;D-二聚体(D-D)0.99 mg/L;肺功能:第1秒用力呼气容积(FEV1)1.67 L,占预计值59.78%,第1秒用力呼气容积/用力肺活量(FEV1/FVC)为 56.97%。
既往癫痫病史40年,长期服用卡马西平片0.2 g bid po治疗,偶尔晚上有癫痫发作,总体病情控制尚可。哮喘病史18年,长期规律应用沙美特罗替卡松粉吸入剂250 mg bid,控制可。
诊断:①肺淋巴管平滑肌瘤病;②结节性硬化症;③哮喘;④癫痫。
2 治疗经过
门诊予以西罗莫司片1 mg qd po,醋酸泼尼松片10 mg bid po,哮喘、癫痫按原方案治疗。治疗1.5月,门诊测西罗莫司血药浓度2.1 ng/ml,较理想浓度值偏低。
3 药师分析及建议
2014和2015年,日本和美国先后批准了西罗莫司治疗LAM的适应证,目前,西罗莫司治疗 LAM 已被国际临床指南推荐。根据《西罗莫司治疗淋巴管肌瘤病专家共识》[1]推荐,西罗莫司的成人常用剂量为1~2 mg qd,需要通过监测西罗莫司的全血药物谷浓度、治疗效果和不良反应调整用药剂量,目标全血药物谷浓度推荐为5~10 mg/L。
该患者已服用西罗莫司1个多月,监测西罗莫司血药浓度偏低。致使其血药浓度偏低的原因可从以下3个方面进行分析:①病情因素:患者目前病情平稳,无其他不适,无腹泻便秘等情况,可基本排除疾病因素的影响。②饮食因素:服用西罗莫司片剂后,其生物利用度可因进食而受到影响。高脂肪餐可使西罗莫司的AUC从23%增加至35%。西柚汁可减缓由CYP3A4介导的西罗莫司代谢和潜在加强由P-糖蛋白(P-gp)介导的西罗莫司从小肠上皮细胞向肠腔的逆转运。该患者于每天下午2:30左右服用西罗莫司(1 mg,qd),期间未食用葡萄柚、西柚汁及果汁等相关饮食,可排除饮食因素的影响。③药物因素:西罗莫司主要在肝脏代谢,是CYP3A4和P-gp的作用底物。CYP3A4和 P-gp的诱导剂可降低西罗莫司的浓度,而CYP3A4和 P-gp抑制剂可增加西罗莫司的血药浓度。患者癫痫用药卡马西平也主要经肝脏CYP3A4代谢,同时卡马西平是CYP3A4的强诱导剂,当西罗莫司与卡马西平合用时,可使西罗莫司的代谢增加,从而使西罗莫司的血药浓度下降[2-3]。
该患者癫痫病史40年,发作时以短暂意识缺失伴有神经痛为主要表现,平素服用卡马西平片(0.2 g bid)治疗,偶尔晚上有癫痫发作,总体病情控制尚可。由于患者合并LAM,西罗莫司是其重要治疗药物,因此,首先需要决定是增加西罗莫司剂量还是更换抗癫痫药物?药师对此作了进一步分析。西罗莫司被国际临床指南推荐作为治疗LAM的首选药物,目前尚无可替代药物,且根据西罗莫司的说明书,频繁调整西罗莫司剂量有可能导致用药过量或用药不足。因为西罗莫司的半衰期较长,一旦西罗莫司的维持剂量被调整,患者至少应在新的维持剂量下坚持服用7~14 d,然后再在血药浓度检测下进一步的调整剂量。另外,西罗莫司的说明书也明确提出不推荐西罗莫司与CYP3A4的强诱导剂合用。卡马西平作为CYP3A4的强诱导剂,降低了LAM治疗药物西罗莫司的血药浓度。而针对该病例的癫痫类型还有其他替代药物可供选择。于是决定将卡马西平更换为其他对西罗莫司影响较小的广谱抗癫痫药。
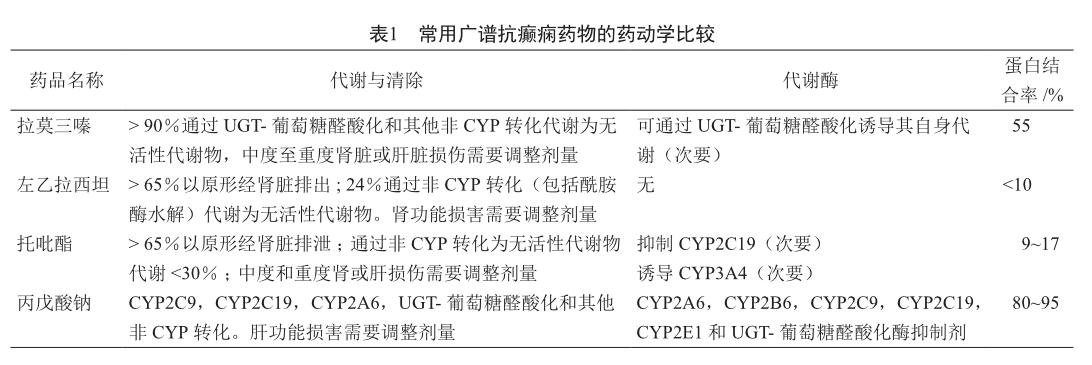
抗癫痫药物的选择应根据药物特点、癫痫发作情况和患者因素综合考慮,因人而异[4]:①药物因素:药物的有效性、潜在不良反应与其他药物的相互作用、药品费用;②疾病因素:癫痫发作的类型、合并其他的疾病;③患者因素:年龄、性别、生活方式及患者意愿。表1显示常用广谱抗癫痫药物的药动学特点。
由表1可见,不经CYP3A4酶代谢的广谱抗癫痫药有丙戊酸、拉莫三嗪、左乙拉西坦。然后临床药师对于这三种抗癫痫药物进行分析和比较,选出最适合该患者的一种抗癫痫药物。
2018 AAN/AES指南中指出[5],左乙拉西坦(1 000 mg/d)和卡马西平 (400~1 200 mg/d)的疗效和耐受性相近。研究发现[6-7],当与免疫抑制剂合用时,卡马西平可能会降低免疫抑制剂的血药浓度从而降低药效,而左乙拉西坦由于其药动学特点,口服和静脉给药时无药物相互作用,被认为是有效的替代药物。同时,指南认为拉莫三嗪(500 mg/d)和卡马西平(400~2 000 mg/d)用于局灶性癫痫病时,二者的癫痫复发率相近(拉莫三嗪 52%,卡马西平 57%)。拉莫三嗪可作为单药治疗全身性/局灶性癫痫发作,也可作为联合用药治疗难治性癫痫发作,其具有良好的安全性和耐受性,也可用于孕妇和育龄期女性抗癫痫治疗药物的选择[8]。但对于全身性癫痫发作,其有效性低于丙戊酸,而不良反应则无明显差异[9-10]。丙戊酸可用于各种类型的癫痫发作和癫痫综合征,也可在其他抗癫痫药治疗无效或疗效欠佳时使用,且可以与任何其它一种抗癫痫药联合应用[11-12]。其抗癫痫谱广、疗效好、生物利用度高、不良反应较少。AAN、NICE、SIGN指南均推荐丙戊酸是治疗全身强直阵挛性发作的首选药物。研究发现[10,13-15],丙戊酸用于全身强直阵挛性发作的有效率明显高于拉莫三嗪和左乙拉西坦,与拉莫三嗪、左乙拉西坦相比,丙戊酸表现出更好的优势。但是,由于丙戊酸可增加胎儿的致畸风险,不推荐用于育龄期女性癫痫患者。
综上所述,尽管左乙拉西坦、拉莫三嗪或丙戊酸都可以作为该患者所用的卡马西平的替代药物,但综合评估后,认为丙戊酸是首选药。但必须引起注意的是在使用丙戊酸进行替代治疗时,通常須在丙戊酸剂量增加至治疗水平后再逐渐减少卡马西平的剂量,以防止在换药期间出现突然癫痫发作或癫痫持续状态。
4 治疗结果随访与转归
2019年1月15日,患者在继续服用卡马西平片(0.2 g bid)的基础上,开始服用丙戊酸钠片(前5 d按照0.5 g qd用药,5 d后调整为0.5 g bid),按照上述方案服用10 d后测丙戊酸血药浓度36.69 mg/ml。在继续服用丙戊酸钠片(0.5 g bid)的基础上开始递减卡马西平片的剂量(按照每10 d逐步递减100 mg卡马西平,期间出现一次睡眠时癫痫小发作,后改为每20 d减100 mg)。2019年3月31日完全停用卡马西平片,目前抗癫痫方案为丙戊酸钠片0.5 g bid。后续继续随访该患者癫痫治疗方案及西罗莫司的血药浓度。
5 治疗体会
该患者为LAM合并癫痫,两种疾病的治疗药物之间存在相互作用。面对这样的治疗矛盾,应该调整药物剂量还是更换药物品种,须从疾病、药物、患者三方面综合考虑。西罗莫司作为LAM国际临床指南推荐的首选治疗药物,目前尚无其他药物可替代。通过评估决定更换对西罗莫司药动学参数影响较小的抗癫痫药物。而在选择抗癫痫的替代药物时,需结合该患者的癫痫类型选择有效的且与西罗莫司相互作用最小的抗癫痫药物。同时,在逐步更换药物过程中,应密切监护,以免癫痫病情反跳。
参考文献
[1] 中华医学会呼吸病学分会间质性肺疾病学组. 西罗莫司治疗淋巴管肌瘤病专家共识(2018)[J]. 中华结核和呼吸杂志, 2019, 42(2): 92-97.
[2] Kuypers DR. Immunotherapy in elderly transplant recipients a guide to clinically significant drug interactions[J]. Drugs Aging, 2009, 26(9): 715-737.
[3] Patsalos PN, Perucca E. Clinically important drug interactions in epilepsy: general features and interactions between antiepileptic drugs[J]. Lancet Neurol, 2003, 2(6): 347-356.
[4] Bates D, Burak KW, Coffin CS, et al. Phenytoin-induced reduction in sirolimus levels[J]. Can J Hosp Pharm, 2011, 64(4): 271-274.
[5] Kanner AM, Ashman E, Gloss D, et al. Practice guideline update summary: Efficacy and tolerability of the new antiepileptic drugs I: Treatment of new-onset epilepsy: Report of the American Epilepsy Society and the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology[J]. Epilepsy Curr, 2018, 18(4): 260-268.
[6] Shih JJ, Whitlock JB, Chimato N, et al. Epilepsy treatment in adults and adolescents: Expert opinion, 2016[J]. Epilepsy Behav, 2017, 69(4): 186-222.
[7] Werhahn KJ, Trinka E, Dobesberger J, et al. A randomized, double-blind comparison of antiepileptic drug treatment in the elderly with new-onset focal epilepsy[J]. Epilepsia, 2015, 56(3): 450-459.
[8] Coppola G, Piccorossi A, Operto FF, et al. Anticonvulsant drugs for generalized tonic-clonic epilepsy[J]. Expert Opin Pharmacother, 2017, 18(9): 925-936.
[9] Rosenow F, Schade-Brittinger C, Burchardi N, et al. The LaLiMo Trial: lamotrigine compared with levetiracetam in the initial 26 weeks of monotherapy for focal and generalised epilepsy – an open-label, prospective, randomised controlled multicenter study[J]. J Neurol Neurosurg Psychiatry, 2012, 83(11): 1093-1098.
[10] Marson AG, Al-Kharusi AM, Alwaidh M, et al. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: an unblinded randomised controlled trial[J]. Lancet, 2007, 369(9566): 1016-1026.
[11] 中國抗癫痫协会. 临床诊疗指南癫痫病分册(2015修订版)[M]. 北京: 人民卫生出版社, 2015.
[12] Díaz RA, Sancho J, Serratosa J. Antiepileptic drug interactions[J]. Neurologist, 2008, 14(6 Suppl 1): S55-S65.
[13] Mohanraj R, Brodie MJ. Outcomes of newly diagnosed idiopathic generalized epilepsy syndromes in a non-pediatric setting[J]. Acta Neurol Scand, 2007, 115(3): 204-208.
[14] Giri VP, Giri OP, Khan FA, et al. Acid versus lamotrigine as first-line monotherapy in newly diagnosed idiopathic generalized tonic-clonic seizures in adults-a randomized controlled trial[J]. J Clin Diagn Res, 2016, 10(7): FC01-FC04.
[15] Sala-Padró J, Toledo M, Santamarina E, et al. Levetiracetam and valproate retention rate in juvenile myoclonic epilepsy[J]. Clin Neuropharmacol, 2016, 39(6): 299-301.

