9种不同厂家卡马西平片的含量、有关物质和溶出度分析
李玲,田宁,付胜楠,宋玮娟,游秀华,吴传斌,胡海燕(中山大学药学院药剂学与制药工程实验室/广东省创新药物制剂工程技术研究开发中心,广州市 510006)
卡马西平(Carbamazepine,CBZ)应用于临床已有近50年的历史。目前广泛用于治疗精神病、酒精癖的戒断综合征、中枢性尿崩症、偏头痛和半侧面肌痉挛等。随着卡马西平的广泛应用,特别是大量、合并用药的出现,其毒副作用也日益受到重视[1,2]。不同厂家的卡马西平片其内在质量是否存在差异?如果存在差异,这些差异是否与不良反应存在某种相关性?本文对市场上流通的9个不同厂家的卡马西平片的含量、有关物质及溶出度进行了比较研究,拟探讨卡马西平片临床不良反应的差异是否与其内在质量差异有关。
1 仪器与试药
1200型高效液相色谱仪(美国Agilent公司,可编程紫外检测器);RCZ-8M溶出试验仪(天津市天大天发科技有限公司);RCQ-8C溶出仪自动取样器(天津市天大天发科技有限公司);紫外分光光度计(TU-1901双光束,北京普析通用)。
卡马西平对照品(中国药品生物制品检定所,批号:0142-9503);卡马西平片A(某合资药厂,批号:X0454);卡马西平B(产地上海,批号:091014);卡马西平C(产地上海,批号:1004017);卡马西平D(产地广东,批号:100601);卡马西平E(产地江苏,批号:1006131);卡马西平F(产地重庆,批号:100401);卡马西平G(产地江苏,批号:100721);卡马西平H-1(产地江苏,批号:20100610);卡马西平H-2(厂家同H-1,批号:20080901);卡马西平I(产地上海,批号:100308);四氢呋喃、甲醇为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法[3]与结果
2.1 色谱条件
色谱柱:phenomenex CN柱(250 mm×4.6 mm,5 μm);流动相:甲醇-四氢呋喃-水(120∶30∶850),其中每1 000 mL中加0.2 mL甲酸和0.5 mL三乙胺;流速:1.5 mL·min-1;检测器:紫外检测器;波长:230 nm;进样量:20 μL;柱温:40 ℃。
2.2 系统适用性试验
精密称取卡马西平对照品50 mg,置于50 mL容量瓶中,用甲醇-水(1∶1)稀释至刻度,摇匀,滤过,取20 μL注入液相色谱仪。理论板数为6 000,卡马西平峰与10,11-二氢卡马西平峰分离度为1.70。
2.3 含量测定
取不同厂家卡马西平片20片,精密称定,研细后精密称量适量(约相当于卡马西平50 mg),置于50 mL容量瓶中,加甲醇约25 mL使卡马西平溶解,用水稀释至刻度,摇匀,滤过,精密量取续滤液5 mL,置于25 mL容量瓶中,用甲醇-水(1∶1)稀释至刻度,摇匀,作为供试品溶液。另精密称量卡马西平对照品20 mg,置100 mL容量瓶中,甲醇-水(1∶1)稀释至刻度,即得0.2 mg·mL-1对照品溶液。按“2.1”项下色谱条件测定,按外标法以峰面积计算含量。
不同厂家的卡马西平片含量测定结果见表1。由表1可知,9个厂家的卡马西平片含量最低94.5%,最高106.1%,均落在标示量的90%~110%之间,均符合规定。但不同厂家间含量差别仍较明显。
2.4 有关物质
取不同厂家卡马西平片20片,精密称定,研细后精密称量适量(约相当于卡马西平50 mg),置于50 mL容量瓶中,加甲醇约25 mL使卡马西平溶解,用水稀释至刻度,摇匀,滤过。取滤液20 μL,照“2.1”项下色谱条件,注入液相色谱仪,杂质1~9的保留时间分别为 8.69、10.82、16.66、26.46、30.38、35.08、37.05、42.59、57.37 min,色谱见图1;有关物质含量见表2。

表1 含量测定结果Tab 1 Results of the content determination

图1 不同厂家卡马西平片有关物质HPLC图Fig 1 HPLC chromatograms of related substances in various Carbamazepine tablets
由图1和表2可知,合资药厂A与其他8个厂家的卡马西平片有关物质差异较大。合资药厂A的卡马西平片主要存在编号为1、2、4、5的主要杂质,而除合资药厂A外的8个厂家,普遍存在编号为6、7、8、9的杂质,具有截然不同的杂质谱。其中,合资药厂A的杂质总量明显少于其他厂家,为9个厂家中最低,用面积归一法计算,仅为0.04%。9个厂家中杂质总量最多的达到约0.35%(厂家C、厂家D)。据参考文献推测,杂质3可能为10,11-二氢卡马西平,杂质9可能为合成卡马西平的中间体亚氨基二苄[4]。

表2 不同厂家卡马西平片有关物质的含量(%%)Tab 2 Contents of related substances of various Carbamazepine tablet(s%%)
2.5 溶出度
以盐酸24 mL加水至1 000 mL为溶出介质,采用浆法,转速为150 rmp·min-1,温度为(37.0±0.5)℃,分别于0.5、1.0 h取溶出液适量,用0.8 μm微孔滤膜过滤,滤液用溶出介质稀释成每1 mL中含卡马西平6~15 μg的溶液,在285 nm处测定吸光度,按C15H12N2O的吸收系数为518计算每片的溶出度。
不同厂家卡马西平片的累积百分溶出度如图2所示。结果显示,不同厂家的卡马西平片在1 h的累积溶出百分率均达到65%以上,均符合2010年版《中国药典》(二部)要求。但将8个厂家的卡马西平片0.5、1.0 h的累积溶出百分率与合资药厂A进行比较,发现均存在显著性差异(P<0.01)。合资药厂A生产的卡马西平片体外溶出较慢,0.5 h溶出度不到60%,1.0 h溶出仅72%,与文献报道一致[5]。而8个国内厂家的卡马西平0.5 h平均溶出度均达到80%以上,1.0 h平均溶出90%以上。
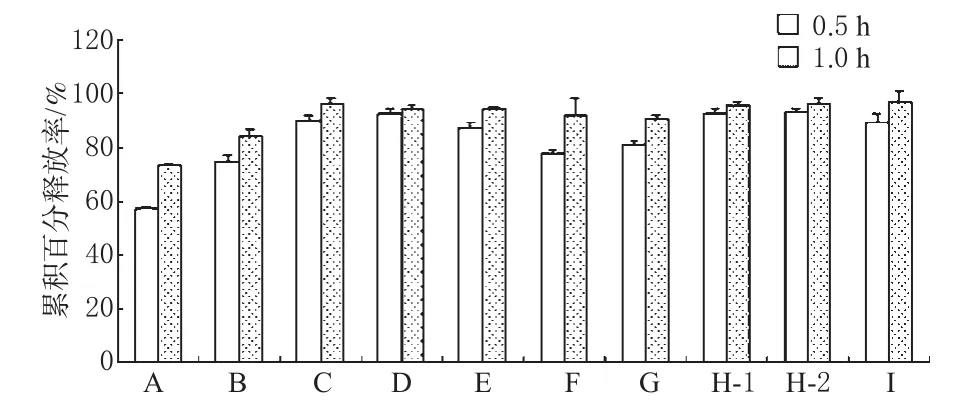
图2 不同厂家卡马西平片0.5、1.0 h累积溶出度(%%,n=6)Fig 2 Accumulative dissolution rates of various Carbamazepine tablets in 0.5 and 1.0 (h%%,n=6)
另外,国内厂家H的不同批号(H-1和H-2,生产日期分别为2008年和2010年)在含量、溶出和有关物质方面均有很好的一致性。
3 讨论
笔者对9个厂家的卡马西平片进行了含量、有关物质和溶出度比较分析,发现合资药厂A与其他8个国内厂家的卡马西平片在有关物质和体外溶出两方面存在显著差异。
合资药厂A的卡马西平片主要存在编号为1、2、4、5的主要杂质,而其余的8个国内厂家,普遍存在编号为6、7、8、9的杂质,具有截然不同的杂质谱。
溶出结果表明,合资药厂A的卡马西平片的体外溶出是9个厂家中最慢的。霍启录等[6]曾对6个不同厂家卡马西平片进行了质量评价,并测定了包括某合资药厂在内的3个厂家的体内药动学参数。结果表明,3个厂家的药-时曲线下面积相似,而合资药厂A的卡马西平片有较小吸收速率常数(Ka)和最高血药浓度(Cmax),较长的最高血药浓度时间(Tmax),国内厂家与其存在差异。此结果似乎可以用溶出试验结果进行解释:与8个国内药厂相比,合资药厂A的卡马西平片具有较慢的溶出速度(溶出度较大),导致体内经胃肠吸收较慢,药-时曲线可能较平缓,多次给药后血药浓度波动小。反映在药动学参数上,即Ka和Cmax较小,Tmax延长。2010年版《中国药典》(二部)对卡马西平片的溶出只规定了下限,即1.0 h溶出不低于65%,而卡马西平的治疗窗较窄,卡马西平片的溶出是否越快越好,该药典中的标准是否合理,都值得进一步研究。
有关物质主要反映原料药的质量,溶出主要反映制剂的质量。从本研究结果可以推测,合资药厂A与其他8个厂家在原料药和制剂方面均存在显著差异,这些差异有可能是导致卡马西平片临床不良反应差异的原因。
笔者对总杂质含量较高的厂家C、厂家D的有关物质进行了高效液相色谱-质谱联用分析,结果发现采用电喷雾和大气压化学离子源、正负电离和全扫描模式,有关物质均未出峰。究其原因可能是:杂质含量太低,达不到仪器检测限;流动相中水的比例较高(85%)不利于雾化;流动相中含有四氢呋喃抑制了电离。卡马西平片有关物质的定性鉴别还在进一步研究中。
[1] 张一力,张山川,陈新民,等.卡马西平的不良反应及临床应用[J].华西医学,2007,22(1):177.
[3] 国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:126-127.
[4] 王春华,邵新春.高效液相色谱法测定卡马西平含量及有关物质[J].药物分析杂志,2002,22(6):484.
[5] 崔九虎,张 慧,曾大利,等.不同厂家卡马西平片溶出度考察[J].海峡药学,2009,21(3):19.
[6] 霍启录,胡敏燕,刘世庭,等.卡马西平片的质量分析与体内吸收评价[J].华西药学杂志,2000,15(6):441.

