GPC3在不同侵袭能力肝细胞癌细胞株中的表达及其与4E-BP1和PS6K的相关性研究
高飞,董勤
(1.内蒙古医科大学,呼和浩特 010110; 2.内蒙古医科大学附属医院肝胆外科,呼和浩特010030)
肝癌是常见的消化系统恶性肿瘤,其发病率和死亡率均居首位[1]。而肝细胞癌(hepatocellular carcinoma,HCC)的发病率在肝脏肿瘤中又居首位,5年以上生存率约为10%[2]。目前HCC以手术配合放化疗的综合治疗为主,然而60%~70%的HCC患者在手术切除的5年内会再次复发,甚至发生转移,一旦转移则更难以治疗。因此,探索肝癌的发病机制及转移复发的相关因素,并找到预测转移复发的生物指标和药物靶向治疗的靶点,是目前肿瘤学研究的热点之一。
磷脂酰肌醇蛋白聚糖3(phosphatidylinositol proteoglycan 3,GPC3)是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路的上游分子,通过mTOR信号通路对细胞的生长起正向调节作用,核糖体S6蛋白激酶1(ribosomal S6 protein kinase,PS6K)和真核细胞启动因子4E结合蛋白1(promoter 4E-binding protein 1,4E-BP1)是mTOR下游底物,对细胞的生长起负向调节作用。在肝癌细胞中GPC3、4E-BP1及PS6K的表达及其与癌细胞侵袭能力相关性的研究较少,是否可以作为预测转移复发的分子标志物也未见探讨。因此,本研究利用蛋白免疫印迹法(Western blotting)和定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)方法对GPC3、4E-BP1和PS6K在不同侵袭能力的HCC细胞系中的mRNA和蛋白表达进行检测,并通过生物信息学分析数据的相关性,探讨这3项指标在HCC的诊断、预测转移复发及HCC发生发展中的价值。
1 材料与方法
1.1材料 总RNA快速提取试剂盒、cDNA反转录试剂盒、qPCR试剂realMaster Mix(SYBR Green)均购自天根生化科技(北京)有限公司;PCR引物合成于美国Invitrogen公司;兔源的抗GPC3抗体(1∶1 000),抗4E-BP1抗体(1∶1 000),抗PS6K抗体(1∶1 000),抗β-Actin抗体(1∶1 000),辣根过氧化物酶标的抗兔二抗(1∶1 000)均购自美国Abcam公司;HL-7702、MHCC97H、MHCC97L细胞系购自美国ATCC公司,RPMI 1640(Roswell Park Memorial Institute Media 1640)和DMEM(Dulbecco′s modified eagle medium)细胞培养基和胎牛血清(10099141)购自美国Gibco公司;青霉素、链霉素和胰酶购自北京索莱宝科技有限公司,丝氨酸/半胱氨酸蛋白酶抑制剂苯甲基磺酰氟(36978)购自美国Thermo公司。
1.2方法
1.2.1生物信息学分析 利用在线网站cbioportal和GEPIA(Gene Expression Profiling Interactive Analysis)输入基因名称,限定在HCC条目中搜索,分别查找GPC3、4E-BP1和PS6K基因在HCC患者组织中的表达及其与预后的关系。
1.2.2细胞培养 使用10%胎牛血清和1%双抗(青霉素和链霉素)的DMEM培养基培养HL-7702、MHCC97H、MHCC97L三种细胞,并置于37 ℃、5% CO2培养箱中长期培养。观察细胞生长状况,当细胞汇合度达到约90%时进行消化、传代。接种合适的细胞数量至孔板中继续培养,用以进行后续实验。
1.2.3Western boltting检测 分别收集孔板中的HL-7702、MHCC97H、MHCC97L细胞,用预冷的磷酸盐缓冲溶液洗涤两次,将消化下来的细胞用含有 0.1 mmol/L丝氨酸/半胱氨酸蛋白酶抑制剂和蛋白酶抑制cocktail(4693116001,Roche)的细胞裂解液[成分包括50 mmol/L 3-羟甲基-氨基甲烷-盐酸,1%聚乙二醇辛基苯基醚,150 mmol/L氯化钠,0.1%十二烷基磺酸钠,调节pH至7.4]低温裂解15 min。收集裂解产物,4 ℃,12 000×g离心30 min,用BCA试剂盒测定收集到的上清液的总蛋白浓度。在收集到的总蛋白中加入等体积蛋白上样缓冲液,100 ℃煮10 min。取30 μg总蛋白上样进行电泳,于10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离胶分离目的蛋白。将带有目的蛋白的凝胶置于转膜仪上,转膜仪恒压15 V转膜30 min,使蛋白印迹至硝酸纤维素膜,随后放入5%脱脂奶粉中,摇床以20 r/min的速度晃动并孵育抗体室温封闭2 h。相应的3种一抗分别于4 ℃孵育过夜,次日TBST(TBS+吐温)[成分包括20 mmol/L 3-羟甲基-氨基甲烷-盐酸,0.1% tween-20(吐温-20),500 mmol/L氯化钠]洗涤硝酸纤维素膜5次,每次5 min,随后加入辣根过氧化物酶标记的二抗在37 ℃下孵育 2 h,TBST洗涤5次,每次5 min。最后用化学发光法进行显色。所有Western boltting检测均重复3次。
1.2.4qPCR检测 分别收集HL-7702、MHCC97H、MHCC97L的HCC细胞并用预冷的磷酸盐缓冲溶液洗涤一次,参照RNA提取试剂盒说明书分别提取3种细胞总RNA。以总RNA为模板,参照反转录试剂盒说明书合成cDNA。再以cDNA为模板,借助不同的基因引物序列,使用ABI7500 qPCR仪检测相关基因的表达。GADPH(glyceraldehyde-3-phosphate dehydrogenase)的上游引物: 5′-GGTCACCAGGGCTGCTTTTA-3′,下游引物:5′-GAGGGATCTCGCTCCTGGA-3′(扩增长度198 bp);GPC3的上游引物:5′-GTTGTGAAAGGTGCTTATCT-3′,下游引物:5′-GAAGGGT-TTGAAAGTGGA-3′(扩增长度192 bp);4E-BP1上游引物: 5′-CTATGACCGGAAATTCCTGATGG-3′,下游引物:5′-CCCGCTTATCTTCTGGGCTA-3′(扩增长度160 bp);PS6K的上游引物:5′-GGTTTCATCCAGGATCGAGCAGG-3′,下游引物:5′-ACAAAGATGGTCACGGTCTGCC-3′(扩增长度445 bp)。反应程序为95 ℃ 15 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 60 s,共35个循环。以GADPH的表达作为内参,采用2-ΔΔCt法分析3种基因的mRNA表达水平。所有qPCR检测均重复3次。

2 结 果
2.1GPC3、4E-BP1和PS6K在HCC中的表达及其与预后的关系 利用在线网站cbioportal分析结果显示,GPC3、4E-BP1、PS6K表达异常的HCC患者生存时间明显短于表达正常的HCC患者(P=0.028 1,P<0.001,P=0.011 9),整体生存率和生存周期均降低,见图1a-c。GEPIA网站分析显示,PS6K低表达(n=182)的HCC患者总体生存率显著高于PS6K高表达(n=182)的患者(P=0.097),见图1d。
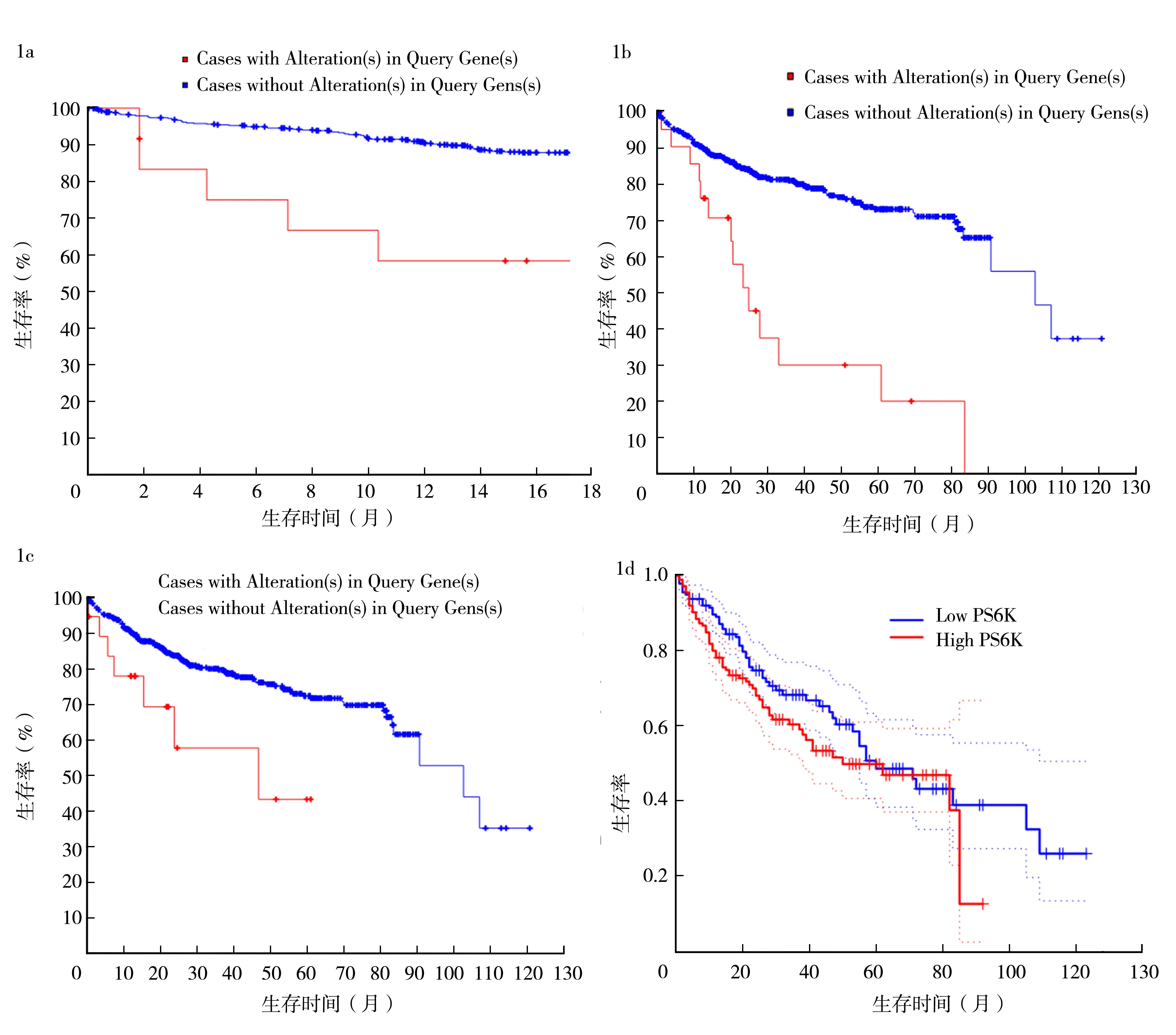
GPC3:磷脂酰肌醇蛋白聚糖3;4E-BP1:真核细胞启动因子4E结合蛋白1;PS6K:核糖体S6蛋白激酶;HCC:肝细胞癌;cases with Alteration(s) in Query Gene(s):基因突变者;cases without Alteration(s) in Query Gene(s):无基因突变者;1a:GCP3的表达变化与生存时间的相关性;1b:4E-BP1的表达变化与生存时间的相关性;1c:PS6K的表达变化与生存时间的相关性;1d:PS6K表达高低与生存时间的相关性
图1 GCP3、4E-BP1和PS6K mRNA表达变化与HCC预后的关系
2.2MHCC-97H、HL-7702、MHCC-97L细胞中GPC3、4E-BP1和PS6K mRNA的表达水平 qPCR结果显示,与HL-7702细胞系相比,MHCC-97H细胞表达的GPC3和PS6K mRNA水平显著升高(t=8.734,P<0.001;t=4.977,P<0.001),4E-BP1 mRNA水平降低(t=8.426,P<0.001),而MHCC-97L细胞GPC3 mRNA表达水平降低(t=6.457,P<0.001),4E-BP1 mRNA水平升高(t=5.572,P<0.001),PS6K mRNA水平差异无统计学意义(t=1.875,P=0.067)。与MHCC-97L细胞系相比,MHCC-97H细胞表达的GPC3和PS6K mRNA水平显著升高(t=32.465,P<0.001;t=5.413,P<0.001),4E-BP1 mRNA水平降低(t=29.669,P<0.001)。见表1。
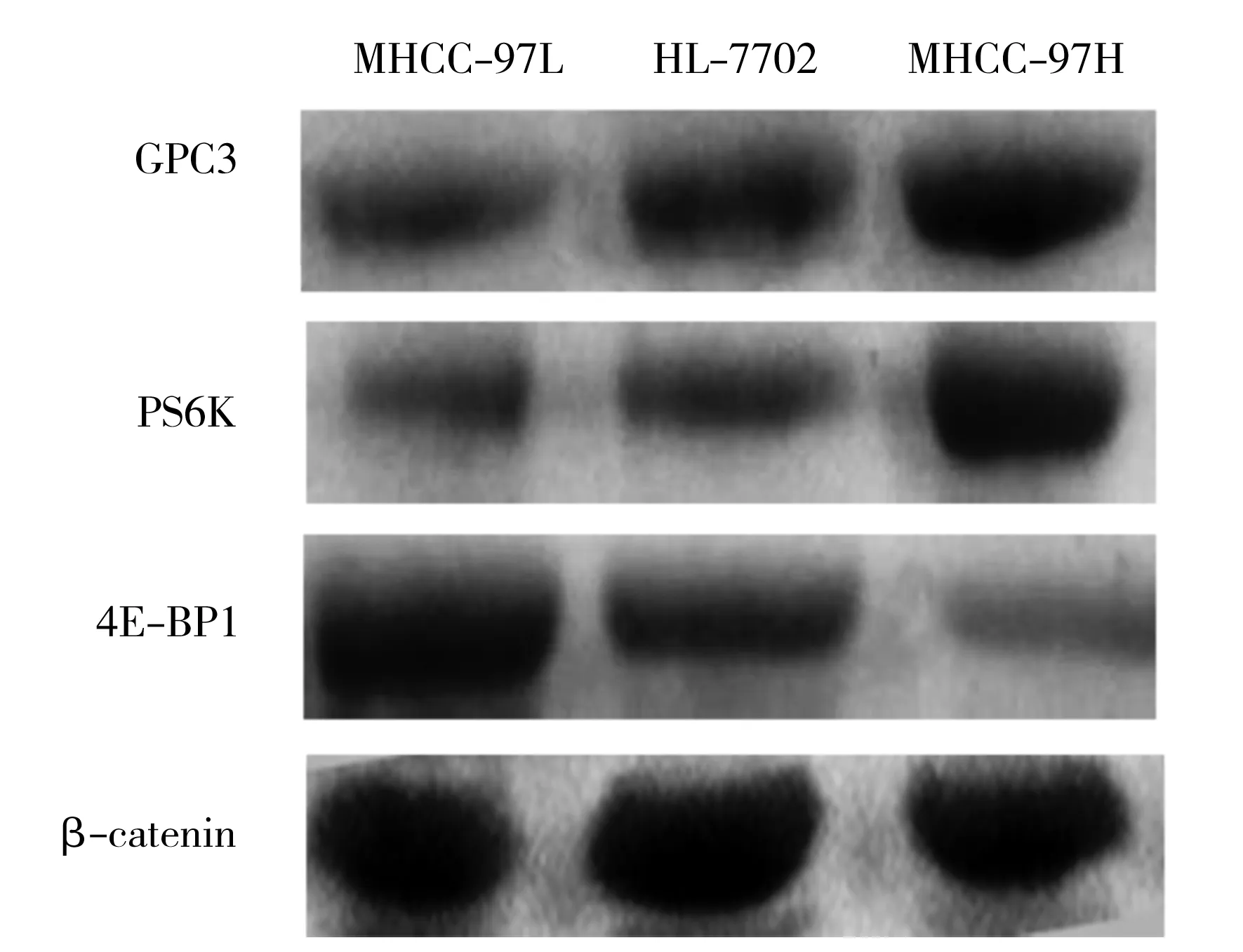
2.3MHCC-97H、HL-7702、MHCC-97L细胞中GPC3、4E-BP1和PS6K蛋白的表达水平 Western blot结果显示,与HL-7702细胞系相比,MHCC-97H细胞表达的GPC3和PS6K蛋白水平显著升高(t=5.538,P<0.001;t=8.279,P<0.001),4E-BP1蛋白水平降低(t=6.475,P<0.001),而MHCC-97L细胞表达的GPC3和PS6K蛋白水平显著降低(t=8.407,P<0.001;t=8.716,P<0.001),4E-BP1蛋白水平升高(t=10.363,P<0.001)。与MHCC-97L细胞系相比,MHCC-97H细胞表达的GPC3和PS6K蛋白水平显著升高(t=8.725,P<0.001;t=7.914,P<0.001),4E-BP1蛋白水平降低(t=28.466,P<0.001)。见表2、图2。
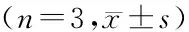
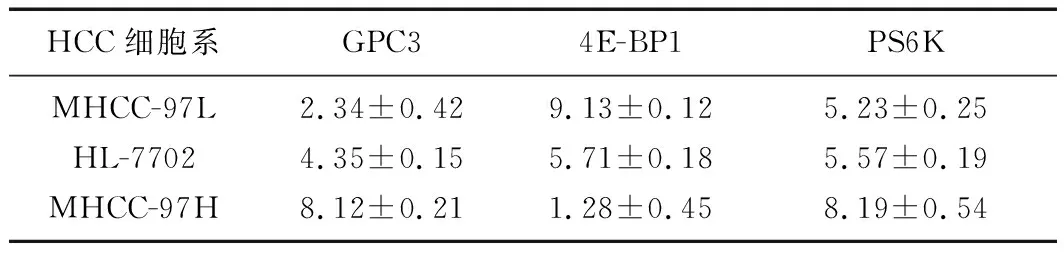
HCC细胞系GPC34E-BP1PS6KMHCC-97L2.34±0.429.13±0.125.23±0.25HL-77024.35±0.155.71±0.185.57±0.19MHCC-97H8.12±0.211.28±0.458.19±0.54
HCC:肝细胞癌;GPC3:磷脂酰肌醇蛋白聚糖3;4E-BP1:真核细胞启动因子4E结合蛋白1;PS6K:核糖体S6蛋白激酶
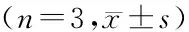

HCC细胞系GPC34E-BP1PS6KMHCC-97L0.34±0.041.13±0.030.31±0.02HL-77020.55±0.050.47±0.040.48±0.01MHCC-97H0.82±0.010.18±0.070.82±0.07
HCC:肝细胞癌;GPC3:磷脂酰肌醇蛋白聚糖3;4E-BP1:真核细胞启动因子4E结合蛋白1;PS6K:核糖体S6蛋白激酶
HCC:肝细胞癌;GPC3:磷脂酰肌醇蛋白聚糖3;4E-BP1:真核细胞启动因子4E结合蛋白1;PS6K:核糖体S6蛋白激酶
图2不同侵袭能力的HCC细胞系中GPC3、4E-BP1和PS6K蛋白表达情况
2.4GPC3、4E-BP1和PS6K的在不同侵袭能力的HCC细胞系表达的相关性 经R语言编程进行相关性矩阵分析,结果显示,在MHCC-97L中,GPC3与4E-BP1呈负相关(r=-0.850),GPC3与PS6K呈正相关(r=0.868),PS6K与4E-BP1呈负相关(r=-0.898);在MHCC-97H中,GPC3与4E-BP1呈负相关(r=-0.877),GPC3与PS6K呈正相关(r=0.888),PS6K与4E-BP1呈负相关(r=-0.898)。见图3。
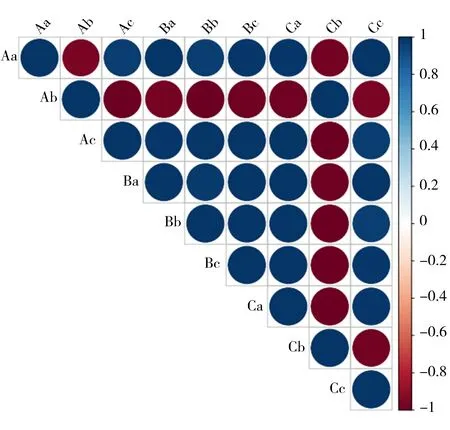
GPC3:磷脂酰肌醇蛋白聚糖3;4E-BP1:真核细胞启动因子4E结合蛋白1;PS6K:核糖体S6蛋白激酶;HCC:肝细胞癌;A:MHCC-97L;B:HL-7702;C:MHCC-97H;a:GPC3;b:PS6K;c:4E-BP1
图3 GPC3、4E-BP1和PS6K在3种HCC中的相关性分析
3 讨 论
目前肝癌的发病率及恶性程度越来越高,能否早期诊断并预测其恶性及转移程度成为亟待解决的问题。目前,众多研究者正在尝试利用多种方法预测肝癌的转移及恶性程度,如通过分析患者常规肝功能和肿瘤标志物结果等[3-4]。本研究试图寻找与HCC侵袭能力直接相关的基因并探讨其作为预测恶性程度标志物的可能性。
GPC3是一种分泌性的细胞外糖蛋白,依靠磷脂酰肌醇锚定在细胞膜上,通过结合细胞外基质或蛋白酶等影响下游信号传递,调控细胞生长和分化。GPC3是肝癌诊断的重要标志物,其在肝癌组织中的表达与肝癌患者的预后密切相关[5]。mTOR信号通路调控细胞的生长和增殖,该通路的异常激活与多种恶性肿瘤发生、发展有关。mTOR通路激活后分别调控两种下游信号:4E-BP1和PS6K,这两者与mTOR直接结合发挥作用。4E-BP1通过结合真核起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)抑制蛋白表达。4E-BP1经mTOR磷酸化后失去与eIF4E结合的能力,进而促进与细胞生长相关的蛋白质的翻译。另一方面,mTOR激活PS6K后,PS6K可磷酸化核糖体S6蛋白,从而增加含嘧啶序列mRNA的翻译,这些mRNA表达的蛋白通常是核糖体蛋白和翻译调节蛋白。因此,mTOR下游底物PS6K和4E-BP1分别对细胞的生长起正、负调节作用。多肿瘤的形成伴有mTOR信号通路的异常调控,如肿瘤细胞增殖、周期的调控、细胞迁移侵袭等[6-10]。
GPC3在肝细胞肝癌中表达异常,并且在肿瘤细胞增殖、分化、侵袭和转移过程中发挥重要调节作用[11],可作为特异性的肿瘤标志物诊断HCC[12]。此外,有文献报道,肝癌组织GPC3的异常表达与肿瘤分级、临床病理分期密切相关,可用于预测肿瘤复发或转移及患者的生存期[13]。PS6K可影响整个细胞周期的过程,尤其是G1期向S期的转化,还可以抑制凋亡分子 Bcl-2的活性从而减少细胞凋亡,此外还能诱导肿瘤细胞对缺氧环境的耐受,分泌缺氧诱导因子-1α增加血管内皮生长因子的表达[14]。有文献报道,PS6K基因功能的异常或过表达可增强肿瘤细胞的迁移和侵袭能力,并与细胞骨架肌动蛋白的重组、上皮-间充质转化等相关[15]。4E-BP1是一种小分子蛋白质,通过与eIF4E结合抑制mRNA的翻译,磷酸化的4E-BP1将失去与eIF4E结合的能力,上调mRNA的翻译。4E-BP1在肿瘤中的作用较复杂,有研究证实在多种肿瘤中,肿瘤细胞可通过高表达eIF4E避开4E-BP1介导的负调控[16]。eIF4E是真核细胞翻译起始和调控的核心成分,与mRNA 5′端帽子结构结合后调控蛋白质翻译起始过程[17-18]。
本研究使用在线网站cbioportal分析结果显示,GPC3、4E-BP1、PS6K表达异常的HCC患者与表达正常HCC患者的预后差异有统计学意义,整体生存率和生存周期均降低。因此,生物信息学数据为探讨GPC3、PS6K、4E-BP1在HCC中的表达及其与预后之间的关系奠定了良好的理论基础。本研究结果显示,与MHCC-97L和HL-7702细胞相比,高侵袭力的MHCC-97H细胞的GPC3、PS6K的mRNA和蛋白水平均显著升高,而4E-BP1的mRNA和蛋白水平从高到低则依次为HL-7702、MHCC-97L、MHCC-97H,且各种细胞株之间差异均有统计学意义。有文献报道,GPC3与生长因子相互作用,可作为激活磷脂酰肌醇-3-激酶/蛋白激酶B/mTOR信号通路的上游信号分子,而mTOR下游底物PS6K和4E-BP1分别促进和抑制细胞的增殖及生长[19]。本研究通过R语言进行蛋白表达的相关性分析显示,高侵袭能力的HCC细胞系GCP3和PS6K表达增高,4E-BP1表达降低,并呈显著相关性,而在侵袭能力最弱的MHCC-97L细胞中情况相反,这些结论为诊断和检测HCC的发生提供了一定的理论基础。此外,有研究证明血清中GPC3水平的检测可作为HCC的潜在检测指标。有研究使用酶联免疫吸附测定法测量HCC患者的血清GPC3水平,结果显示,在HCC患者中报告的阳性率为36.1%~95%[20-22]。
综上所述,GPC3在mTOR通路中发挥重要作用,激活mTOR后上调PS6K的表达,同时抑制4E-BP1表达,这3种基因与肿瘤细胞的侵袭能力相关。因此,检测GPC3、PS6K、4E-BP1蛋白的表达情况,可为预测肝癌患者术后肿瘤转移,预后及选取治疗方案提供理论基础,在HCC发生、发展中也具有重要价值。

