水杨酸钠诱导大鼠耳蜗中DAPK1表达改变
翟思佳 黄巧 廖行伟 刘宇超 尹时华
广西医科大学第二附属医院耳鼻咽喉头颈外科(南宁530000)
水杨酸钠作为临床常用药品之一,特别是在西方国家被广泛大量使用。大剂量的水杨酸钠可以对从耳蜗到中枢神经的不同听觉系统层次造成听觉损害,对耳蜗螺旋神经节的损伤尤甚[1,2],并可体现在听性脑干反应(ABR)和畸变产物耳声发射(DPOAE)的改变[3,4]。水杨酸钠对听觉系统毒副作用中最明显的三大症状是耳鸣、听力下降和言语认知能力减低[5],长期的临床实践发现水杨酸钠可以引起可逆性的耳鸣,有文献报道给予水杨酸钠200mg/日,持续两周,即可建立耳鸣动物模型[6]。目前对于水杨酸钠的作用机制尚未完全明确,尚需进一步研究。
死亡相关蛋白激酶1(death associated protein kinase 1,DAPK1)是一种钙调蛋白调节的丝氨酸/苏氨酸蛋白激酶,参与机体多种病理生理过程[7],其缺失与癌症、炎症[8]、脑卒中[9]、动脉粥样硬化、阿尔茨海默病[10]等疾病密切相关。那么DAPK1是否也参与了在水杨酸钠诱导听觉损害的过程呢?为此,本研究采用水杨酸钠诱导听觉损伤建立大鼠模型,通过ABR、DPOAE等电生理方法、HE染色及免疫组化等形态学方法检测耳蜗的病理生理变化;基于DAPK1的转录表达情况,探讨水杨酸钠能否调控DAPK1表达。
1 材料与方法
1.1 试剂与材料
1.1.1 实验动物
40只耳廓反应灵敏,未暴露于噪声及耳毒性药物环境的健康雄性SD大鼠(体重约300 g)购自广西医科大学实验动物中心。
1.1.2 主要试剂
DAPK1兔抗鼠多克隆抗体购自boster公司;SBAC二抗试剂盒购自boster公司;TRIZOL购自TaKaRa公司;逆转录盒与荧光定量PCR试剂盒均购于天根生化科技有限公司。
2.1 研究方法
2.1.1 实验动物分组及造模
实验前进行双侧ABR和DPOAE测试,选取反应阈小于40dB和耳声发射筛查通过的大鼠40只,随机分为两组,每组20只。A组为等量生理盐水对照组;B组为水杨酸钠给药实验组,给药方式为腹腔注射。水杨酸钠注射量为350mg/kg/d,连续注射7天。
2.1.2 ABR检测
于实验前及给药结束后动物处死前对对照组及水杨酸钠组大鼠双耳分别进行ABR和DPOAE测试。麻醉后的大鼠置于隔声室,记录电极扎入额顶正中,参考电极接同侧耳廓,鼻尖接地。click短声刺激,刺激率21次/秒,带通滤波300~3000Hz,观察时程15ms,叠加次数1024次,强度从90dB SPL开始递减,以能引出可分辨Ⅱ波的最小刺激强度为ABR反应阈,并重复检测2次。
2.1.3 DPOAE检测
于实验前及给药结束后动物处死前对对照组及水杨酸钠组大鼠双耳分别进行DPOAE测试。麻醉后的大鼠置于隔声室,刺激声强度L1=65dB SPL,L2=70dB SPL,取2k、3k、4k、6k、8k、10k共6个频率点进行测试,记录各频率左、右耳的平均DPOAE反应幅值。
2.1.4 标本取材及切片制备
最后一次水杨酸钠给药12h后,待大鼠麻醉充分后,打开胸腔进行心脏灌注,待眼珠、四肢末端发白后快速断头,取出听泡后剥离出耳蜗,在解剖显微镜下于蜗尖处挑开小孔,用1mL注射器由蜗顶灌注4%多聚甲醛固定液,再将标本置于4%多聚甲醛中,在4℃冰箱内固定48h。随后将耳蜗置于10%EDTA溶液室温脱钙1个月,隔天更换一次脱钙液。乙醇梯度脱水、二甲苯透明、石蜡定向包埋后平行耳蜗纵轴连续切片,片厚4μm。
2.1.5 HE染色
石蜡切片置于60℃烤箱30min,将切片取出进行二甲苯脱蜡和梯度酒精水化;蒸馏水冲洗,苏木素染色1min,水洗;蒸馏水浸泡1min;1%盐酸酒精分化数秒,自来水返蓝30min,伊红染色2min;梯度酒精脱水,二甲苯透明,晾干封片,镜检。
2.1.6 免疫组化
切片常规脱蜡后,用过氧化物室温孵育10分钟以灭活内源性酶,蒸馏水洗3次。然后进行抗原修复:将切片浸入EDTA修复液中,微波炉中高火加热至沸腾后断电,间隔1-5min,中高火8min,自然冷却,PBS洗三次。滴加封闭液于37℃放置30分钟,甩去多余液体。滴加稀释比为1:25的一抗(空白对照组在此步骤以PBS缓冲液代替一抗进行孵育),37℃2小时,PBS洗7分钟×3次。滴加二抗,37℃30分钟,PBS洗7分钟×3次。滴加试剂SABC,37℃30分钟,PBS洗7分钟×3次。使用DAB显色剂室温显色,蒸馏水洗涤。苏木素复染,酒精分化,反蓝,封片。显微镜观察。细胞胞浆有棕黄色颗粒者为阳性表达,无棕黄色者为阴性表达。在200倍镜视野下拍照,采用Image-Pro Plus6.0图像分析软件测定单位面积阳性细胞表达的平均光密度值(Average optical densities,AOD)。
2.1.7 RNA提取
将大鼠麻醉后迅速取出双侧耳蜗,置入RNA保存液中,在解剖显微镜下剥离蜗壳,取出膜迷路组织,迅速放入已加入300μl TRIZOL的1.5mLEP管中,用玻璃研磨棒在EP管中快速研磨碎,另加入700μl TRIZOL,冰上放置10min。4℃ 12000g,离心5min,吸取上清液到另一无酶EP管中,加入200μl氯仿,震荡15s,冰上静置5min。4℃ 12000g,离心15min,小心吸取上层清液入新的无酶EP管中,切勿吸取到中间层。耳蜗组织中胶原含量高,本实验采用mRNA改良提取法:用200μl异丙醇与200μl高盐溶液(0.8mol/L柠檬酸钠与1.2mol/L NaCl的混合液)沉淀RNA,提高RNA纯度,颠倒混匀后冰上静置10min。4℃12000g离心10min,弃上清保留沉淀,加入75%乙醇1mL洗涤沉淀。4℃12000g离心5min,倒去乙醇,用小枪头吸取残留液体,室温晾干,然后将RNA溶于无酶水中,微量核酸蛋白检测仪测定RNA浓度,OD260/OD280比值必须在1.7~2.0之间。
2.1.8 荧光定量PCR
将mRNA反转录为cDNA,RT-PCR检测各样本DAPK1表达,反应条件:95℃30s,95℃5s,56℃30s,72℃30s,总共38个循环。以GPHAD为内参对照,每组设3个复孔,重复3次,计算平均值。引物序列:DAPK1 F:5'-AAGGCCTCCTCTGTGTTCAAG-3',R:5'-CCCTTGCACGTCAGTCCATAA-3'。GPHAD F:5'-AGTGCCAGCCTCGTCTCATA-3';R:5'-TGAACTTGCCGTGGGTAGAG3-3'。
2 结果
2.1 原给药后各组动物ABR阈值比较
用ABR评估给药前后各组大鼠的听力情况(如图1及图2)。给药前大鼠阈值为31.79±4.13 dB SPL,造模第7天对照组动物ABR阈值为32.14±3.78 dB SPL,实验组为50±4.8dB SPL,给药前、后对照组听力阈值变化无统计学意义(P>0.05),而给药后水杨酸钠组大鼠听阈较给药前及对照组均显著升高,采用独立t检验,t=-10.931,P<0.001。且随给声刺激强度减小,各波潜伏期延长,波形分化逐渐变差,至阈值以下,波形不能辨认。这与吴莎[11]、陈抗松[12]等人的研究结果一致,大剂量注射水杨酸钠明显影响大鼠ABR阈值及波形,说明造模成功,大剂量水杨酸钠对大鼠听觉系统造成了一定损伤。
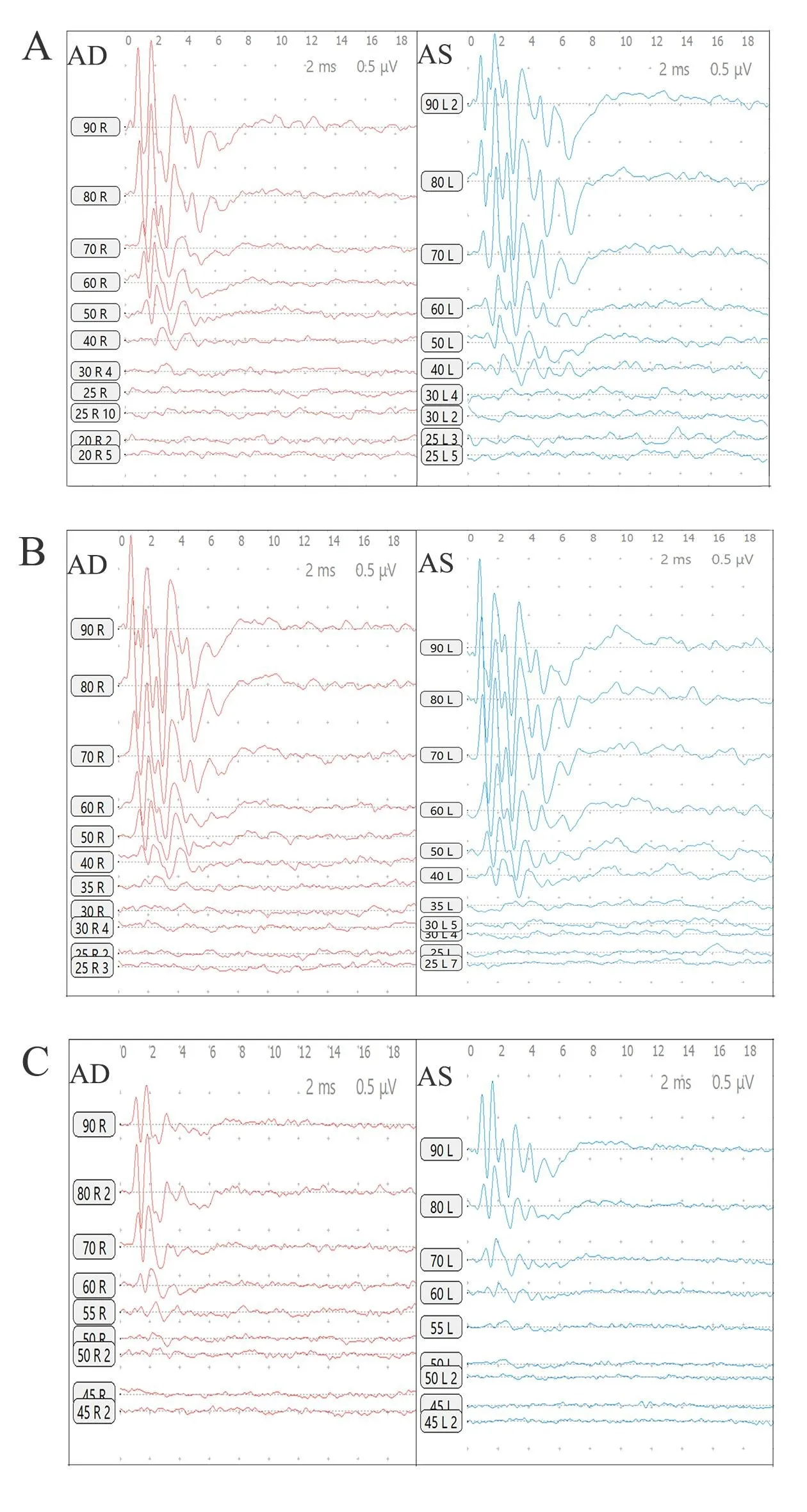
图1 水杨酸钠给药前后各组大鼠ABR检测结果波形变化A动物给药前的测试波形;B给药后对照组动物动物ABR波形;C给药后水杨酸钠组动物ABR波形。Fig.1 Waveform changes in ABR test results of rats in each group before and after salicylate administration.A shows the test waveform before animal administration;B shows the waveform of ABR in the control animal after administration;C is the the ABR waveform of the sodium salicylate group animal after administration.
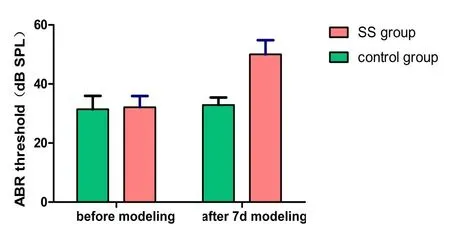
图2 水杨酸钠给药前后各组ABR反应阈检测情况(n=40,control group为对照组,SS group为水杨酸钠组;横坐标为水杨酸钠给药时间,纵坐标为ABR听力阈值。给药后control组动物ABR阈值为32.14±3.78 dB SPL,SS组为50±4.8dB SPL,SS组较control组显著升高,且P<0.01,t=-10.931,P=0.000)。Fig.2 Detection of ABR response threshold before and after sodium salicylate administration(n=40,SS group is sodium salicylate group;abscissa is sodium salicylate administration time,ordinate is ABR hearing threshold.After administration,the ABR threshold of the control group was 32.14±3.78 dB SPL,and the SS group was 50±4.8dB SPL.The SS group was significantly higher than the control group,and P<0.01 t=-10.931,P=0.000).
2.2 原给药后各组动物DPOAE值比较
于给药前选择耳声发射筛查通过的大鼠进行实验,给药结束后再次对各组大鼠进行耳声发射检测,采用独立t检验进行统计分析,发现造模7天后水杨酸钠组大鼠较给药前及对照组2k(t=3.131,P=0.004)、3k(t=2.909,P=0.008)、4k(t=3.530 P=0.002)、6K(t=2.340,P=0.029)、8k(t=3.676,P=0.001)DPOAE幅值显著下降,而对照组给药前后DPOAE幅值无明显变化,P>0.05(如表1与图3所示),提示大剂量水杨酸钠给药造成了听力损失,听觉损伤[13]。
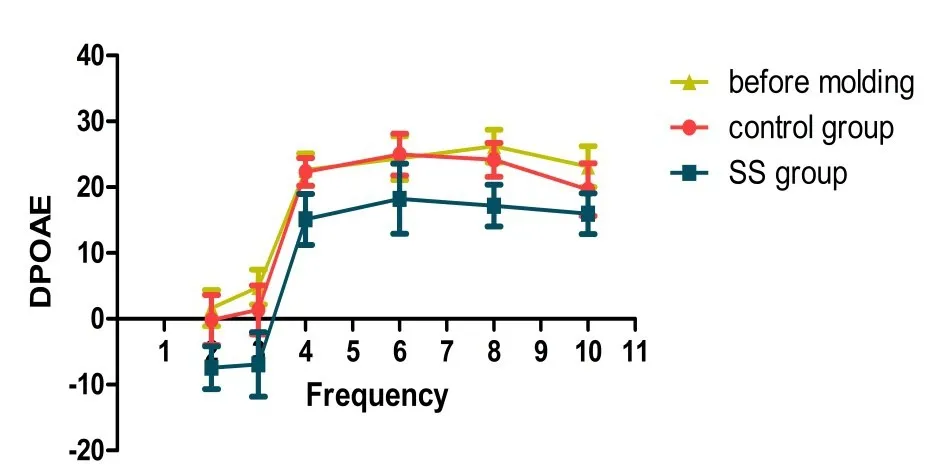
图3 水杨酸钠给药前后各组DPOAE检测情况(before modeling为给药前大鼠(n=40),control group为对照组(n=20),SS-group为水杨酸钠组(n=20);横坐标为耳声发射频率,纵坐标为DP值。给药后水杨酸钠组较给药前及对照组2k(t=3.131,P=0.004)、3k(t=2.909,P=0.008)、4k(t=3.530 P=0.002)、6k(t=2.340,P=0.029)、8k(t=3.676,P=0.001)DPOAE幅值显著下降,且P<0.05;而对照组较给药前DPOAE幅值无明显变化,P>0.05。)Fig.3 Detection of DPOAE in each group before and after salicylate administration(SS group is sodium salicylate group;abscissa is DPOAE frequency,ordinate is DP value.The amplitude of DPOAE in the SS group(n=20)was significantly lower than animals before SS administrator(n=40)and the control group(n=20)in 2k(t=3.131,P=0.004),3k(t=2.909,P=0.008),4k(t=3.530 P=0.002),6k(t=2.340,P=0.029),8k(t=3.676,P=0.001),and P<0.05.However,the control group had no significant change in the amplitude of DPOAE compared to animals before modeling,P>0.05.
2.3 HE染色观测给药后各组动物耳蜗损伤情况
造模7d后,通过HE染色观察各组大鼠耳蜗损伤情况,可以观察到对照组耳蜗结构正常(如图4A);而水杨酸钠组耳蜗SNG细胞明显变形,移位,部分溶解消失,Corti器也存在有一定程度的细胞萎缩,螺旋缘、血管纹未见明显变化(如图4B)。说明造模后水杨酸钠组大鼠较对照组的显著损伤主要集中在SNG区域,大剂量注射水杨酸钠明显影响大鼠听觉器官耳蜗。
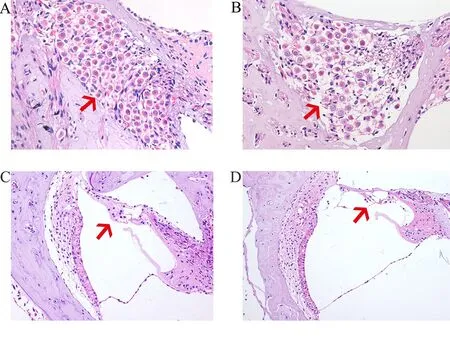
图4 HE染色观察各组耳蜗损伤情况A箭头所指为给药后对照组耳蜗SNG区域;B箭头所指为给药后水杨酸钠组耳蜗SNG区域;C箭头所指为给药后对照组Corti器;D箭头所指为水杨酸钠组Corti器。A,B×400;C,D×200。Fig.4 HE staining was used to observe the cochlear injury in each group A arrow indicates the cochlear SNG area of the control group after administration;B arrow indicates the cochlea SNG area of sodium salicylate group after administration.;C arrows refer to the Corti device in the control group;D arrows refer to the Corti device in the sodium salicylate group.A,B×400;C,D×200.)

表1 水杨酸钠给药前后各组大鼠耳声发射检测结果变化Table 1 Changes in DPOAE test results of rats in each group before and after salicylate administration
2.4 免疫组化检测各组大鼠耳蜗中DAPK1蛋白表达
造模成功后,运用免疫组化技术检测各组耳蜗中DAPK1蛋白表达情况,发现DAPK1在对照组和水杨酸钠组的大鼠耳蜗中均有表达,主要表达于螺旋神经节(SNG)处,以及螺旋缘(SLM)、血管纹(StV)、Corti器(OC)也有一定表达。在图5A正常对照组中各区域呈强阳性表达,图5B水杨酸钠组中呈弱阳性表达,5C空白阴性对照组中呈阴性表达,其中实验组较对照组DAPK1表达明显减少,发生DAPK1表达差异变化的区域与HE观测到的水杨酸钠诱导的耳蜗组织细胞损伤的部位大致相同,主要集中于SNG区域,这说明水杨酸钠致耳蜗SNG损伤的同时下调了该区域的DAPK1表达,二者具有紧密关联。进行光密度计数,正常对照组的平均光密度值(AOD)为0.022±0.002,水杨酸钠组为0.012±0.003,采用独立t检验统计分析发现水杨酸钠组表达较正常对照组表达减少(t=8.687,P=0.000),差异具有统计学意义(见图6)。

图5 免疫组化染色检测各组DAPK1表达情况A正常对照组;B水杨酸钠给药组;C空白阴性对照组。红色箭头所示为SNG,蓝色箭头为OC,绿色箭头为StV,黑色箭头为SLM。A,B,C×200。Fig.5 Immunohistochemical staining for the expression of DAPK1 in each group A normal control group,B sodium salicylate administration group,C blank negative control group.The red arrow shows SNG,blue arrow is OC,green arrow is StV,black arrow is SLM.A,B,C×200.
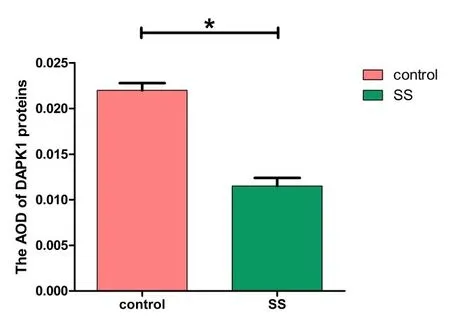
图6 各组大鼠耳蜗DAPK1表达平均光密度计数(AOD)control:对照组(n=10),SS:水杨酸钠组(n=10),横坐标为组别,纵坐标为AOD值,*P<0.01。Fig.6 Mean optical density count(AOD)of DAPK1 in the cochlea of each group was detected control:the control group(n=10),SS:the sodium salicylate administrator group(n=10),abscissa is group,ordinate isAOD value,*P<0.01.
2.5 荧光定量PCR
提取DAPK1 mRNA OD260/OD280比值在1.7~2.0之间,荧光定量反应曲线见图7,计算2-△CT作为DAPK1 mRNA的相对表达量,control组的相对表达量为1.03±0.33,SS组为0.10±0.04。采用独立t检验统计分析发现水杨酸钠组mRNA相对表达量较对照组表达减少(t=7.891,P=0.000),差异具有统计学意义(见图8),L.WEI等人曾发现耳蜗器官体外培养过程中,经水杨酸钠处理12h后PCR检测发现DAPK1基因下调[14],这与本研究关于耳蜗的动物在体研究的结果相一致,均提示听觉耳蜗损伤伴随DAPK1的下调。

图7 荧光定量PCR反应曲线A对照组扩增曲线;B对照组溶解曲线;C为水杨酸钠组扩增曲线;D为水杨酸钠组溶解曲线。对照组DAPK1 mRNA的△CT为4.54±0.56,水杨酸钠组为7.94±0.62。Fig.7 Fluorescence quantitative PCR reaction curve A control curve of the control group;B dissolution curve of the control group;C amplification curve of the sodium salicylate group;D dissolution curve of the sodium salicylate group.The DAPK1 mRNA of the control group△CT was 4.54±0.56,and sodium salicylate group was 7.94±0.62.

图8 各组DAPK1 mRNA的相对表达量control:对照组(n=10),SS:水杨酸钠组(n=10),横坐标为组别,纵坐标为mRNA相对表达量,*P<0.01。Fig.8 Relative expression of DAPK1 mRNA in each group control:the control group,SS:the sodium salicylate group,abscissa is group,ordinate is mRNA relative expression,*P<0.01.
3 讨论
大剂量的水杨酸钠可以对从耳蜗到中枢神经的不同听觉系统层次造成听觉损害,尤其损伤耳蜗螺旋神经节,造成耳鸣、听力下降和言语认知能力减低。本研究通过电生理检测发现SS组的ABR阈移变大、DP幅度下降,说明水杨酸钠给药造成动物模型听觉损伤。通过形态学方法观测耳蜗组织切片,发现SS给药后耳蜗的细胞损伤主要在SNG区域,Corti器也有一定程度萎缩,其余部位螺旋缘、血管纹等形态学变化并不明显。而免疫组化、荧光定量PCR结果显示SS组DAPK1的转录表达较control组显著下调,并且下调改变集中在耳蜗的螺旋神经节(SNG)区域,以及螺旋缘(SLM)、血管纹(StV)、Corti器(OC),发生DAPK1表达差异变化的部位与HE观测到的水杨酸钠诱导的耳蜗组织细胞损伤的部位大致相同,均主要集中于SNG区域,这说明水杨酸钠致耳蜗SNG损伤的同时下调了该区域的DAPK1表达,二者具有紧密关联。L.WEI等人[14]也曾发现耳蜗SNG原代细胞体外培养过程中,经水杨酸钠处理12h后PCR检测发现在螺旋神经节损伤的同时SNG细胞中的DAPK1基因下调,本研究的结果与其相一致。综上所述,我们证实在动物模型听觉损伤过程中,螺旋神经节损伤的同时SNG细胞中的DAPK1表达下降,水杨酸钠可能通过调节SNG中DAPK1的转录表达而损伤听觉系统,继而造成耳鸣、听力下降和言语认知能力减低等症状出现。
DAPK1具有在细胞凋亡和炎性调节的双重作用。一方面,DAPK1作为γ-干扰素诱导的程序性细胞死亡的阳性介质,在各类疾病研究中往往作为正性促凋亡因子,参与细胞凋亡通路[15]。而本课题组前期研究证实水杨酸钠诱导SNG凋亡[16],结合DAPK1在水杨酸钠模型中的下调,DAPK1可能具有双重凋亡调控作用,既可促进凋亡,亦可抑制凋亡,但DAPK1负性调控凋亡的文章至今鲜有报道,尚需进一步探讨研究。另一方面,DAPK1扮演炎性调节角色,既具有产生IL-1β和IL-18等促炎信号传导的作用,同时也可以负调控多种炎症基因[17],例如DAPK1抑制肿瘤坏死因子-α(TNF-α)或脂多糖(LPS)诱导的NF-κB活化和促炎细胞因子的表达[18],因此DAPK1在炎性反应调节过程中对不同细胞类型和环境因素的改变将会做出不同的调节反应。其中DAPK1作为抗炎因子参与多种疾病[8,19]。在DAPK敲除鼠模型中,LPS诱导NF-κB表达,加剧了肺的炎症反应[20]。在肠道炎症中,DAPK甲基化导致DAPK低表达,使炎症的严重程度增加[21]。
最新研究发现神经炎症是水杨酸钠诱导听觉损伤的新机制,水杨酸钠会导致多种炎症因子TNF-α、IL-1β、IL-1在耳蜗中上调[22,23],而DAPK1作为抗炎因子可抑制多种炎症因子,结合本研究发现DAPK1由于水杨酸钠的耳毒性作用而表达下调,我们不妨推测DAPK1在水杨酸钠模型中对螺旋神经节细胞扮演着抑制炎性反应的角色,水杨酸钠可能通过下调DAPK1而使耳蜗的促炎因子过表达,造成耳蜗的炎性反应,继而导致听觉损伤。因此,我们认为DAPK1参与水杨酸钠致听觉系统损伤继而发生耳鸣、听力下降的过程,尤其是螺旋神经节的损伤。并推测水杨酸钠可能通过下调DAPK1诱导耳蜗炎症因子的产生来完成这个过程,但其具体调节机制仍需进一步探究。

