乙型肝炎病毒反转录酶区耐药突变患者HBsAg主要亲水区免疫逃逸相关突变研究
黄碧霞,刘妍,思兰兰,陈容娟,李晓东,罗丹,刘璐洁,王钧,徐东平,刘新光
1广东医科大学广东省医学分子诊断重点实验室/生物化学与分子生物学研究所,广东东莞 523808;2解放军总医院第五医学中心全军传染病研究所/临床研究管理中心,北京 100039
乙型肝炎病毒(hepatitis B virus,HBV)感染可导致慢性乙型肝炎(chronic hepatitis B,CHB)、肝硬化及肝细胞癌等肝脏疾病。目前,临床上治疗乙型肝炎最常用的抗病毒药物是核苷(酸)类似物(nucleos(t)ide analogues,NAs),包括核苷类药物[如拉米夫定(lamivudine,LAM)、替比夫定(tebivudine,LdT)、恩替卡韦(entecavir,ETV)]和核苷酸类药物[如阿德福韦酯(adefovir dipivoxil,ADV)、富马酸替诺福韦酯(tenofovir disoproxil fumarate,TDF)]。由于HBV反转录酶缺乏校正功能,在病毒学、免疫、肝脏和诱发因素的压力下,HBV易发生突变。长期应用NAs,药物压力导致HBV易发生耐药突变[1],且主要发生在多聚酶/反转录酶(reverse transcriptase,RT)区域。近年来有研究表明,HBV发生适应性突变不仅是药物压力作用的结果,还取决于其复制力及对抗病毒药物和宿主免疫反应的敏感性[2-3]。
乙肝表面抗原(hepatitis B surface antigen,HBsAg)是诊断HBV感染、判断抗HBV疗效的重要指标。HBsAg主要亲水区(major hydrophilic region,MHR)指99-169氨基酸(aa)序列区(aa 99-169),是刺激B细胞产生中和性抗体的重要抗原表位[4]。目前有42种HBsAg突变被确定为MHR免疫逃逸相关突变(表1)[5-6]。由于S基因与HBV RT区完全重叠,NAs治疗引起的耐药突变亦可导致S基因突变,相反S基因突变亦可诱导RT区突变[7-8]。目前,关于免疫适应性对耐药突变病毒株影响的临床大样本研究相对较少[9]。本研究探讨RT耐药突变患者HBV S基因MHR免疫逃逸相关突变的特点。

表1 相关文献报道的HBsAg MHR免疫逃逸相关突变Tab.1 Immune escape-associated mutations of HBsAg MHR reported in literature
1 资料与方法
1.1 研究对象 采用解放军总医院第五医学中心建立的中国多功能HBV基因数据库,回顾性分析2007年7月-2017年8月就诊于该院经多种核苷(酸)类药物抗病毒治疗并行HBV DNA直接测序的27 394例患者的临床资料,从中筛出6917例18~60岁慢性乙型肝炎C基因型患者的基因直接测序数据,并按照是否发生HBV RT耐药突变分为HBV RT耐药突变组(n=4332)与HBV RT野生组(n=2585)。CHB诊断依据为我国《慢性乙型肝炎防治指南(2015)》[10],排除HIV、HCV、HDV等重叠感染者;排除原发性肝癌患者。本研究经解放军总医院第五医学中心伦理委员会审查批准。
1.2 收集临床资料 收集患者的人口统计学和临床数据,包括年龄、性别、抗病毒治疗史、血清HBV DNA、HBsAg水平和谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆碱酯酶(CHE)等生化指标。
1.3 血清生化指标、HBV血清标志物和HBV DNA定量检测 均由解放军总医院第五医学中心临床检验中心完成。HBV血清学标志物检测使用Roche公司的Elecsys定性试剂,其中血清HBsAg定量检测使用HBsAg Elecsys定量试剂(检测下限为0.05 IU/ml);血清HBV DNA定量采用Roche公司实时荧光定量PCR检测(检测下限为40 IU/ml)。
1.4 HBV RT耐药突变和HBV S基因MHR免疫逃逸相关突变分析 HBV RT基因和S基因核酸序列均来源于HBV基因数据库,采用Megalign软件比对分析HBV RT耐药突变和HBV S基因MHR免疫逃逸相关突变。HBV标准序列从NCBI网站(http://www.ncbi.nlm.nih.gov/projects/genotyping/formpagex.cgi)获得。
1.5 HBV RT耐药突变和HBsAg MHR突变分析 分析RT区LAM、ADV、ETV经典耐药突变位点和S区MHR免疫逃逸相关突变。前者包括rtV173L、r tL180M、r t A181V/T、r tT184A/S/L/G/F、rtS202G/C、rtM204I/V、rtN236T和rtM250L/V[11];后者包括国内外报道的42种MHR免疫逃逸相关突变(表1)。
1.6 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料用x±s或M(Q1,Q3)表示,组间比较采用方差分析和独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CHB患者的HBV RT耐药突变检出率 回顾性分析结果显示,HBV RT耐药突变总体检出率为37.37%(2585/6917)。研究对象筛选流程见图1。
2.2 两组CHB患者MHR免疫逃逸相关突变的临床特点 HBV RT耐药突变组患者平均年龄为43.5岁,其中2101例(81.30%)为男性,而HBV RT野生组患者平均年龄为40.0岁,其中3489例(80.50%)为男性。HBV RT耐药突变组HBV DNA载量高于HBV RT野生组[(5.09±1.84) lg10IU/mlvs. (4.95±1.96) lg10IU/ml,P<0.05],总体突变率显著高于HBV RT野生组(30.00%vs. 17.13%,P<0.05)。两组患者一般资料见表2。

图1 研究对象筛选流程图Fig.1 Flow chart of research objects screening

表2 HBV RT耐药突变组与HBV RT野生组患者一般资料Tab.2 General information of patients in HBV RT resistant mutation group and HBV RT wild group
2.3 两组CHB患者HBsAg MHR免疫逃逸相关突变氨基酸替换 HBV RT耐药突变组中sQ101K/R/H、sS114T/A/L、sT/I126S/N/A、sG130N/R/K/A、sM133T/I、sS143T/L、sA159V/G、sE164D/G单点突变检出率均高于HBV RT野生组,差异有统计学意义(P<0.05),且这些突变均是已报道且公认的MHR免疫逃逸相关突变。详细结果见图2。
3 讨 论
世界卫生组织2018年的统计数据显示,全球约有2.92亿人感染了HBV,其中我国约有8600万[12-13]。 NAs是目前临床常用的抗HBV药物,但长期应用易引起耐药,耐药主要发生在HBV RT区域,HBV RT耐药突变会影响HBV感染的治疗[14]。核苷(酸)类药物耐药突变株发生演变除取决于病毒和药物的影响(药物敏感性降低程度、复制力水平、突变基因屏障)外,还可能受到免疫逃逸(免疫适应性)的影 响[15-16]。本研究主要通过临床大样本分析明确免疫因素对耐药突变株的影响。
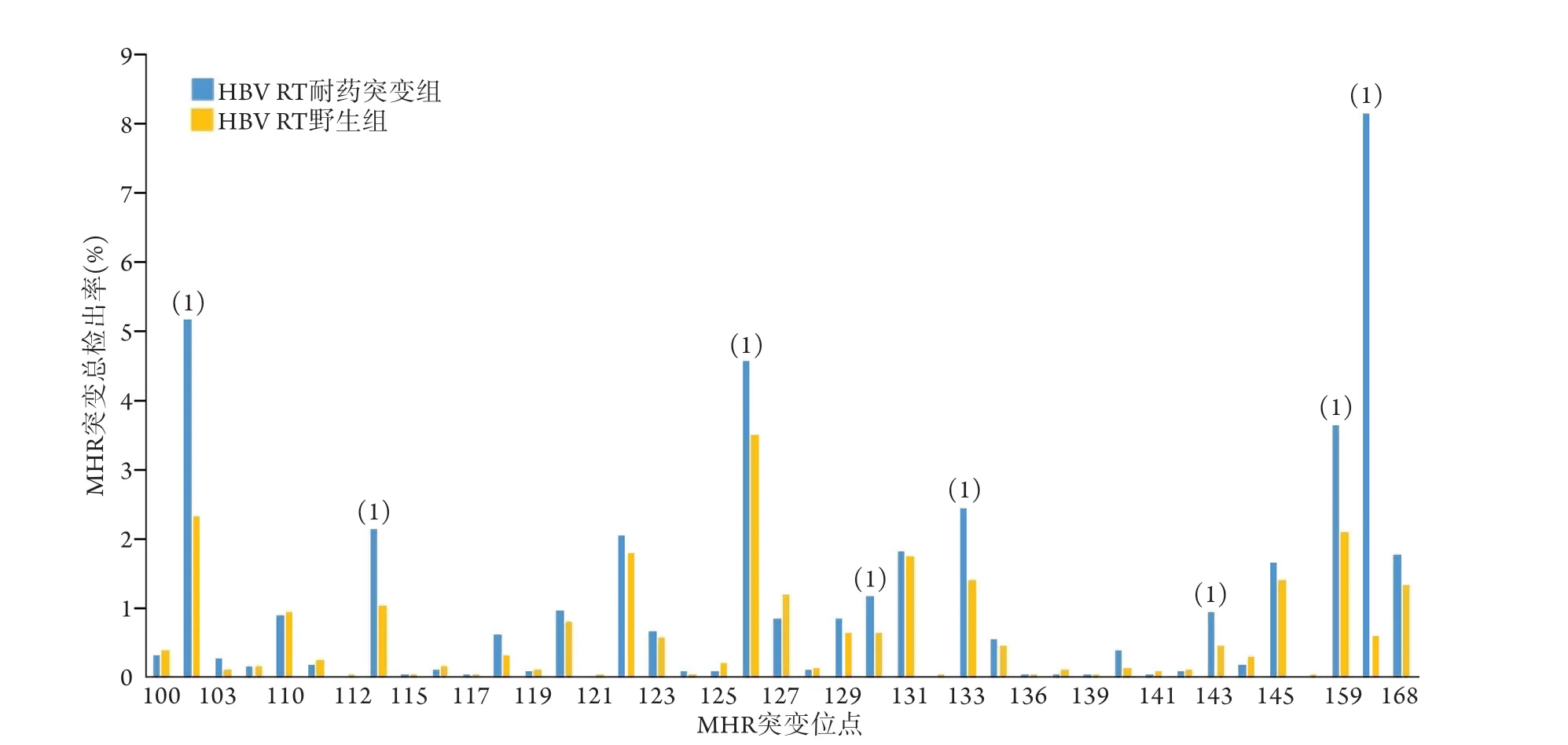
图2 两组慢性乙型肝炎患者MHR免疫逃逸相关突变分析Fig.2 Analysis of MHR immune escape related mutations in two groups of patients with chronic hepatitis B
迄今为止,已经鉴定出10种HBV基因型,命名为A~J[17-18],其具有明显的地理分布特征,我国主要是B和C基因型。近期Ababneh等[19]关于约旦地区D基因型分离株HBV S基因免疫逃逸突变及反转录酶突变模式的小样本研究发现,RT突变和HBsAg突变均增加了耐药风险。本研究仅纳入了C基因型CHB患者,因此可扩大样本量进一步分析其他基因型在HBV RT耐药突变和MHR免疫逃逸相关突变中的意义。
免疫逃逸相关突变主要发生在HBsAg主要亲水区域。文献报道,约有42种HBsAg突变被确定为MHR免疫逃逸相关突变[5-6]。本研究在6917例C基因型CHB患者中检出2585例HBV RT耐药相关突变,检出率为37.37%(2585/6917);检出1517例MHR免疫逃逸相关突变,检出率为21.93%(1517/6917),略低于Colagrossi等[20]的研究结果,后者报道接受NAs治疗的828例患者中,447例(54.00%)发生NAs诱导的突变,183例(22.10%)发生免疫逃逸相关突变。提示临床上HBV耐药突变和MHR免疫逃逸相关突变较常见,且对HBV抗病毒治疗应答影响较大,应引起重视。
HBV耐药发生顺序为基因型耐药、病毒学耐药和临床耐药。有研究发现,抗病毒耐药突变是通过长期NAs治疗选择的,且病毒学耐药与耐药突变及免疫逃逸相关突变的不断积累有关[21]。本研究纳入2585例HBV RT耐药突变患者和4332例HBV RT野生型患者,二者在年龄构成及ALT、AST、CHE等生化指标和HBV DNA载量上差异均有统计学意义(P<0.05);HBV RT耐药突变组HBV DNA载量高于HBV RT野生组,且MHR总体免疫逃逸相关突变率显著高于HBV RT野生组(30.00%vs. 17.13%,P<0.05)。本研究结果表明,HBV耐药突变可能使病毒复制力增加,导致NAs的敏感性下降,抗病毒应答不佳或无应答;MHR免疫逃逸相关突变的存在更利于HBV耐药的发生,提示耐药性与免疫相关逃逸突变密切相关,两者协同影响病毒的存活和疾病的进展。
本研究结果发现,H B V RT 耐药突变组中sQ101K/R/H、sS114T/A/L、sT/I126S/N/A、sG130N/R/K/A、sM133T/I、sS143T/L、sA159V/G、 sE164D/G等单点突变检出率高于HBV RT野生组(P<0.05),表明这8种MHR免疫逃逸相关突变在HBV RT耐药突变患者中更易出现。体外研究发现,sT/I126S[22]、sM133T[22-23]、sS143L[24]、sA159G[25]可影响HBsAg的表达与分泌,并降低其抗原性,但是目前鲜有研究报道HBV RT耐药突变与其中任意MHR免疫逃逸相关突变共同存在对耐药发生和HBV临床治疗的影响。值得注意的是,Amini-Bavil-Olyaee等[26]研究发现,经典免疫逃逸相关突变sG145R和sP120T可明显降低HBsAg水平,致使L AM耐药性HBV突变体复制力升高,表明sG145R和sP120T与LAM耐药突变具有相关性;且体外研究结果表明,TDF可作为一种有效治疗临床LAM耐药突变和免疫逃逸突变结合突变体的一线药物。因此,应加强临床实践中既有S区免疫逃逸突变又有RT区耐药突变的复杂HBV突变体的检测和抗病毒治疗研究。
综上所述,本研究通过临床大样本分析发现,HBV RT耐药突变患者具有更高的HBsAg MHR免疫逃逸突变检出率,明确了MHR免疫逃逸相关突变与HBV RT耐药突变的相关性,有助于加深人们对耐药突变病毒株影响机制中免疫因素的理解,提高临床对HBV耐药的监控水平,以及帮助临床医师优化抗病毒治疗方案。

