桑轮纹病病斑内部及周边真菌群落结构研究
王 谢,李星月,尹诗琳,3,唐 甜,张建华*
(1. 四川省农业科学院土壤肥料研究所,四川 成都 610066; 2. 四川省农业科学院植物保护研究所,四川 成都 610066; 3. 四川农业大学林学院,四川 成都 611130)
【研究意义】桑轮纹病又称桑轮斑病,是一种桑树真菌病害,长期影响着亚洲诸国的蚕桑生产。【前人研究进展】1980年,该病被Takahashi等[1]在日本首次报道,称为zonate leaf spot of mulberry ,并指出该病的病原菌为“Gonatophragmiummori”。后Takahashi等[2]又调查指出其寄主涉及16科24属 28植物种,完整描述了该病原菌的整个生活史阶段。1999年,该病被Maji等[3]在印度发现 ,称为brown ring leaf spot disease of mulberry,并指出其病原菌为Cephalosporiumstrictum。我国从20世纪80年代开始对该病进行报道研究,1994年首次正式报道了广西百色蚕区发生的桑轮纹病灾情[4],2007年江西修水县爆发了桑轮纹病并呈较快的蔓延趋势[5],2011年浙江淳安县也报道了一起特大桑轮斑病灾害事件[6],2012年云南省昭通地区也首次报道了该地区出现的桑轮纹病[7]。2016年,笔者在四川眉山地区调研时发现桑轮纹病是当地每年必发生的一种病害,在随后的两年里,又在四川绵阳地区、四川仁寿地区、重庆潼南地区等地发现大面积桑树轮纹病病害。【本研究切入点】虽然桑轮纹病的传统植物病理学研究已经有了一定的基础,但其具体的宿主-环境微生物-病原菌之间的关系研究尚处于空白。【拟解决的关键问题】因此,本研究试图利用高通量测序分析技术探索桑轮纹病病斑内部及周边的真菌群落结构,为未来进一步揭示桑轮纹病的致病机理和构建其绿色防治技术体系提供理论基础和数据基础。
1 材料与方法
1.1 样品的前处理和采集
2017年10月31日,在青神桑轮纹病发病桑园中随机选取10株发病桑树,每株树上取10片成熟的具有桑轮纹病病斑的桑叶,用95 %的乙醇将叶片表面消毒2次,再用无菌水冲洗2次,并用无菌滤纸拭干。然后,根据病斑在叶片上的空间位置划分出病斑的核心区(简称H区)、病斑的边缘区(简称L区)和病斑周围的未发病区(简称N区)3个特定区域(图1)。其中,H区是指从外向内第2圈层及其以内的所有轮状圈层所涉及的区域,颜色通常表现为枯黄色;L区是指最外层轮状圈层(该层外半径r1-内半径r0=距离a,颜色通常为棕色)及其相连的外半径为(r1+ 1.5×a)的轮状圈层(颜色通常为绿色)。N区是指与L区外缘相邻的外半径为(r1+

H: 病斑的核心区; L: 病斑的边缘区; N: 病斑周围的未发病区; a: 距离H: Core area of lesion; L: Marginal area of lesion; N: Peripheral area of lesion; a: Distance图1 桑轮纹病病斑特定取样位置的设定Fig.1 Setting schematic of specific sampling location for mulberry ring sheath lesions
4.5×a)的轮状圈层,颜色通常为绿色。接着,每片叶子取1个病斑,并在超净工作台下用手术剪刀分别剪下H区、L区和N区。最后,按照病斑的位置将剪下的H区、L区和N区分别混合为3个不同的待测样品,用病斑位置的简称分别将样品命名为H、L、N,并将其放入4 ℃冰箱中待测。
1.2 高通量宏基因组微生物测序的样品处理
参照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的使用说明书进行DNA提取,提取DNA后进行DNA完整性检测。利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应应加入的DNA量。PCR所用的引物为已经融合了Miseq测序平台的ITS1-2通用引物。ITS1F引物为CCCTACACGACGCTCTTCCGATCTN (barcode) CTTGGTCATTTAGAGGAAGTAA,ITS2R引物为GTGACTGGAGTTCCTTGGCACCCGAGAATTCCAGCTGCGTTCTTCATCGATGC。PCR结束后,PCR产物进行琼脂糖电泳检测。真菌PCR产物和其他扩增片段小于400bp的PCR产物,选用0.8倍的磁珠处理。利用Qubit3.0 DNA检测试剂盒对回收的DNA精确定量,以方便按照1∶1的等量混合后测序。等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol。该环节委托生工生物工程(上海)股份有限公司完成。
1.3 数据分析
基于对reads数据的拼接、过滤、去嵌合及非特异性扩增序列的数据前处理,分别进行OTU聚类分析、Alpha多样性分析、物种分类分析、多维度分析和物种分类树分析。
2 结果与分析
2.1 测序序列长度分析
质量控制后,平均剩余序列52 205条,平均序列长度229.22 bp(表1)。
2.2 桑轮纹病病斑及周边内真菌的OTUs数
各样品文库的覆盖率为0.99,表明样本中序列没有被测出的概率越低,本次测序结果可代表样本的真实情况。在97 %的相似水平下,进行生物信息统计分析,共计比对1822个OTUs。其中,H区有604个OTUs,L区有499个OTUs,N区有974个OTUs。由图2可知,H、L和N区3个区域内的真菌存在明显差异,其共有OTUs较少,而多为独有的OTUs。
2.3 桑轮纹病病斑内部及周边的真菌群落结构
经过鉴定发现,除未鉴定的物种(图3中的unclassified)外,在种水平上H区中相对丰度排名前5的真菌分别是Gonatophragmiumtriuniae、Myrotheciumroridum、Bannoahahajimensis、Incertaesedissp.和Hannaellaoryzae,其相对丰度分别为96.25 %、1.04 %、0.39 %、0.37 %和0.27 %;L区中相对丰度排名前5的真菌分别是Gonatophragmiumtriuniae、Myrotheciumroridum、Bannoahahajimensis、Strelitzianaalbiziae和Cercosporaapii,其相对丰度分别为96.95 %、0.48 %、0.13 %、0.13 %和0.09 %;N区中相对丰度排名前5的真菌分别是Gonatophragmiumtriuniae、Strelitzianaalbiziae、Chaetothyriaceaesp.、Myrotheciumroridum和Ascomycotasp.,其相对丰度分别为31.29 %、13.24 %、6.99 %、6.84 %和6.39 %。
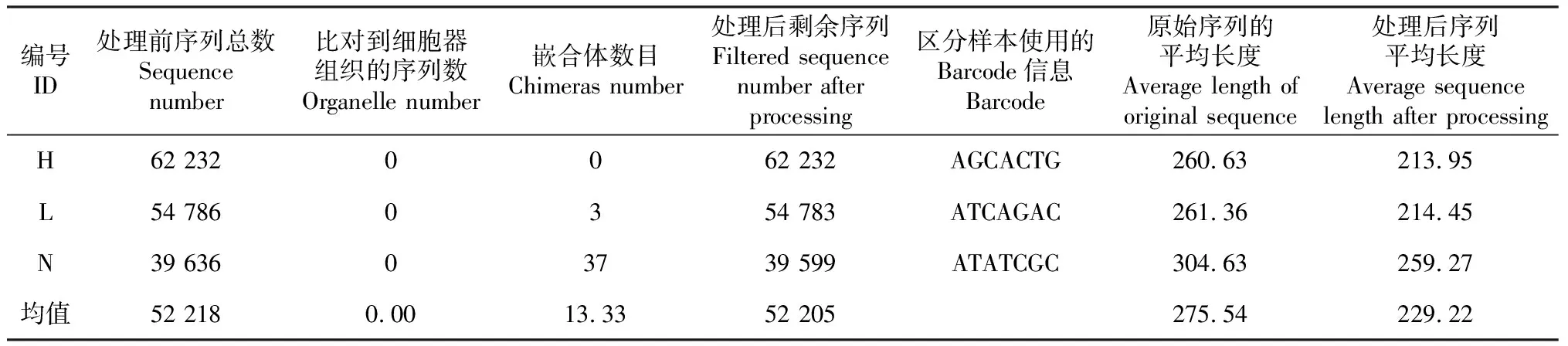
表1 测序数据处理后的结果统计表
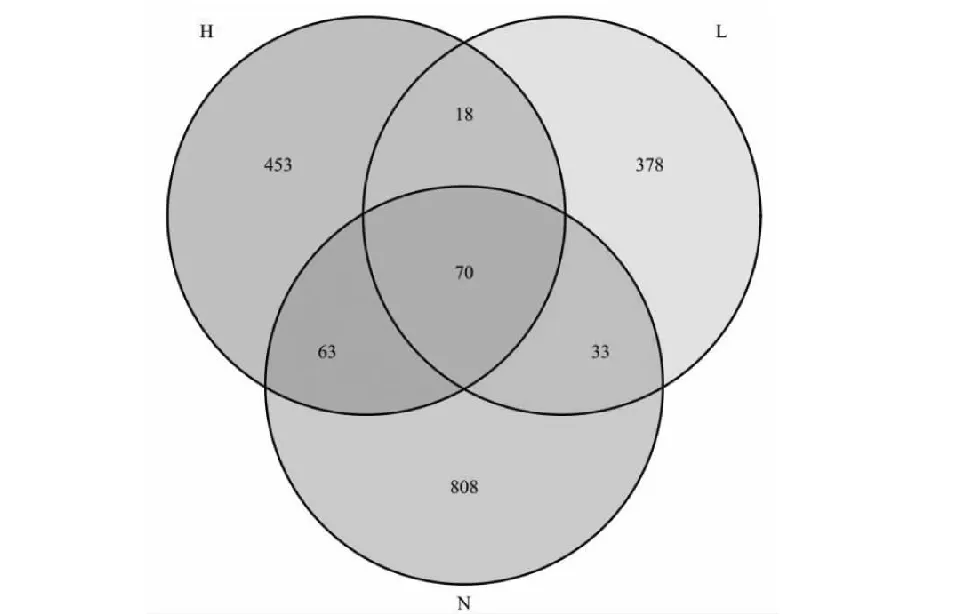
图2 桑轮纹病病斑特定取样位置共有的和独有的OTU数目Fig.2 Number of common and unique OTUs at specific sampling locations of mulberry ring sheath patches
2.4 桑轮纹病病斑内部及周边的真菌多样性
H、L和N区的Shannon多样性指数值分别为0.36、0.30和3.56,表明桑叶上病斑区内生真菌多样性低于周边未发病区。
2.5 桑轮纹病病斑内部及周边的真菌之间相关性
将除未鉴定的物种(图3中的unclassified)外,H、L和N区排名前5的真菌的相对丰度进行泊松相关性分析,结果发现:病斑内G.triuniae与B.hahajimensis、Incertaesedissp.、H.oryzae、S.albiziae、Chaetothyriaceaesp.、C.apii和Ascomycotasp.呈显著的负相关关系,其相关系数分别为-0.97、-0.99、-0.83、-1.00、-1.00、-1.00和-1.00。而其他真菌之间呈现显著的正相关关系,相关系数皆大于0.82。这表明桑轮纹病病斑的内部及周边真菌G.triuniae与其他真菌存在着激烈的竞争。
3 讨 论
3.1 桑轮纹病的病原真菌有待进一步确定
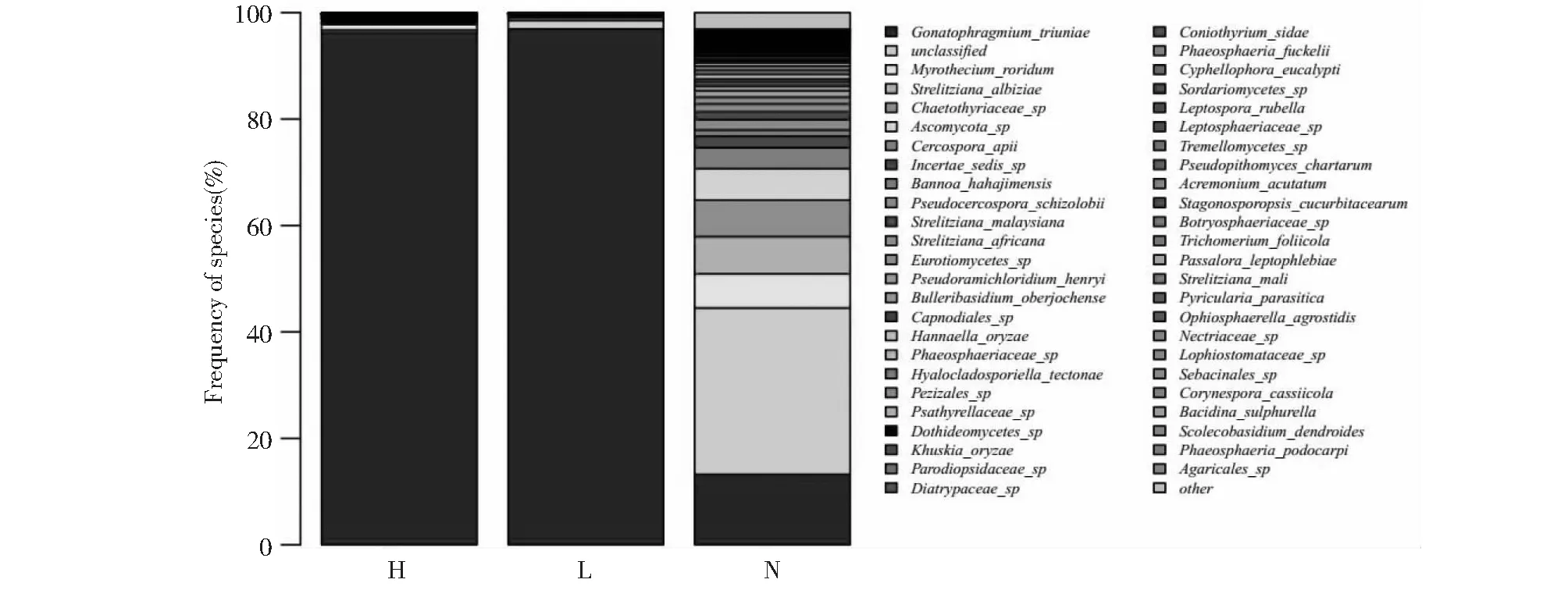
图3 桑轮纹病病斑特定取样位置的种水平上内生真菌分布Fig.3 Endophytic fungi distribution at species level at specific sampling location of mulberry ring sheath disease
本研究中病斑H和L区相对丰度最大的真菌为G.triunia,而报道的桑轮纹病的病原真菌为G.mori[1]。鉴于发病样品中检测到的最大相对丰度真菌与传统描述的病原真菌作为同属真菌,且测得的病原真菌序列与文库中G.triunia的序列比对相似度为100 %,在此,可初步认为G.triunia为桑轮纹病的病原真菌。但必须注意的是,由于目前比对文库中没有G.mori的序列记载,加之高通量测序原理上存在不完整性,G.triunia与G.mori是否为同一个种,及两者序列之间的差异到底有多大,这是尚未可知的。在尚未明确两者是同一菌种的前提下,未来还需要进一步分离桑轮纹病病原真菌并进行遗传鉴定。
3.2 桑轮纹病病斑的不断扩大与病原真菌的相对丰度密切相关
桑轮纹病病斑的不断扩大与病原真菌的相对丰度密切相关。在桑轮纹病病斑周围N区中依然存在着31.29 %相对丰度的病原真菌(G.triunia),这表明病斑的不断增大与叶片内病原真菌相对丰度的增加密切相关,且30 %的病原真菌相对丰度绝对不是其出现病斑的环境阈值。对比出现病斑的地方(L和H区),病原真菌的相对丰度都已经达到了96 %以上。
3.3 桑轮纹病病斑内病原真菌种群优势的建立主要依赖于植物毒素
病原真菌(G.triunia)在桑叶内表现出明显的竞争优势。Kinjo 等[8]于1987年研究发现桑轮纹病病原真菌可以释放植物毒素,并对这些毒素的结构进行了研究。这表明桑轮纹病病斑内病原真菌种群优势的建立主要依赖于其释放的植物毒素在真菌种群拮抗竞争过程中所起到的作用,所以它与其它主要真菌之间都呈现显著的负相关关系。
3.4 桑轮纹病病斑中心穿孔可能与Myrothecium roridum有关
桑树轮纹病发展到后期,中心会出现穿孔的现象。反观在桑轮纹病病斑H区,真菌M.roridum的相对丰度比L区高;因此,研究猜测在真菌M.roridum会在病原真菌(G.triunia)利用完叶内生长资源后对叶片进行二次资源利用。经观察,H 区组病斑类似枯叶,微生物可利用的主要部分为叶表皮的角质层。这表明了真菌M.roridum在进行二次资源再利用时,需要对角质蛋白具有明显的可利用性。经查,真菌M.roridum为桑树漆斑病的病原菌[9-11],其习性就是喜角质蛋白[12]。真菌M.roridum的这一习性基本可以回答如此假设,即H区中心出现的穿孔是由M.roridum分解完叶表皮的角质层后所留下的。虽然这需要更多的试验进行进一步的论证,但这也暗示了桑轮纹病病斑形成机理的复杂性,从病原菌的附着到病斑的出现、再到扩大和穿孔,整个过程涉及多种真菌的作用,这将为揭示桑轮纹病致病机理和研究绿色防控技术提供重要的参考依据。
4 结 论
在种水平上桑轮纹病发病叶片的病斑核心区(H区)、病斑边缘区(L区)和病斑周围的未发病区(N区)的真菌G.triuniae相对丰度排名皆是最高,分别为96.25 %、96.95 %和31.29 %。真菌M.roridum在H区的相对丰度为1.04 %,是L区的相对丰度2.17倍。该结果揭示了桑轮纹病病斑形成过程是复杂的,病斑的出现、扩大和穿孔是多种真菌共同作用的结果。此外,研究结果还引出了桑轮纹病病原菌G.mori与数据库100 %比对的真菌G.triuniae是否为同一种病原微生物需要进一步确定的科学问题。

