基于人工智能测量指标的新型冠状病毒肺炎CT影像鉴别诊断
李大胜,王娜娜,董建平,霍志毅,裴丽君,刘 曦
1. 北京市海淀医院(北京大学第三医院海淀院区) a. 放射科;b. 感染科,北京 100080;
2. 北京大学 人口研究所,北京 100871;3. 联影智能医疗科技(北京)有限公司,北京 100036
引言
新 型 冠 状 病 毒 肺 炎(Coronavirus Disease 2019,COVID-19)是由一种新型的冠状病毒引起的,国际病毒分类委员会冠状病毒研究小组将该病毒命名为SARS-CoV-2。该病毒具有较强的传染性,感染者病情发展迅速,严重者会出现呼吸窘迫综合征、呼吸衰竭等并发症,可导致死亡[1]。目前,临床诊断主要依据流行病学史、临床症状、实验室检查结果、胸部影像表现以及核酸检测(咽拭子或血清抗体)或基因测序同源对比等信息,并将患者分为疑似病例和确诊病例。针对疫情,国家卫健委发布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》[1],在临床上依据肺炎影像学特征将疑似患者纳入“临床诊断病例”的分类,胸部影像学检查在COVID-19诊断中的作用越来越重要。此外,国家卫健委发布的《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》[2]指出,胸部影像学显示24~48 h内病灶明显进展>50%者按重型管理,表明胸部影像学征象对于COVID-19的治疗具有重要的指导作用。
然而,COVID-19与其他病原体引发的社区获得性肺炎(Community Acquired Pneumonia,CAP)之间的鉴别诊断依然是临床工作中的重点和难点,早诊断和早治疗对影像和临床医生提出了更大的挑战[3-5]。近年来,临床应用的人工智能(Arti ficial Intelligence,AI)辅诊系统具备良好的检测敏感性和自动定量分析功能[5-8]。目前,针对COVID-19疫情的AI辅诊系统也已经开始在临床使用。本文旨在探索“影像AI辅诊系统”在COVID-19与其他CAP鉴别诊断中的应用价值。
1 资料与方法
1.1 一般资料
2019年1月27日至2020年2月20日期间,收集了北京市海淀医院(北京大学第三医院海淀院区)103例肺炎患者,其中29例病例SARS-CoV-2的核酸检测阳性,确诊为COVID-19患者,作为病例组,诊断标准符合国家卫健委《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[3];74例为排除COVID-19的CAP患者,为对照组。103例患者的年龄范围为15~86岁,年龄中位数38岁。COVID-19组患者均经核酸检测为阳性确诊,具有典型的流行病学接触或暴露史,其中10例患者具有武汉旅行史或居住史,19例患者具有与确诊病例密切接触史或共同居住史,19例中的7例为家庭聚集发病。CAP组74例患者为在同一时间段就诊于我院的CAP患者,部分核酸检测为阴性,且全部随诊排除了COVID-19。两组患者的临床症状主要包括:发热、咳嗽、咽痛、乏力、腹泻和肌肉酸痛等。临床化验有或无白细胞升高、淋巴细胞减低等情况。收集两组患者的胸部CT影像资料,CT影像诊断由2名具有诊断经验的资深医师(10年以上年资,主治医师)完成。
1.2 检查及诊断方法
(1)检查方法。所有患者均进行胸部CT平扫,采用美国GE公司64排VCT扫描仪和中国联影公司40排UCT530扫描仪。扫描参数:管电压120 kV,管电流自动调节,层厚 5 mm,层间距 5 mm,薄层重建 0.625~1 mm,扫描范围自胸廓入口至后肋膈角水平。所有原始图像经过影像归档和通信系统传输至影像诊断工作站。
(2)诊断方法。所有图像由2名具有丰富工作经验的放射诊断医师分别采用常规阅片和AI辅诊系统辅助阅片方式进行分析。同时应用AI辅诊系统进行定量分析,根据病变累及范围、病变区域密度值等级划分,得出感染区域体积占比及感染区域实变分析报告。结合病例的影像和临床情况,探讨基于AI测量指标的COVID-19和CAP患者CT图像的鉴别诊断价值。
本研究使用的AI辅诊系统(uAI新冠肺炎智能辅助分析系统,上海联影智能医疗科技有限公司)通过学习大量COVID-19病人的CT影像数据,可以自动识别胸部CT影像中炎症病变的影像特征,并进行全自动病灶勾画、病灶体积测量及体积占比的量化分析。该系统的分割技术基于VB-Net[9-11]卷积神经网络来实现。相较于其他图像分割网络,VB-Net采用了模型压缩及显存优化等技术,具有运行速度快、资源消耗小等特点,更适合处理三维医学影像的分割任务。CT胸部影像分析流程:① 导入患者胸部CT影像,对左右肺、肺叶和肺段进行分割;② 分割肺内的病灶;③ 统计分割得到的病灶在全肺、左肺和右肺的体积,以及相应的感染百分比,同时结合病灶在肺内的分割统计病灶内不同密度(Houns field Unit,HU)区间的体积以及全肺占比。这些量化指标可以更为有效地描述COVID-19患者的典型与不典型CT征象。
1.3 统计学分析
首先,采用χ2检验方法检验性别在COVID-19组和CAP组间的差异;对年龄的原始数据进行log转换,采用t检验分析两组年龄的差异;将AI测量数据(不同密度的感染体积及感染占比)进行log数据转换后,使数据的分布符合或接近正态分布,且方差齐性,然后采用One-way ANOVA检验AI测量值在两组之间的差异,采用均值±标准差(±s)表示对数转换后的平均水平。应用SPSS 20.0进行统计分析,P<0.05作为统计学显著性水平。
2 结果
2.1 COVID-19组和CAP组的CT影像资料分析
COVID-19具有一定的影像学典型征象。在临床实践中,根据病变受累的范围和表现,推荐将COVID-19的CT表现分为3个阶段:早期、进展期和重症期,部分患者经过隔离治疗可出现放射学的转归期[1-3,12]。本研究入组的29例COVID-19患者的初次CT检查,涵盖了不同阶段的CT表现征象。
COVID-19早期CT表现为单肺或双肺多发局限性磨玻璃影、结节影、淡片影,或者斑片状、片状磨玻璃阴影,病变多散在分布,边界不清。COVID-19单发病灶与多发病灶,分别见图1和图2。进展期CT表现为双肺多发磨玻璃影、程度不等的实变影。重症期CT表现为双肺弥漫性磨玻璃及实变,密度不均,实变影内见空气支气管征与支气管轻度扩张,双肺大部分受累时呈“白肺”表现,伴少许纤维索条影,并双侧少量胸腔积液。
本研究的COVID-19组和CAP组的影像特点与其他研究结果基本相同,根据形态学特点可以做出初步鉴别判断[12-13]。但部分病例鉴别诊断仍存在困难,常规阅片的方法无法在第一时间排除COVID-19,还需要等待核酸检测等临床检查结果后才能确认。

图1 COVID-19单发病灶CT图像
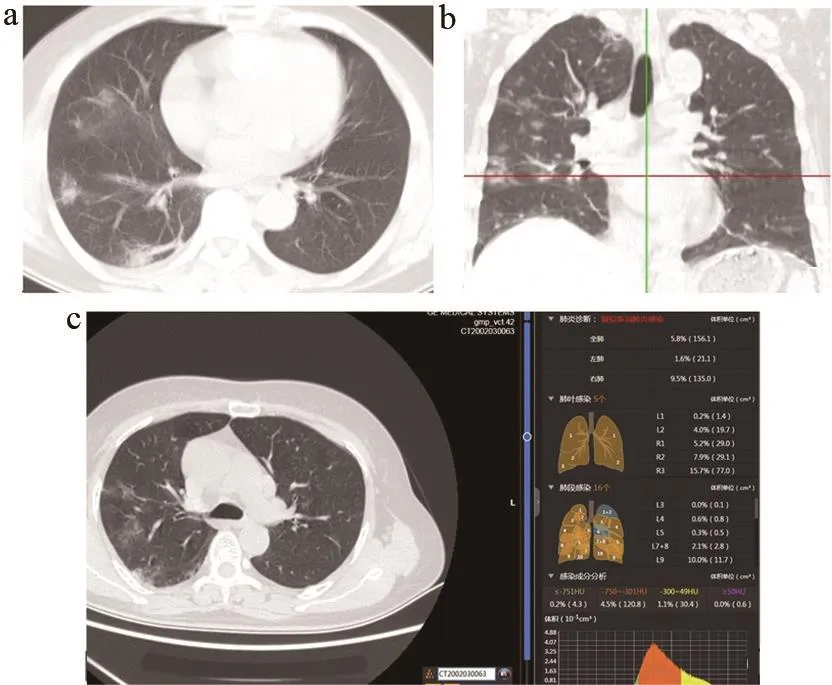
图2 COVID-19多发病灶CT图像
2.2 AI辅诊系统对COVID-19和CAP鉴别诊断结果
29例COVID-19病例中,男女比例分别是44.83%和55.17%;74例CAP对照组患者中,男女比例分别是59.46%和40.54%,采用χ2检验性别在两组之间的差异无统计学显著性(P>0.05);COVID-19组的年龄中位数是46岁,年龄范围24~86岁,CAP组年龄中位数是37岁,年龄范围是15~80岁。将年龄原始数据经log转换后进行t检验,年龄在COVID-19组和CAP组间无统计学显著性差异(P>0.05)(表1),年龄和性别在两组之间无统计学显著性,表明两组具有较好的可比性。
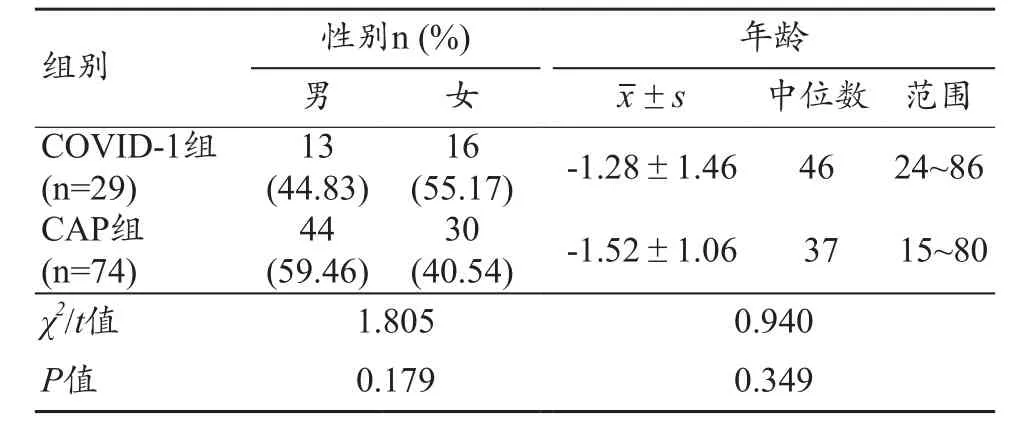
表1 COVID-19组和CAP组的性别和年龄比较
COVID-19组和CAP组的AI测量值比较,见表2。表2中数据均为对数转换后的均数,接近或符合正态分布,且方差齐性,采用One-way ANOVA检验两组在AI测量值的差别,使用±s表示对数转换后的平均数。研究结果显示,密度为HU(-750,-300)的感染体积及感染病灶占比在COVID-19组和CAP组之间均存在显著的统计学差异(P<0.05);全肺感染体积及其感染占比、左肺感染体积及其感染占比、右肺感染体积及其感染占比、HU(<-750)感染体积及其感染占比、HU(-300,49)感染体积及其感染占比在两组之间无统计学差异(P>0.05)。图3显示了HU(-750,-300)感染体积及感染占比在COVID-19组和CAP组之间的比较结果,显示COVID-19组的HU(-750,-300)感染体积平均水平及感染占比平均水平均显著高于CAP组。
3 讨论
CT影像是筛查COVID-19的有效方法,与核酸检测相比耗时少,完成一次胸部CT扫描仅需要几十秒。高清晰度的CT图像可以通过网络传输,便于远程阅片。CT图像的分辨力高,可以很好地显示肺部病灶的细节及特点,但薄层CT影像图片较多、工作量大,一次CT扫描就产生超过300幅影像。诊断准确性取决于影像诊断医师的水平和细致程度,工作强度较大,容易出现漏、误诊。我院作为北京市COVID-19定点收治医院,引入“uAI新冠肺炎智能辅助分析系统”,处理完成300余幅图像仅需10 s,而人工处理需要10~15 min以上才能完成全部评价,现在AI+人工大约5 min就可以完成,大幅提高了临床诊断效率,为临床COVID-19的准确诊断提供了新的依据和保障[4-6,14-15]。
表2 COVID-19组和CAP组之间的AI测量值比较(±s)
注:表中变量均为对数转换后,接近或符合正态分布且方差齐性,采用One-way ANOVA检验。
组别占比(%)COVID-19(n=29)全肺感染 左肺感染 右肺感染 HU (<-750)感染 HU (-750, -300)感染 HU (-300, 49)感染体积(cm3)占比(%)体积(cm3)占比(%)体积(cm3)占比(%)体积(cm3)占比(%)体积(cm3)占比(%)体积(cm3)-1.28±1.46 CAP(n=74)3.86±1.78 0.20±1.63 1.98±2.64-0.39±1.85 2.21±3.04-0.09±2.05 0.98±1.90-1.77±1.02 3.52±1.74-0.08±1.51 1.67±2.28-1.52±1.06 F值 3.671 3.784 2.776 2.326 2.505 3.957 3.291 2.839 5.201 6.402 0.654 0.884 P值 0.058 0.055 0.099 0.130 0.117 0.049 0.073 0.095 0.025 0.013 0.421 0.349 3.07±1.92-0.43±1.43 0.98±2.77-0.98±1.72 1.22±2.76-0.84±1.57 0.23±1.87-2.03±0.55 2.57±1.94-0.85±1.34 1.29±2.13
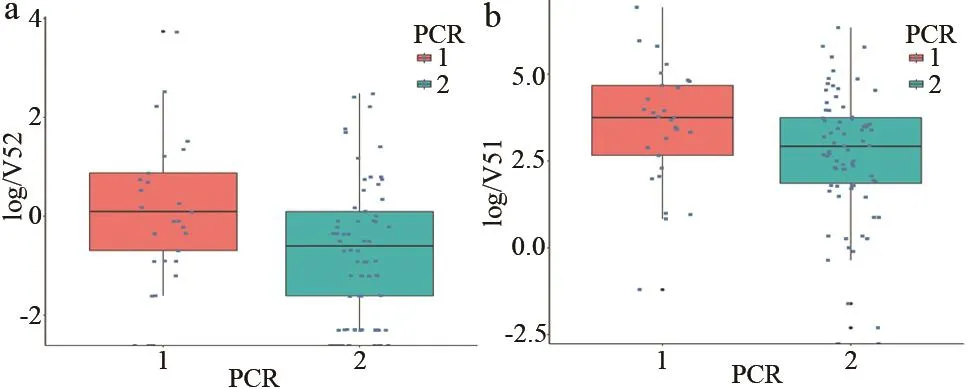
图3 COVID-19组和CAP组的HU(-750,-300)感染体积(a)及感染占比(b)散点分布图
COVID-19和CAP患者的CT影像存在差别。目前,临床上更多的是进行形态学内容分析、定性描述[9-10,16-17],而我们通过在临床工作中应用AI,可以对肺炎病灶进行的定量分析,其中的部分指标对COVID-19的诊断和鉴别诊断具有统计学意义。基于AI测量指标的COVID-19 CT影像鉴别诊断在临床上也可以实现。
目前,针对COVID-19的影像学特征还缺乏定量评估的分析和研究,很多研究都是以影像表现的描述为主[16-18]。有研究报道了基于影像特征的AI辅诊系统,探讨了AI在肺炎诊断中的作用[4-5],提出重型及危重型COVID-19患者病灶占整肺百分比呈现递增趋势。本研究以轻型和普通型为主,病灶占整肺百分比程度相对较小,同样验证了该系统的定量评估作用。对于肺炎疑似患者,该系统会立即生成肺炎分析报告,包含感染区域体积占比和感染区域实变分析两个方面,感染区域体积占位分析了病灶在全肺、每个肺叶的体积比例。
本研究中COVID-19组与CAP组的统计学比较显示,HU(-750,-300)感染体积及感染占比在两组间均存在统计学意义。而全肺感染体积及其感染占比、左肺感染体积及其感染占比、右肺感染体积及其感染占比、HU(<-750)感染体积及其感染占比、HU(-300,49)感染体积及其感染占比在两组之间无统计学差异(P>0.05)。本研究中COVID-19和CAP组的病灶密度存在差别,初诊的COVID-19感染区域内密度为HU(-750,-300)的成分与CAP的成分之间存在差异,提示了COVID-19病灶内的密度较低,也就是密度在HU(-750,-300)的病灶体积较大,占全部病灶的比例较大。在国内外的研究中,通常把这种病灶描述为磨玻璃样密度影[9-13,19-21],但是这种计算定量测量密度和比例的工作在人工阅片诊断时无法完成。AI辅助诊断可以非常快捷和准确地获得定量数据,与人工传统阅片相结合,可以对炎症病灶中所谓的磨玻璃密度影病灶进行定量分析,从而为COVID-19和CAP的鉴别诊断提供更确切的依据。
4 结论
CT检查结果是COVID-19确诊的重要手段,在临床筛查工作中具有明显的优势。AI辅诊系统可以大大提高CT的诊断效率,并在对病灶量化测量的基础上,通过对肺炎病灶的形态学观察,对COVID-19和CAP进行鉴别诊断,使CT在筛查中发挥更大的作用。本研究的不足之处在于样本量较小,对COVID-19的定量研究尚缺乏大数据支持,需要在更多的临床应用中去验证。

