加工方式对非发酵面团小麦醇溶蛋白致敏性的影响
王 娜,孟利军,黄忠民,艾志录,崔晨旭,4,张改平
·农产品加工工程·
加工方式对非发酵面团小麦醇溶蛋白致敏性的影响
王 娜1,2,3,4,5,孟利军1,3,4,5,黄忠民1,3,艾志录1,3,崔晨旭1,3,4,张改平2,5※
(1. 河南农业大学食品科学技术学院,郑州 450002;2. 河南农业大学牧医工程学院,郑州 450002;3. 农业农村部大宗粮食加工重点实验室,郑州 450002;4. 郑州市营养与健康食品实验室,郑州 450002;5. 农业农村部动物免疫学重点实验室,郑州 450002)
该研究探究了热加工(水煮、烘烤、微波、高温高压)、冷处理(液氮、速冻机速冻)和非热加工(超高静压、辐照、脉冲强光、臭氧和超声波)处理对非发酵面团小麦醇溶蛋白致敏性的影响。利用SDS-PAGE 和双抗体夹心ELISA 法研究各种加工处理后非发酵面团小麦醇溶蛋白的分子量和致敏性变化。结果表明:200 和300 MPa的超高静压处理后,非发酵面团小麦醇溶蛋白的致敏性显著增加(<0.05),均增至125%左右;水煮、微波、高温高压、烘烤、液氮、速冻机处理、超高静压250 MPa、辐照(7、13 kGy)、臭氧熏蒸、脉冲强光和超声波处理均能显著降低非发酵面团小麦醇溶蛋白的致敏性(<0.05),其中以水煮、高温高压、液氮、臭氧和脉冲强光(PL-1)处理的脱敏效果最显著(<0.01),均降至60%左右。由此可知,加工方式能够显著影响非发酵面团小麦醇溶蛋白的致敏性,可作为食品中过敏原安全控制的有效手段,为脱敏食品的生产提供有效参考。进一步研究需要结合其他体内试验的评估,特别是小麦易敏人群的临床试验。
加工; 蛋白; 非发酵面团;小麦醇溶蛋白;致敏性
0 引 言
小麦作为世界上最重要的粮食作物,1/3以上人口以它为主粮;同时,小麦是世界粮农组织(FAO)认定的八大食物过敏原之一[1]。小麦致敏蛋白种类多(清蛋白、球蛋白、醇溶蛋白、谷蛋白)、致敏途径和机制复杂、过敏病症特性强,对过敏患者的生活产生了严重影响。小麦过敏多属于迟发型,有较高的漏诊率和错诊率,随着人们认识度的提高,已成为一个不可忽视的食品安全问题[2]。近几年来,小麦过敏的发病率逐年上升,世界上有0.2%〜0.9%的成人和0.4%〜1.3%的儿童患有小麦过敏[3-4]。中国是世界上最大的小麦生产国、消费国和进口国。Jiang等[5]研究发现小麦(37%)也是诱发中国人群过敏性休克最常见食物。
小麦醇溶蛋白是小麦中一种主要过敏原,研究认为它是乳糜泻患者的主要诱因[6]。乳糜泻肠炎是遗传易感患者摄入小麦麸质(麦醇溶蛋白和麦谷蛋白的复合物)后不能耐受所致的慢性小肠吸收不良综合症[7]。麸质蛋白上的某些T细胞表位引发乳糜泻,特别是来自/-以及-醇溶蛋白(相对前者较少)上的表位[8]。小麦醇溶蛋白也能诱发食物依赖运动激发过敏[9-10],如Battais 等[11]报道了引起法国成人小麦过敏、荨麻疹、小麦依赖运动诱发的过敏性休克的主要过敏原是-醇溶蛋白。
加工能改变食物过敏原的结构,从而影响其致敏性。Leszczynska等[12]用2.2〜12.8 kGy辐照处理商品麦醇溶蛋白粉和小麦粉发现其变应原性增加与所施剂量呈线性关系,辐射小麦粉中提取的醇溶蛋白免疫反应性增加高于纯麦醇溶蛋白。Kwak等[13]用竞争型 ELISA 研究发现,高温高压处理后小麦醇溶蛋白的 IgG结合力降低至69%,单纯微波处理则无影响,微波与高温高压联合处理后IgG 结合力降低至73%。Mazzeo等[14]用两步转谷氨酰胺酶法处理小麦粉,其麦醇溶蛋白和麦谷蛋白的致敏性分别降低了7.6%和7.5%,而小麦粉的烘焙品质没有劣变。Varjonen等[15]将小麦粉自80 ℃加热至120 ℃,发现中性或酸性致敏原RAST(Radio Allergo Sorbent Test)值变小,说明烘焙加工能在一定程度上降低小麦蛋白的致敏性。路雪蕊[16]研究高压加热、微波、超声波和酶法处理对小麦粉致敏性的影响,发现酶法处理是有效地降低小麦粉致敏性的方法,其中菠萝蛋白酶和木瓜蛋白酶同步法酶解小麦粉脱敏效果最显著,其致敏性能降低36.1%。Li等[17]研究发现地衣芽孢杆菌的碱性蛋白酶和木瓜果实的乳胶中的木瓜蛋白酶具有比风味酶,胃蛋白酶,胰蛋白酶或-胰凝乳蛋白酶更大的降低小麦面粉中麦醇溶蛋白含量的能力,碱性蛋白酶-木瓜蛋白酶依次处理小麦粉,几乎被完全去除麦醇溶蛋白,其面粉提取物显示出最低的IgE结合力。
本文结合中国饮食特点,选取天然小麦品种,制作成非发酵面团,研究水煮、微波、烘烤、高温高压4种面团熟化方式和超高静压、辐照等几种新型非热加工对非发酵面团小麦醇溶蛋白致敏性的影响,以期在工业应用层面上提供理论指导,开发过敏个体耐受的低过敏性面制品。
1 材料与方法
1.1 材料与试剂
主要材料与试剂如表1所示:

表1 主要材料与试剂
1.2 仪器与设备
主要仪器与设备如表2所示:
表2 主要仪器与设备
1.3 试验方法
1.3.1 不同加工处理非发酵面团
选取小麦品种为郑麦7698,润麦,磨粉,以每100 g面粉加入50 mL水(50%)为基准,手工和面10 min左右制作成非发酵面团,并在面条机压面档的 4.0、3.0、2.0、1.5、1 mm轧距上分别轧面1道,制得1 mm厚的面皮,然后分别进行以下处理,如表3所示:
未处理的非发酵面团作为阳性对照CK,每个处理设3个重复,所有处理样品均立即冷冻干燥,打磨成粉,4 ℃存放备用。
1.3.2 样品小麦醇溶蛋白的提取
具体参考潘治利等[23]的方法提取样品小麦醇溶蛋白:首先称取0.1 g样品于2 mL离心管中,加入2颗磁珠,加1 mL蒸馏水,混匀,4 ℃振荡提取30 min,7 000 r/min 4 ℃离心10 min,弃上清,依此重复3次,弃上清,除去清蛋白;然后加入1 mL 2%的NaCl溶液,混匀,4 ℃振荡提取30 min,7 000 r/min 4 ℃离心10 min,弃上清,依此重复3次,弃上清,除去球蛋白;最后向离心管中加1 mL 70%的乙醇溶液,混匀,4 ℃振荡提取30 min,7 000 r/min 4 ℃离心10 min,收集上清,即为醇溶蛋白。用0.45m尼龙66膜过滤备用。4 ℃下可保存1周;长期保存置于-20 ℃。

表3 非发酵面团的不同加工处理
1.3.3 SDS-PAGE凝胶电泳
具体参照蛋白质电泳技术[24]。
1.3.4 夹心法ELISA测定蛋白的致敏性
试验方法参考秦倩茹等[25]和试剂盒说明书,并略作修改,具体如下:先将所有样品小麦醇溶蛋白的浓度统一调节为750 ng/L,上样时再用试剂盒自带样品稀释液最终稀释5倍,符合试剂盒检测范围 8〜250 ng/L。分别设空白孔(只加70%乙醇,不加样品及酶标试剂,其余各步操作相同)、待测样品孔。然后按照下列操作进行夹心ELISA试验:
样品抗原与一抗结合→温育→洗涤→加入酶标抗体(空白孔除外)→温育→洗涤→显色→浓硫酸终止反应→酶标仪读数
按照公式(1)计算非发酵面团小麦醇溶蛋白的致敏性残存率
致敏性残存率/%= [(OD2-OD0)/( OD1-OD0)]×100(1)
式中OD0为70%乙醇的吸光值,OD1为阳性对照的吸光值,OD2为经处理样品的吸光值。每个处理重复测3次。
1.3.5 数据处理
数据分析采用Excel 2007和SPSS.16.0软件,各组数据采用单因素方差分析(One-Way ANOVA),<0.05表示具有显著差异,<0.01表示差异极显著。
2 结果与分析
2.1 热加工和冷处理对非发酵面团小麦醇溶蛋白致敏性的影响
2.1.1 热加工和冷处理非发酵面团小麦醇溶蛋白的SDS-PAGE 电泳结果分析
由图1中的CK可知,小麦醇溶蛋白的/-和-亚基分子量在30〜45 kDa之间,-gliadins分子量在46〜74 kDa之间。如图1所示,高温高压处理(GG)后,小麦醇溶蛋白30〜45 kDa左右特征谱带几乎完全消失;其他处理后小麦醇溶蛋白30〜45 kDa左右特征谱带变化均不显著,说明小麦醇溶蛋白的-/-和-亚基有一定的热稳定性。水煮处理(SZ)后,50 kDa左右条带颜色加深,25 kDa左右有两条蛋白条带变得清晰,说明有小分子蛋白生成。烘烤处理(HK)后,50 kDa左右条带颜色加深,100 kDa左右有3条条带生成;高温高压处理后,非发酵面团小麦醇溶蛋白50 kDa左右条带颜色加深,60kDa、100 kDa左右有条带生成。100 kDa左右有条带生成,说明长时间(5 min以上)高温处理可使小麦醇溶蛋白凝聚,形成大分子蛋白。
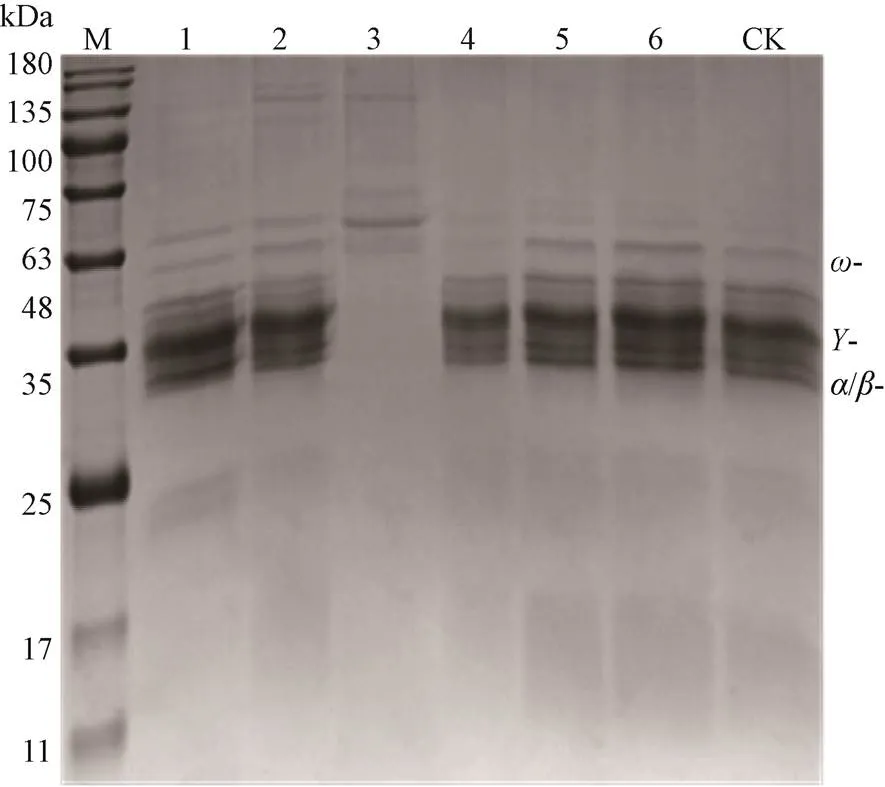
M:Marker;CK:阳性对照;泳道:1.水煮(SZ);2.烘烤(HK);3.高温高压(GG);4.微波(WB);5.液氮(YN);6.速冻机(SD),下同。
2.1.2 热加工和冷处理非发酵面团小麦醇溶蛋白的ELISA结果分析
热加工和冷处理后非发酵面团小麦醇溶蛋白的致敏性均显著降低(<0.05),如图2所示:其中水煮、高温高压和液氮处理导致小麦醇溶蛋白的致敏性极显著降低(<0.01),均降至60%左右;烘烤导致其致敏性降至76.69%;微波导致其致敏性降至85.36%;速冻机处理导致后其致敏性降至79.49%。

注:不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
水煮是湿热处理,可能是水分子的介入使小麦醇溶蛋白生成小分子蛋白质(25 kDa左右蛋白条带)导致其消化稳定性降低,同时也有可能是部分小麦醇溶蛋白转移到了处理水中[26];微波处理后,非发酵面团小麦醇溶蛋白的分子量没有显著变化,其致敏性降低可能是因为微波处理导致其空间构型发生改变;结合图1知,高温高压处理后,非发酵面团小麦醇溶蛋白30〜45 kDa左右特征谱带几乎完全消失,但其致敏性只降至60% 左右,并未随着蛋白条带的缺失而丧失,推测一是可能形成新的抗原表位,二是其抗体结合位点热稳定性强,并未随着蛋白变性甚至降解而失去活性[27]。高温高压同为湿热处理,也可能是水分子的介入使小麦醇溶蛋白抗原表位发生改变,其消化稳定性降低为其致敏性降低提供了可能[28]。烘烤和高温高压处理后,在共价或非共价作用下形成分子内或分子间聚合物,生成大分子蛋白(100 kDa左右),一定程度上掩盖了蛋白过敏原表位,进而降低小麦醇溶蛋白的免疫反应性[29]。
2.2 非热加工对非发酵面团小麦醇溶蛋白分子量和致敏性的影响
2.2.1 非热加工处理非发酵面团小麦醇溶蛋白的SDS-PAGE电泳结果分析
非热加工处理后非发酵面团小麦醇溶蛋白的电泳图谱如图3所示:与CK相比,臭氧、脉冲强光和超声波处理后非发酵面团小麦醇溶蛋白30〜45、46〜74 kDa特征条带的大小、数目和灰度变化不显著,说明这些处理对非发酵面团小麦醇溶蛋白的分子量影响不显著。
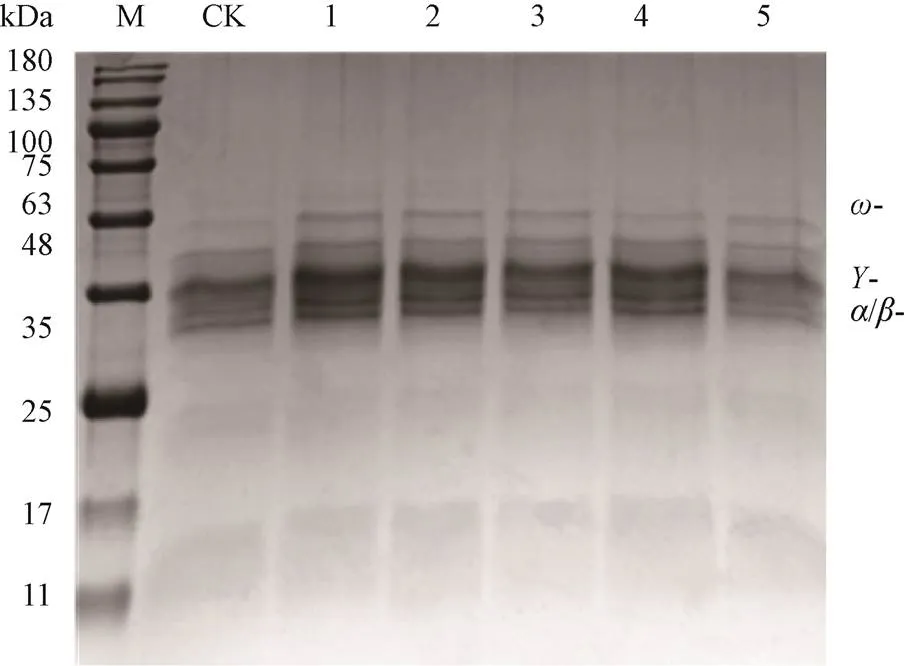
M:Maker;CK:阳性对照;泳道:1.臭氧熏蒸(O3-1);2. 臭氧熏蒸(O3-2);3.脉冲强光1(PL-1);4.脉冲强光2(PL-2);5.超声波(CS),下同。
2.2.2 非热加工处理非发酵面团小麦醇溶蛋白的ELISA结果分析
非热加工后非发酵面团小麦醇溶蛋白的致敏性均显著降低(<0.05),如图4所示:其中以臭氧熏蒸30min(O3-1)、臭氧熏蒸60 min(O3-2)、脉冲强光闪照70次(PL-1)处理后其致敏性降低最显著(<0.01),分别降至61.84%、66.65%、62.25%,;脉冲强光闪照140次(PL-2)时,其致敏性又升至79.08%;500W超声波处理2 h时,其致敏性降至90.23%。
臭氧熏蒸处理后非发酵面团小麦醇溶蛋白的致敏性降低,可能是因为臭氧能够对物质进行氧化,会破坏、影响蛋白质的结构[30-31];脉冲强光能明显降低非发酵面团小麦醇溶蛋白的致敏性,其脱敏效果随着时间延长而降低,可能与其光热作用、聚合作用以及催化效应能使蛋白质聚合改变过敏原结构有关,但其确切机制尚不清楚。Zhao等[32]研究发现PL脉冲光能够将整个花生核内的所有主要变应原减至无法检测到;高强度超声波引发“空穴效应”形成局部高压高温区,导致食物蛋白质构象变化,从而影响其致敏性[33]。研究发现超声处理可降低三文鱼过敏原Sals 1蛋白抗原性,但不能达到完全消除的效果[34]。
2.3 超高静压处理对非发酵面团小麦醇溶蛋白分子量和致敏性的影响
2.3.1 超高静压处理非发酵面团小麦醇溶蛋白的SDS-PAGE电泳结果分析
超高静压处理后非发酵面团小麦醇溶蛋白SDS-PAGE电泳图谱如图5所示,与CK相比,超高静压处理后,非发酵面团小麦醇溶蛋白目的片段的大小、位置、灰度均没有发生显著变化,说明超高静压对非发酵面团小麦醇溶蛋白分子量无显著影响,可能是由于超高静压不能使小麦醇溶蛋白的一级结构发生解聚、交联或裂解,不能生成一些小颗粒亚基单位或者分子量更大的蛋白质。
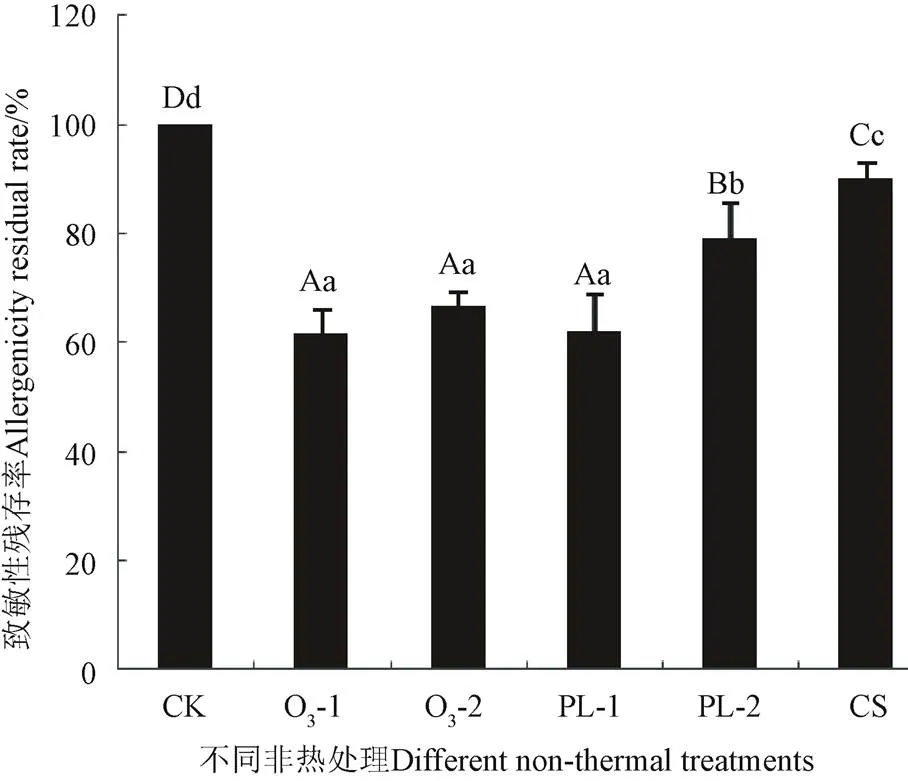
图4 非热处理非发酵面团小麦醇溶蛋白致敏性的变化
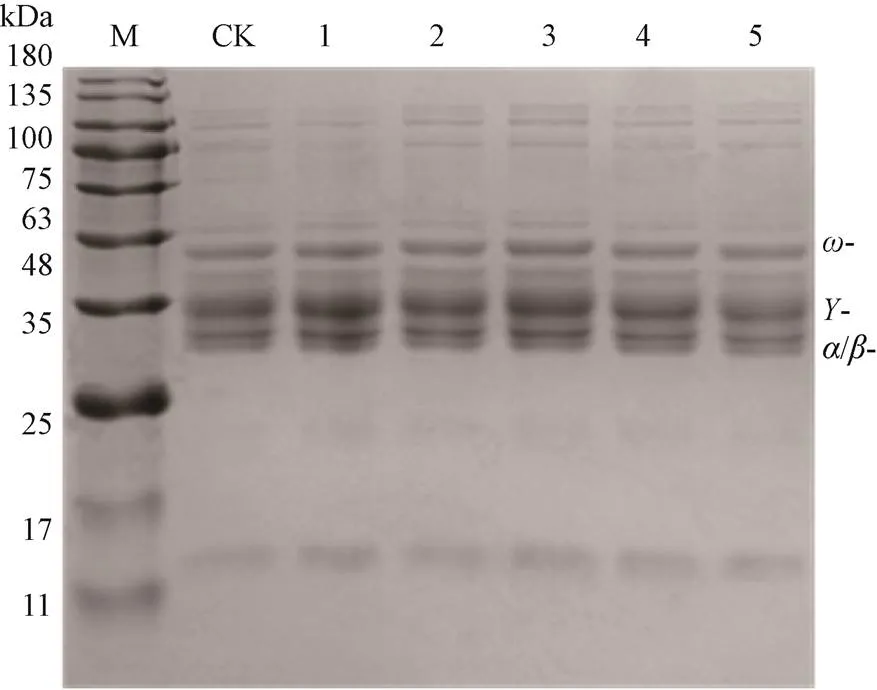
M:Maker;CK:阳性对照;泳道1-5表示处理压力:100、150、200、250、300 MPa,下同。
2.3.2 超高静压处理非发酵面团小麦醇溶蛋白的ELISA结果分析
保压温度35 ℃,保压时间20 min时,100〜300 MPa超高静压处理非发酵面团小麦醇溶蛋白,其致敏性先升高后降低再升高,如图6所示呈波动型变化。其中100 、150 MPa处理后,与CK相比,其致敏性变化不显著(>0.05);200 MPa处理后,其致敏性显著增至127.27%,说明适当超高静压处理对小麦醇溶蛋白有增敏作用;250 MPa处理时,其致敏性又显著降至80.94%,这可能是由于随着压力增加蛋白质结构不断发生变化,使过敏原表位被掩盖或破坏,从而使其致敏性降低[35];300 MPa处理时,其致敏性又明显增至128.17%,蛋白质的结构进一步发生变化,被掩盖的抗原表位又表露出来,使过敏蛋白的致敏性增加。
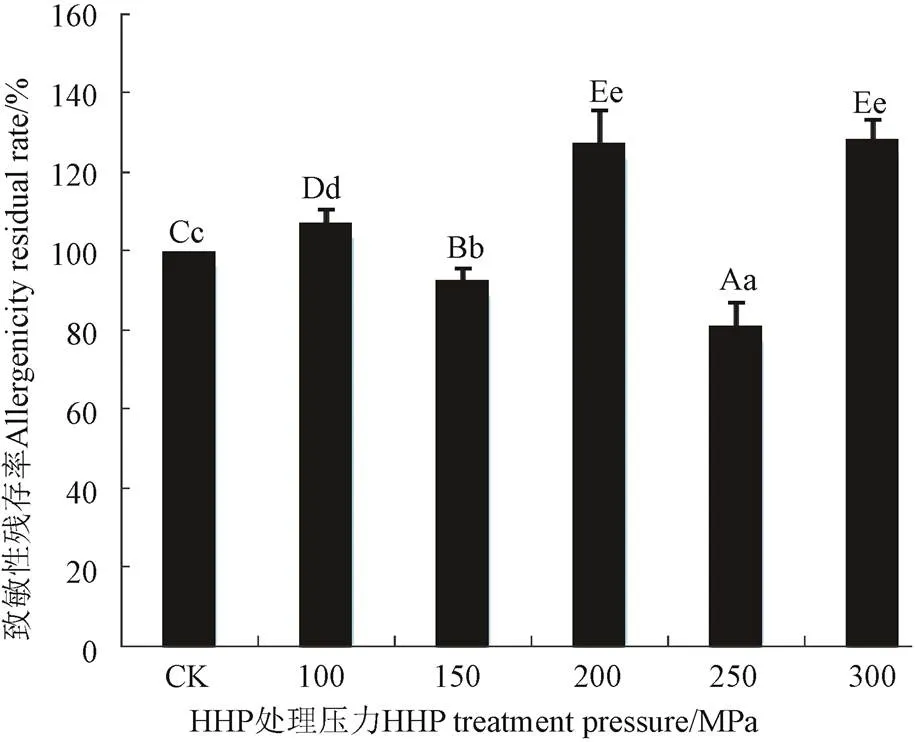
图6 超高静压处理非发酵面团小麦醇溶蛋白致敏性的变化
2.4 辐照处理对非发酵面团小麦醇溶蛋白致敏性的影响
2.4.1 小麦醇溶蛋白的SDS-PAGE电泳结果分析
1〜15 kGy-60Co辐照处理后非发酵面团小麦醇溶蛋白的SDS-PAGE电泳图谱如图7所示,小麦醇溶蛋白特征条带的大小、数目和灰度变化均不显著,说明辐照处理对非发酵面团小麦醇溶蛋白的分子量影响不显著。
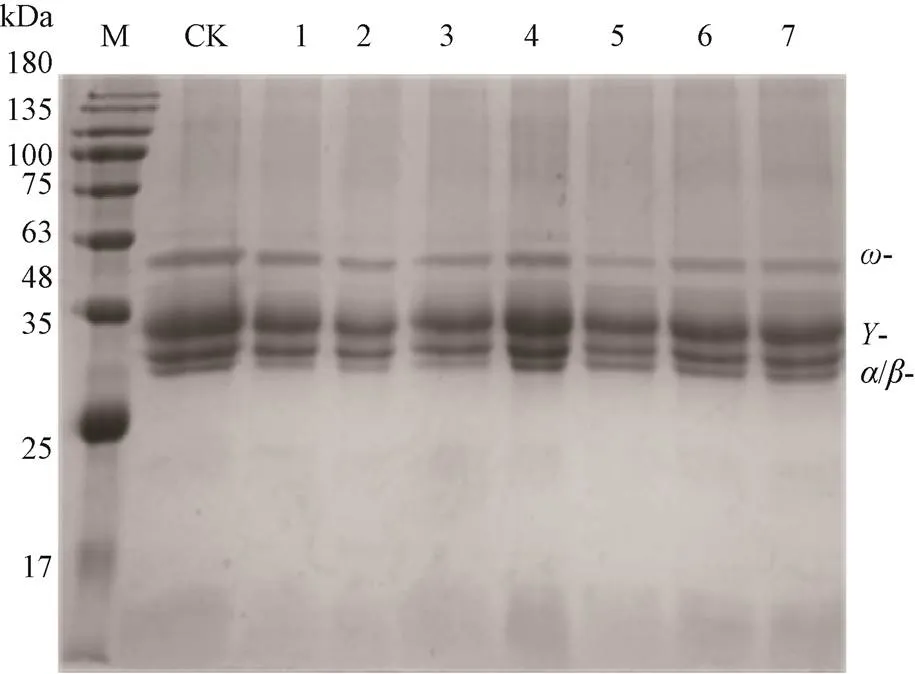
M:Maker;CK:阳性对照;泳道1-7表示辐照剂量:1、3、5、7、10、13、15 kGy,下同。
2.4.2 小麦醇溶蛋白的ELISA结果分析
1〜15 kGy剂量-60Co辐照处理导致非发酵面团小麦醇溶蛋白致敏性呈波动型变化,如图8所示先降低后升高再降低。与CK相比,辐照剂量为1、3、5、10、15 kGy处理非发酵面团时,其致敏性变化不显著(>0.05);7 kGy时,其致敏性降至72.32%;13 kGy时,其致敏性降至84.03%。结合图7可知,辐照能降低小麦醇溶蛋白致敏性主要是可能因为辐照导致蛋白质二级结构或者高级结构发生变化[36]。
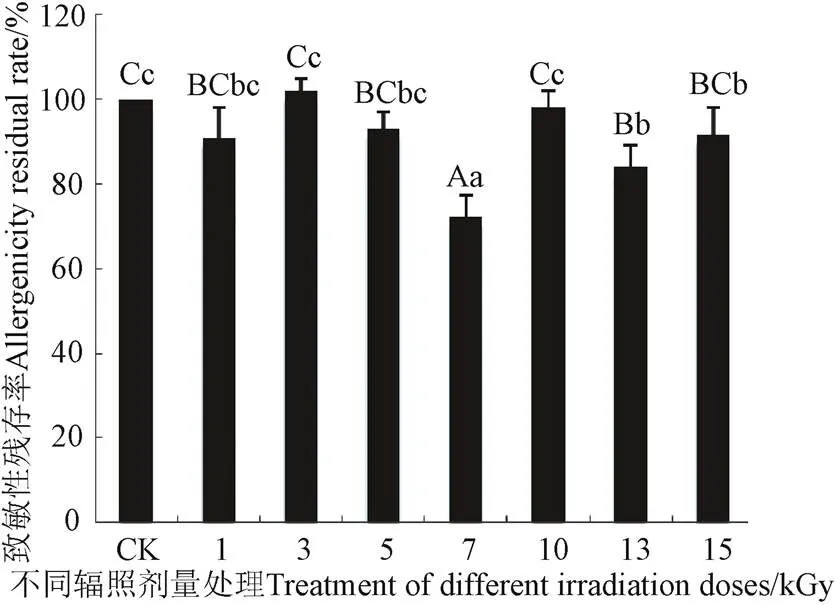
图8 不同辐照剂量处理非发酵面团小麦醇溶蛋白致敏性的变化
3 讨 论
不同加工对非发酵面团小麦醇溶蛋白致敏性影响不同,有增敏、脱敏和保持不变:如保压35 ℃,保压20 min时,200和300 MPa的压力具有增加非发酵面团小麦醇溶蛋白致敏性的风险。不同加工方式由于其作用机制不同,对非发酵面团小麦醇溶蛋白的脱敏效果也不尽相同,如图 9所示:水煮、高温高压、液氮、60Co(7、13 kGy)、臭氧熏蒸(30、60 min)、脉冲强光和超声波处理均能显著降低非发酵面团小麦醇溶蛋白的致敏性(<0.05),其致敏性均降至80%以下,其中水煮、高温高压、液氮、臭氧熏蒸(30、60 min)和PL-1处理脱敏效果极显著(<0.01),均降至60%左右。结合分子量变化可知,从蛋白摄入方面考虑,水煮比高温高压更适合用于非发酵面制品。从脱敏效果来看,与烘烤相比,水煮更适合非发酵面团的加工,也印证了中国传统饮食面条、水饺、面叶的合理性。由此推测也可能是这一中国劳动人民的智慧结晶大大降低了中国人群发生小麦过敏的概率。随着时代的发展,食品加工方式多样化,新型加工方式,如臭氧熏蒸、脉冲强光和超声波等均可用于非发酵面制品加工中,辐照在非发酵面制品加工中运用时要特别注意剂量的控制。
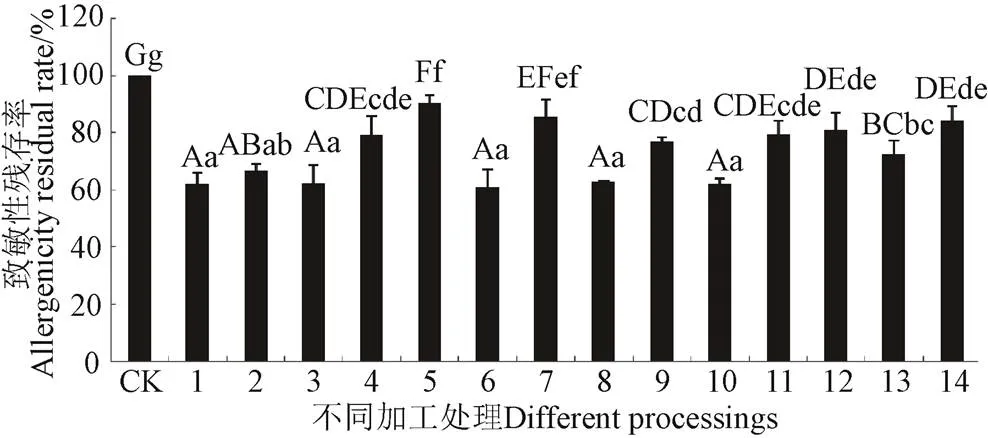
注:1. 臭氧熏蒸1(O3-1);2. 臭氧熏蒸2(O3-2);3. 脉冲强光1(PL-1);4. 脉冲强光2(PL-2);5. 超声波(CS);6. 水煮(SZ);7. 微波(WB);8. 高温高压(GG);9. 烘烤(HK);10. 液氮(YN);11. 速冻机(SD);12.HHP-250 MPa;13.60Co-7kGy;14.60Co-13kGy
不同小写字母表示差异显著(<0.05),不同大写字母表示差异极显著(<0.01)
Note:1.Ozone fumigation 1 (O3-1); 2. Ozone fumigation 2 (O3-2); 3. Pulsed Light 1 (PL-1); 4. Pulsed glare 2 (PL-2); 5. Ultrasound ( CS); 6. Boiled (SZ); 7. Microwave (WB); 8. High temperature and high pressure (GG); 9. Baking (HK); 10.Liquid nitrogen (YN);11.Quick freezer (SD);12.HHP-250MPa; 13.60Co-7kGy; 14.60Co-13kGy
Different lowercase letters indicate significant differences<0.05), different uppercase letters indicate significant differences<0.01)
图9 非发酵面团小麦醇溶蛋白脱敏加工方式
Fig.9 Processing methods for reducing allergenity of wheat gliadin in non-fermented dough
4 结 论
食品加工可以改变蛋白结构,使抗原表位发生变化,从而影响食物过敏原的致敏性,虽然加工不能完全消除非发酵面团小麦醇溶蛋白的致敏性,但是选择合适的加工参数,可使其致敏性最小化。保压温度35 ℃,保压时间20 min时,200 和300 Mpa超高静压处理具有增敏作用,不合适用于非发酵面制品加工;水煮、高温高压、液氮、60Co(7、13 kGy)、臭氧熏蒸(30、60 min)、脉冲强光和超声波处理均能显著降低非发酵面团小麦醇溶蛋白的致敏性,均可用于非发酵面制品加工,其中水煮在非发酵面制品加工中更值得推崇。当然这些加工方式的脱敏效果还需要进一步结合更多体内试验加以验证,特别是小麦易敏人群的临床试验。
[1] Zwietering M. Practical considerations on food safety objectives[J]. Food Control, 2005, 16(9): 817-823.
[2] Battais F, Pineau F, Popineau Y, et al. Food allergy to wheat: identification of immunoglobulin E and immunoglobulin G-binding proteins with sequential extracts and purified proteins from wheat flour[J]. Clin Exp Allergy, 2003, 33(7): 962-970.
[3] Emmett S E, Angus F J, Fry J S, et al. Perceived prevalence of peanut allergy in Great Britain and its association with other atopic conditions and with peanut allergy in other house-hold member[J]. Allergy, 1999, 54(4): 380-395.
[4] Venter C, Perira B, Grundy J, et al. Prevalence of sensitization reported and objectively assessed food hypersensitivity amongst sux-year-old children: A population-based study[J]. Pediatric Allergy and Immunology, 2006, 17(5): 356-363.
[5] Jiang N N, Yin J, Wen L P. Characteristics of anaphylaxis in 907 Chinese patients referred to a tertiary allergy center: A retrospective study of 1 952 episodes[J]. Allergy. Asthma Immunol Res, 2016, 8(4): 353-361. 姜楠楠,尹佳,文利平. 中国人群1952 次严重过敏反应回顾性研究:临床特点、诱因及治疗[J]. 中华临床免疫和变态反应杂志,2016, 8(4): 353-361. (in English with Chinese abstract)
[6] Biagi F, Zimmerl K, Thomas P. Is gliadin mispresented to the immune system in celiac disease? A hypothesis[J]. Q J Med, 1999, 92: 119-122.
[7] Koning F, Giliseen L, Wijmenga C. Gluten: A two-edged sword: Immunopathogenesis of celiac disease[J]. Springer seminars in immunopathology. 2005: 27, 217-232.
[8] Fasano A, Catassii C. Current Approaches to Dignosis and Treatment of Celiac Disease: An Evolving Spectrum[J]. Gastroenterology, 2001;120: 636-651.
[9] Morita E, Yamamrua Y, Mihara S, et al. Food -dependent exercise - induced anaphylaxis: a report of two cases and determination of wheat-gamma-gliadin as the presumptive allergen[J]. Br J Dermatol, 2000, 143: 1059-1063.
[10] Palosuo K, Varjonen E, Nurkkala J, et al. Transglutaminase-mediated cross - linking of a peptic[J]. J Allergy Clin Immunol, 2003, 111: 1386-1392.
[11] Battais F, Courcoux P, Popineau Y, et al. Food allergy to wheat: Differences in immunoglobulin E-binding proteins as a function of age or symptoms[J]. J Cereal Sci, 2005, 42: 109-117.
[12] Leszczynska J, Ła̧cka A, Szemraj J, et al. The influence of gamma irrradiation on the immunoreactivity of gliadin and wheat flour[J]. Eur Food Res Technol, 2003, 217: 143–147.
[13] Kwak J H, Kim Kbwr, Lee C J, et al. Changes in antigenicity of gliadin from medium flour by autoclave and microwave treatment[J]. J Kor Soc Food Sci Nutr, 2011, 40(10): 1423-1429.
[14] Mazzeo M F, Bonavita R, Maurano F, et al. Biochemical modifications of gliadins induced by microbial transglutaminase on wheat flour[J]. Biochimica Biophysica Acta, 2013, 1830: 5166-5174.
[15] Varjonen E, Bjorksten F, Savolainen J. Stability of cereal allergens[J]. Clin Exp Allergy, 1996, 26(4): 436-443.
[16] 陆雪蕊. 降低小麦粉致敏性的研究及应用[D]. 保定:河北农业大学,2016. Lu Xuerui. Study on Allergenicity Decreasing of Wheat Flour and Its Application[D]. Baoding: Hebei Agricultural University, 2016. (in Chinese with English abstract)
[17] Li Y, Yu J M, Goktepe I, et al. The potential of papain and alcalase enzymes and process optimizations to reduce allergenic gliadins in wheat flour[J]. Food Chemistry, 2016, 196 (1): 1338–1345.
[18] Leszczynska J, La̧cka A, Szemraj J, et al. The effect of microwave treatment on the immunoreactivity of gliadin and wheat flour[J]. Eur Food Res Technol, 2003, 217: 387–391.
[19] 刘玉莲. 臭氧气体处理对馒头的保鲜效果研究[D]. 郑州:河南农业大学,2018. Liu Yulian. Study on the Effect of Ozone Gaseous on the Preservation of Steamed Bread[D]. Zhengzhou: Henan Agricultural University, 2018. (in Chinese with English abstract)
[20] 邓涵,祖琴琴,朱杰瑞. 超声处理对大豆7S蛋白潜在致敏性的影响[J]. 食品科学,2017. 5(38):32-37. Deng Han, Zu Qinqin, Zhu Jierui. Effect of ultrasonic treatment on the potential allergenicity of soybean 7S globulin[J]. Food Science, 2017. 5 (38): 32-37. (in Chinese with English abstract)
[21] Long F Y, Yang X, Sun J, et al. Effects of combined high pressure and thermal treatment on the allergenic potential of peanut in a mouse model of allergy[J]. Innovative food science & emerging technologies, 2016, 35: 133-138.
[22] 索标,李森,张伟. 脉冲强光对馒头表面金黄色葡萄球菌的杀菌效果[J]. 食品安全质量检测学报,2018,9(7):1491-1495. Suo Biao, Li Sen, Zhang Wei. Evaluation of pulsed light treatment on the inactivation of staphylococcus aureus on steamed bread[J]. Journal of Food Safety and Quality Inspection, 2018, 9 (7): 1491-1495). (in Chinese with English abstract)
[23] 潘治利,罗元奇,艾志录. 不同小麦品种醇溶蛋白的组成与速冻水饺面皮质构特性的关系[J]. 农业工程学报,2016,32(4):242-248. Pan Zhili, Luo Yuanqi, Ai Zhilu. Relationship between composition of gliadin and texture properties of quick-frozen dumpling skins based on different wheat varieties[J]. Journal of Agricultural Engineering, 2016, 32 (4): 242-248. (in Chinese with English abstract)
[24] 李静慧. 超高静压协同酶法降低专用大豆分离蛋白致敏性的研究[D]. 无锡:江南大学,2013. Li Jinghui. Study About Allergenicity Reducing of Special Soy Protein Isolate by High Hydrostatic Pressure Assisting Enzymatic Approach[D]. Wuxi:Jiangnan University, 2013. (in Chinese with English abstract)
[25] 秦倩茹,高宏伟,马洪明. 过敏原小麦醇溶蛋白的ELISA定量检测方法的建立[J]. 食品工业科技,2010,11(31):360-365. Qin Qianru, Gao Hongwei, Ma Hongming. Quantitative determination of gliagin protein from wheat in foods by ELISA method[J]. Science and Technology of Food Industry, 2010, 11 (31): 360-365. (in Chinese with English abstract)
[26] 李颖超,钱和,孙秀兰. 典型热加工对花生致敏蛋白及其免疫反应性的影响[J]. 食品工业科技,2015,36(5):95-98. Li Yingchao, Qian He, Sun Xiulan. Effect of thermal processing on the immunoreactive properties of allergenic proteins from peanut seeds[J]. Science and Technology of Food Industry, 2015, 36 (5): 95-98. (in Chinese with English abstract)
[27] 李振兴,黄榕芳,吴玟静. 热蒸加工对大菱鲆过敏原免疫原性的影响[J]. 食品安全质量检测学报,2012,3(4):279-284. Li Zhenxing, Huang Rongfang, Wu Minjing. Effects of steam processing on allergen immunogenicity of Scophthatmus maximus[J]. Journal of Food Safety and Quality Inspection, 2012, 3 (4): 279-284. (in Chinese with English abstract)
[28] Cabanillas B, Maleki S J, Rodriguez J, et al. Heat and pressure treatments effects on peanut allergenicity[J]. Food Chem, 2012, 132: 360–366.
[29] 解冠华,陈红兵. 加工对牛乳过敏原的影响[J]. 食品科学, 2006,27(11):598-601. Xie Guanhua, Chen Hongbing. Effect of processing on milk allergens[J]. Food Science, 2006, 27 (11): 598-601. (in Chinese with English abstract)
[30] Li M, Peng J, Zhu K X, et al. Delineating the microbial and physical-chemical changes during storage of ozone treated wheat flour[J]. Innovative Food Science & Emerging Technologies, 2013(20):223-229.
[31] 黄雄伟,庄坤,丁文平. 臭氧处理对新收获小麦品质的影响[J]. 中国酿造,2014,33(5):113-115. Huang Xiongwei, Zhuang Kun, Ding Wenping. Effect of ozone treatment on the quality of newly harvested wheat[J]. China Brewing, 2014, 33 (5): 113-115. (in Chinese with English abstract)
[32] Zhao X Y, Yang W D, Chung S Y, et al. Reduction of IgE immunoreactivity of whole peanut) After Pulsed Light Illumination[J]. Food Bioprocess Technol, 2014, 7: 2637–2645.
[33] Li Z X, Lin H, Cao L M, et al. Effect of high intensity ultrasound on the allergenicity of shrimp[J]. Zhejiang Univ Science B, 2006, 7(4): 251-256 251.
[34] 马涛,王一侠,刘艳. 超声处理对三文鱼小清蛋白构象及致敏活性的影响[J]. 食品工业,2017,38(3):160-163. Ma Tao, Wang Yixia, Liu Yan. Effect of ultrasonic treatment on the antigenicity and conformation of salmon parvalbumin[J]. Food Industry, 2017, 38 (3): 160-163. (in Chinese with English abstract)
[35] 董晓颖,高美须,潘家荣. 不同处理方法对虾过敏蛋白分子量及抗原性的影响[J]. 核农学报,2010,24(3):548-554. Dong Xiaoying, Gao Meisu, Pan Jiarong. Effects of different treatments on molecular weight and antigenicity of shrimp allergenic protein[J]. Journal of Nuclear Agriculture, 2010, 24 (3): 548-554. (in Chinese with English abstract)
[36] 王烁,张春红,李淑荣. 辐照处理对花生致敏蛋白的影响[J]. 花生学报,2009,38(2):1-5. Wang Shuo, Zhang Chunhong, Li Shurong. Effect of radiation process on allergic proteins of peanut[J]. Journal of Peanuts, 2009, 38 (2): 1-5. (in Chinese with English abstract)
Effects of different processing on allergenicity of wheat gliadin in non-fermented dough
Wang Na1,2,3,4,5, Meng Lijun1,3,4,5, Huang Zhongmin1,3, Ai Zhilu1,3, Cui Chenxu1,3,4, Zhang Gaiping2,5※
(1.450002,; 2.450002;3.,,450002,; 4.,450002,; 5.,,450002,)
Food allergy has become a major public health and food safety issue concerned by the world . In the world, 0.2% -0.9% of adults and 0.4%-1.3% of children suffer from wheat allergy, which seriously affects the lives of allergic patients. The structure of food allergens can be changed by processing, which maight affect their allergenicities. Therefore, it is meaningful to study the influence of different processing on the allergenicity of gliadin in non-fermented dough. Here non-fermented dough were treated by different processing such as thermal processing (boiled, baked, microwave, high temperature and high pressure), cold treatments (liquid nitrogen, quick freezing machine) and non-thermal processing (static ultrahigh pressure, irradiation, pulsed light, ozone and ultrasonic). The molecular weight and the allergenity of wheat gliadin in non-fermented dough after various processing were determined by SDS-PAGE and the double antibody sandwich ELISA. SDS-PAGE electrophoresis results showed that the molecular weight of wheat gliadin in non-fermented dough changed significantly after boiled, baked or high temperature and high pressure treatment. The results of Sandwich ELISA showed that when the holding pressure temperature was 35℃ and the holding time was 20 min, the non-fermented dough wheat gliadin was treated with 100 -300 MPa ultra-high static pressure, its allergenicity increased first, then decreased, and then increased again, of which its allergenicity significantly decreased to 80.94% when treated at 250 MPa, and significantly increased to 127.27% or 128.17% when treated at 200 or 300 MPa, respectively, indicating that ultra-high static pressure treatment has a allergenicity increasing effect of gliadin in non-fermented dough; Irradiation treatment with-60Co at a dose of 1-15 kGy resulted in the allergenicity of gliadin in non-fermented dough decreased first, then increased and then decreased again, at 7, 13 kGy, the allergenicity decreased to 72.32% or 84.03%, respectively; The allergenicity of non-fermented dough wheat gliadin was significantly reduced after these hot, cold and non-heat processing treatments (<0.05). After 2 hours of 500-watt ultrasonic treatment, its allergenicity was reduced to 90.23%; after Microwave, Quick-freezer, Pulsed light, or Baked treatment, it was reduced to 85.36%, 79.49%, 79.08% or 76.69%, respectively. Among them, the most significant (<0.01) reduction in allergy was observed after Boiled, High temperature and high pressure, Liquid nitrogen, Ozone and Pulsed light (PL-1) treatment, and all of which decreased to about 60%, and ranked following by Boiled> Ozone fumigation 30 min (O3-1)> Liquid nitrogen> Pulsed glare 1 (PL-1)> High temperature and high pressure> Ozone fumigation for 60 min (O3-2). In short, the processing modes can significantly affect the allergenicity of non-fermented dough wheat gliadin, which can be used as an effective method for the safety control of food allergens and provide an effective reference for the production of desensitized food. At the same time, people's daily diet can be healthier by choosing a suitable processing method, especially for wheat susceptible people. Of course, the influence of different processing methods on the decreasing allergenicity of non-fermented dough wheat gliadin need to be further validated in combination with other in vivo experiments and especially the clinical trials of wheat susceptible people.
processing; protein; non-fermented dough; wheat gliadin; allergenicity;
王娜,孟利军,黄忠民,等. 加工方式对非发酵面团小麦醇溶蛋白致敏性的影响[J]. 农业工程学报,2020,36(9):292-299.doi:10.11975/j.issn.1002-6819.2020.09.033 http://www.tcsae.org
Wang Na, Meng Lijun, Huang Zhongmin, et al. Effects of different processing on allergenicity of wheat gliadin in non-fermented dough[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(9): 292-299. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.09.033 http://www.tcsae.org
2020-02-11
2020-03-09
农业农村部动物免疫学重点实验室开放课题(PKLA20170606)
王娜,博士,副教授,主要从事食品免疫与营养学研究。Email:na-wang@163.com
张改平,中国工程院院士,主要从事食品安全快速检测技术和动物重大疫病研究。Email:zhanggaiping@163.com
10.11975/j.issn.1002-6819.2020.09.033
TS201.6
A
1002-6819(2020)-09-0292-08

