辣椒胞质雄性不育系CaNAD9线粒体基因的克隆及表达分析
杨婷玉 邵贵芳 张水 王姣 张靖柔 赵凯 邓明华


摘 要:为了深入研究辣椒胞质雄性不育与能量代谢之间的关系,本研究以辣椒胞质雄性不育系9704A和同型保持系9704B为实验材料,克隆了线粒体基因组CaNAD9基因,比较了其一级结构在2种材料间的差异,利用实时荧光定量PCR技术分析该基因在保持系9704B不同组织中的表达模式,以及胞质雄性不育系9704A与同型保持系9704B花蕾不同发育时期的表达差异。结果表明:通过对双向测序进行分析,辣椒CaNAD9基因CDS长度为573 bp;生物信息学分析表明CaNAD9基因编码190个氨基酸残基;CaNAD9基因转录本在不育系和保持系中均未发生RNA编辑;辣椒CaNAD9基因在不同组织中的表达量存在差异,且差异较为明显,其中在种子中的表达量最高,在胎座中的表达量最低;辣椒CaNAD9基因的表达量在胞质雄性不育系与保持系花蕾不同发育阶段中存在一定差异,在花粉母细胞减数分裂期辣椒胞质雄性不育系与同型保持系中的表达差异最为显著。这种差异可能会使雄性不育系的能量代谢出现异常,从而导致辣椒雄性不育。
关键词:辣椒;CaNAD9;胞质雄性不育;能量代谢;基因表达
中图分类号:S188 文献标识码:A
Cloning and Expression Analysis of Mitochondrial Gene of Cytoplasmic Male Sterile Line CaNAD9 in Pepper (Capsicum annuum L.)
YANG Tingyu, SHAO Guifang, ZHANG Shui, WANG Jiao, ZHANG Jingrou, ZHAO Kai,
DENG Minghua*
College of Horticulture and Landscape, Yunnan Agricultural University, Kunming, Yunnan 650201, China
Abstract: In order to further study the relationship between the cytoplasmic male sterility and energy metabolism in pepper, the cytoplasmic male sterile line 9704A and homologous maintainer line 9704B were used as the experimental materials to clone the mitochondrial genome CaNAD9 gene and compare its primary structure. The difference between the two materials was analyzed by real-time quantitative PCR to analyze the expression pattern of the gene in different tissues of the maintainer line 9704B and the expression differences of the buds of the cytoplasmic male sterile line 9704A and the homologous maintainer line 9704B. The CDS length of the CaNAD9 consisted of 573 bp, which encoding 190 amino acids. RNA editing of the CaNAD9 transcript did not happened in both 9704A and 9704B. The expression of CaNAD9 in pepper was different in different tissues with the highest expression in seeds and the lowest in fetuses. There were some differences in different developmental stages of the flower buds, and the difference in the expression of the cytoplasmic male sterile lines and the homologous maintainers in the meiotic stage of pollen mother cells was the most significant. This difference may cause abnormalities in the energy metabolism of the male sterile line, leading to male sterility in the pepper.
Keywords: pepper (Capsicum annuum L.); CaNAD9; cytoplasmic male sterility; energy metabolism; gene expression
DOI: 10.3969/j.issn.1000-2561.2020.05.018
雄性不育是高等植物中普遍存在的一种自然现象。各种外界环境(光照、温度、化学试剂)及其自身特性的影响,均可造成植物的雄性生殖器官不能产生正常的功能性花粉,但雌性生殖器官正常发育[1]。目前植物的雄性不育来源比较广泛,可借助各种人工手段来获取雄性不育系,如天然的不育品种、自交、种间或种属间杂交、理化诱导和T-DNA插入诱导、基因工程等[2]。根据Sears提出的“三型学说”理論,可将植物的雄性不育分为3类:(1)细胞核雄性不育。其不育主要由核基因控制并且遗传方式遵循孟德尔遗传定律。(2)细胞质雄性不育。其不育主要由细胞器及细胞质因子间的相互作用决定的,一般为母系遗传,该类型不育系不能找到恢复系,在辣椒育种中没有实际应用价值。(3)细胞核质互作不育。其不育主要由核不育基因和质不育因子共同控制决定的[3],又称胞质雄性不育。由于胞质雄性不育植株在生产应用上既可以筛选保持系,又可以获得恢复系,所以在辣椒育种上,可以利用“三系配套”进行高效人工制种。本研究的实验材料为向阳椒中发现并转成稳定不育系的8021A,以及21号牛角椒中发现并转育的不育系9704A。实验材料的不育系和不育度均高达100%,经济性状优良、抗性好、品质优、有较强的配合力和社会生产价值[4-5]。
在近年来的研究中,根据花粉败育的不同方式和时期,可将胞质雄性不育进行不同的划分,可将胞质雄性不育(CMS)分为孢子体雄性不育和配子体雄性不育,两者都是在花粉发育的过程出现了异常[6]。研究发现,9704A的不育系属于孢子体败育型[7]。根据对细胞质基因组以及胞质雄性不育的研究结果表明,大多数植物中的胞质雄性不育(cytoplasmic male sterility, CMS)基因与线粒体有着密切的关系[8]。线粒体的主要功能是通过呼吸作用产生ATP。线粒体内膜上存在一类电子传递体,为植物提供不同支路的脱氢酶和氧化酶,参与植物的光呼吸,辅酶因子和氨基酸的新陈代谢途径[9]。细胞色素属于含铁的电子传递体。细胞程序性死亡(programmed cell death, PCD)是植物生长发育过程中细胞正常死亡的一种方式。PCD发生异常可能导致植物的雄性不育。细胞色素C的释放不能导致PCD,但PCD的第一步就是ROS的爆发引起细胞色素C的释放,从线粒体间隙进入到细胞质中[10-11]。目前,电子传递链的干扰会导致雄性不育的假说已经被证实,Shaya等[12]通过将截断的线粒体基因(atp4、cox1、rps3)的cDNA片段进行克隆后转入烟草植株,发现转入后的植株表现出雄性不育的表型。
NADH泛醌氧化还原酶N(也称NADH脱氢酶)是线粒体电子传递过程中的第一个质子泵,主要通过电子转移驱动质子的移动,使质子由基质转移到内膜外,展开生物氧化的第一步。基因NAD9(也就是线粒体NADH脱氢酶亚基9)在大葱不育系和保持系中的扩增片段存在差异,NAD9基因在不育系的表达量均高于保持系[13]。
本研究以辣椒胞质雄性不育系9704A和同型保持系9704B为实验材料,克隆两系线粒体编码基因CaNAD9,研究其在两系之间生物信息学和时空表达差异,以期为进一步研究提供理论基础。
1 材料与方法
1.1 材料
选取湖南省蔬菜研究所选育的辣椒胞质雄性不育系9704A(不育率高达100%)和同型保持系9704B为实验材料。材料种植于云南农业大学后山园林园艺学院蔬菜实验基地。2个品种均于2018年1月上旬播种,2018年4月下旬定植,定植之后进行生长期常规管理。
待辣椒进入盛花盛果时期,取实验材料。(1)在盛花期取胞质雄性不育系9704A与同型保持系9704B花蕾发育4个不同时期(造孢细胞增殖期、花粉母细胞减数分裂期、小孢子单核靠边期、小孢子成熟期)作为研究两系表达谱差异的材料;(2)在盛果期取同型保持系9704B植株的茎、叶、花、果皮、胎座、种子6个不同组织作为组织表达材料。所取材料均应立刻用液氮处理后?80 ℃超低温保存,用于DNA和RNA的提取。
1.2 方法
1.2.1 DNA、RNA的提取及cDNA合成 DNA的提取采用BioTeKe公司的试剂盒进行提取,提取步骤参考试剂盒说明;利用Trizol试剂提取不同组织及花蕾不同发育阶段的RNA,提取步骤参考试剂盒说明;DNA、RNA提取完毕后利用紫外分光光度计测定其浓度和纯度;检测合格后用TaKaRa试剂盒将RNA反转录成cDNA;DNA,RNA在?80 ℃保存,cDNA在?20 ℃中保存,以用于后续的实验。
1.2.2 基因克隆 根据GenBank中的目的基因序列(登录号:NC_030100)设计特异性引物扩增其CDS全长编码序列。用Primer 5.0设计特异性引物F1(5-GGCGA TTTCCGACAAGTCT-3)和R1(5-CCGACG ATCA AG A CAATTCC-3),DNA和RNA使用相同的引物。以DNA为模板的PCR反应体系:DNA 1 μL;MiX 22 μL;上游引物1 μL;下游引物1 μL;Total 25 μL。反应条件:98 ℃,2 min;98 ℃,10 s;58 ℃,15 s,35个循环;72 ℃,10 s;72 ℃,5 min;4 ℃保存。以cDNA为模板的PCR反应体系:cDNA(25 ng/L)0.5 μL;Premix 10 μL;上游引物0.4 μL;下游引物0.4 μL;无菌水8.7 μL;Total 20 μL。反应条件:94 ℃,2 min;94 ℃,30 s;55 ℃,30 s,39个循环;72 ℃,10 s;72 ℃,5 min;4 ℃保存。
1.2.3 生物信息学分析 利用NCBI(http://www. ncbi.nlm.nih.gov)服务器上的Conserved Domain Architecture Retrieval Tool(CDART)工具(http:// www.ncbi.nlm.nih.gov/BLAST)获取蛋白质的保守结构域;利用GenScan(http://genes.mit.edu/ GENSCAN.html)預测cDNA序列;通过Compute pI/Mw Tool(http://us.expasy.org/tools/pi_tool.html)预测氨基酸的分子量(Mw)和等电点(pI);利用SOPMA程序(http://npsa-pbil.ibcp.fr/)预测蛋白质二级结构;使用DNAStar、BioEdit、ClustalX、MEGA 4和DNAMAN软件进行核苷酸序列及氨基酸序列的比对和构建系统进化树。
1.2.4 实时荧光定量PCR(qRT-PCR) 实时定量PCR采用TaKaRa公司SYBR? Premix Ex Taq TMII(Code No. RR820A)荧光定量试剂盒。在Applied Biosystem荧光定量PCR仪上进行,本研究采用20 μL反应体系,各引物退火温度均为60 ℃,每个样品设3次重复。空白对照采用ddH2O代替cDNA,其他试剂不变,qRT-PCR反应体系如下:20 μL体系,10 μL SYBR? Premix Ex Taq?Ⅱ(购于TaKaRa公司),10 ?mol/L的上下游引物各0.8 μL,2 μL cDNA模板,0.4 μL ROX Reference Dye Ⅱ,6 μL ddH2O;实时荧光定量PCR反应程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,循环40次。以ACTIN基因F2(5-TGCA GGAATCCACGAGACTAC-3)和R2(5-TAC CA CCACTGAGCACAATGTT-3)为阳性内对照基因,校正cDNA模板的细胞拷贝数,根据NAD9基因的测序结果设计荧光定量特异性引物F3(5-GGGTCAAAAAAATGGAAAGA-3)和R3(5-AG G GATAATCAACTCCGCAA-3)。计算相对表达量采用2?CT方法计算相对表达量[14]。基因相对表达量图表的坐标轴使用对数刻度。
2 结果与分析
2.1 辣椒CaNAD9基因的生物信息学分析
分别以辣椒胞质雄性不育系9704A与同型保持系9704B的cDNA为模板,采用特异性引物对进行CaNAD9基因进行扩增。PCR扩增产物用1%琼脂糖凝胶电泳检测,初步检测结果表明目的片段与预期结果相符(图1)。
以cDNA为模板的PCR扩增产物的双向测序结果表明,扩增片段长度为762个碱基,进一步分析表明,该片段包含一个完整开放阅读框(ORF)长度为573 bp,编码由190个氨基酸残基组成的肽链(蛋白质)。分析发现,CaNAD9在不育系和保持系之间的扩增序列完全一致。CaNAD9蛋白编码190个氨基酸残基(图2),CaNAD9蛋白质等电点为6.763,分子量为22 637.57 Da,无信号肽,该蛋白位于细胞质的概率是39.1%。以DNA为模板的PCR扩增产物双向测序结果表明,扩增片段长度为762 bp左右,进一步分析表明:该片段包含一个完整开放阅读框(ORF),该ORF在保持系和不育中的片段序列完全一致,长度为573 bp,不存在任何碱基差异。
对CaNAD9基因的DNA和cDNA序列进行比较分析,发现在保持系和不育系中,从DNA转录生成cDNA过程中均未发生RNA编辑现象,并且该基因在不育系和保持系的扩增片段完全一致。
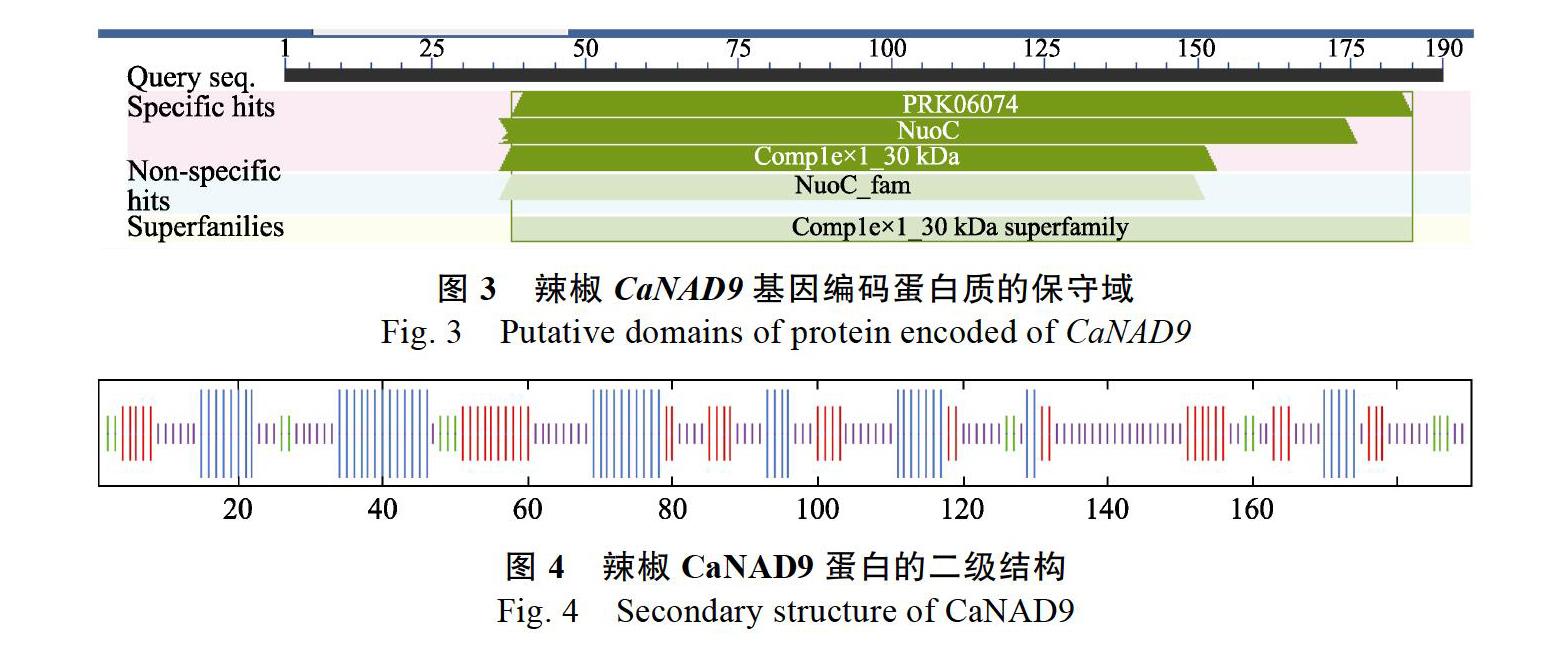
根据保持系以cDNA为模板的PCR扩增结果,对所推导的CaNAD9蛋白质的保守结构域进行预测,蛋白的保守结构域为Respiratory- chain NADH dehydrogenase,推测其属于Com plex130 KDa超家族(图3)。预测CaNAD9蛋白的二级结构中含49个α-螺旋(25.79%),42个延伸链结构(22.11%),14个β-转角(7.37%),85个无规则卷曲(44.74%)。预测的该蛋白质二级结构(图4)。
辣椒CaNAD9基因在辣椒胞质雄性不育系9704A与同型保持系9704B中的氨基酸序列无差异推导出来的氨基酸序列与GenBank中天仙子(YP_ 009121979.1)、烟草(BAD83545.2)、番茄(ATD 51567.1)、马铃薯(CAA56168.1)、酸浆(AKZ 24878.1)的NAD9氨基酸序列具有相似性(图5)。
利用辣椒CaNAD9氨基酸序列与天仙子(YP_009121979.1)、烟草(BAD83545.2)、番茄(ATD51567.1)、马铃薯(CAA56168.1)、酸浆(AKZ24878.1)的NAD9氨基酸序列构建系统进化树,结果表明辣椒的CaNAD9氨基酸序列与天仙子、酸浆的亲缘关系较近,与其他物种的亲缘关系稍远(图6)。
2.2 CaNAD9基因在9704B多组织及在9704A与9704B花蕾不同发育时期的表达分析
6个组织中CaNAD9基因均有表达,CaNAD9基因在不同组织中表达量的差异较为明显,其中在种子中的表达量最高,在胎座中的表达量最低(图7)。
利用实时荧光定量的方法,以辣椒胞质雄性不育系9704A与同型保持系9704B为材料,选取盛花期4个不同发育阶段的花蕾,对CaNAD9基因的表达量进行分析,管家基因ACTIN作为校正。结果表明,CaNAD9基因的表达量在胞质雄性不育系与保持系中存在一定差异,在花粉母细胞减数分裂期辣椒胞质雄性不育系与同型保持系中的表达差异最为显著。伴随着小孢子的发育过程,辣椒保持系中CaNAD9基因的表达水平差异明显,在花粉母细胞减数分裂时期CaNAD9的表达水平急剧下降,表达量达到最低,与同型不育系9704B花蕾发育不同时期的表达量相差不大。与保持系相比,不育系中CaNAD9在花粉母细胞减数分裂时期的表达量下降不明显,表达量高出不育系500倍左右。在小孢子单核期及小孢子成熟期其表达水平相差不大。在不同材料花蕾发育的同一时期,CaNAD9基因的表达也存在一定差异:在小孢子单核靠边期与小孢子成熟期不育系和同型保持系中CaNAD9基因的表达水平相差较小;在花粉母细胞减数分裂期,CaNAD9基因的表达水平在辣椒胞质雄性不育系中明显高于同型保持系;小孢子单核靠边期CaNAD9基因的表达水平在辣椒胞质雄性不育系中略低于同型保持系;小孢子成熟期CaNAD9基因的表達水平在辣椒胞质雄性不育系中略高于保持系(图8)。
3 讨论
本研究分别从辣椒胞质雄性不育系9704A与同型保持系9704B中克隆出了CaNAD9基因,比对分析表明CaNAD9基因在辣椒胞质雄性不育与同型保持系之间具有高度的保守性,两系中同一基因的碱基序列具有高度一致性,在胞质雄性不育系中没有发生任何突变、缺失、重组的现象。初步推测辣椒CaNAD9蛋白属于Complex1_ 30 KDa超家族,根据进化树显示,辣椒CaNAD9氨基酸序列与天仙子和酸浆的亲缘关系较为接近,与烟草、番茄、马铃薯的氨基酸序列相似但是亲缘关系稍远。
NADH脱氢酶是线粒体生物氧化的第一步,催化电子传递给辅酶Q的一种酶,启动电子传递链的正式运输。这几个基因功能表达的正常与否,与线粒体功能的正常运作密不可分。植物线粒体基因组中大概含有60个开放阅读框(open reading frame, ORF),重组产生的开放阅读框大多数与植物的雄性不育有着密切的关系[15]。线粒体的ORF常是线粒体未知与已知区域的嵌合基因,且该嵌合序列常来源于线粒体保守区域的基因或非编码RNA,如K型-CMS小麦中发现的Ks3基因,它含有的ORF编码许多线粒体呼吸链复合体的亚基,如ATP4、ATP6、NAD3、NAD9、COX1、COX3等[16]。来自复合体I的NAD7和NAD9分别在野生型水稻RT98A和烟草CMS Ⅰ、Ⅱ中分别被鉴定。烟草CMS Ⅰ中NAD7的外显子和CMS Ⅱ中的整个NAD7的缺失导致细胞质雄性不育[17]。水稻中NAD9和ORF113在某一区域显示相同的序列[18]。
Schnable P S, Wise R P. The molecular basis of cytoplasmic male sterility and fertility restoration[J]. Trends in Plant Science, 1998, 3(5): 175-180.
Liu H, Cui P, Zhan K, et al. Comparative analysis of mitochondrial genomes between a wheat K-type cytoplasmic male sterility line and its maintainer line[J]. BMC Genomics, 2011, 12(1): 163.
Gutierres S, Sabar M, Lelandais C, et al. Lack of mitochondrial and nuclear-encoded subunits of complex I and alterations of the respiratory chain in Nicotiana sylvestris mitochondrial deletions mutants[J]. Proceedings of the National Academy of Sciences, 1997, 94(7): 3436-3441.
Igarashi K, Kazama T, Motomura K, et al. Whole genomic sequencing of RT98 mitochondria derived from Oryza rufipogon and northern blot analysis to uncover a cytoplasmic male sterility-associated gene[J]. Plant and Cell Physiology, 2013, 54(2): 237-243.
王永勤, 曹家樹, 虞慧芳, 等. 白菜核雄性不育两用系生理生化特性的分析[J]. 园艺学报, 2003(2): 212-214.
Villarreal F, Martín V, Colaneri A, et al. Ectopic expression of mitochondrial gamma carbonic anhydrase 2 causes male sterility by anther indehiscence[J]. Plant Molecular Biology, 2009, 70(4): 471-485.
梁 峥, 郑光植. 植物呼吸代谢多条路线与代谢工程[J]. 植物生理学通讯, 1994(4): 290-292.
邹立基. 植物呼吸作用教学的体会[J]. 植物生理学通讯, 1991(4): 303-305.
肖敬平, 汤佩松. 对植物整体呼吸代谢和能力系统的探索[J]. 植物生理学通讯, 1987(1): 73-77.
薛应龙. 第十二讲 呼吸代谢的生理意义及调控问题[J]. 植物生理学通讯, 1980(1): 60-72.
邱义兰, 刘珠丽, 李 红, 等. 辣椒细胞质雄性不育花药败育及淀粉粒分布的细胞学观察[J]. 分子细胞生物学报, 2008(4): 283-293.

