抗VEGF治疗糖尿病性黄斑水肿短期内黄斑区视网膜厚度 光感受器层连续性及血流密度变化
安 琪 高 健 廖荣丰
糖尿病性视网膜病变(diabetic retinopathy,DR)是全球主要的致盲性眼病[1],而糖尿病性黄斑水肿(diabetic macular edema,DME)是糖尿病患者视力损伤的主要原因[2]。血管内皮生长因子(vessel endothelial growth factor,VEGF)水平升高与DR、DME发生密切相关。VEGF在正常生理情况下,能够促进血管内皮细胞分化增殖,维持血管内皮功能[3]。病理情况下,特异性地与血管内皮细胞受体结合,促进内皮细胞增殖,破坏血视网膜屏障,致视网膜水肿,加重局部缺血缺氧,生成新生血管[4]。研究[5]发现,玻璃体腔抗VEGF治疗可以有效降低玻璃体和房水中的VEGF浓度,促进黄斑水肿及新生血管消退,但抗VEGF药物在减轻黄斑水肿的同时,是否会抑制正常血管的新生过程,加重黄斑区结构紊乱和视网膜缺血缺氧状态?目前尚不清楚。光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)是近年来发展起来的一种快速、高效、非侵入性血管成像技术,相比于传统的荧光血管造影检查,无需使用造影剂,它能无创显示特定层面的视网膜黄斑区结构和毛细血管血流密度。本研究旨在用OCTA观察抗VEGF药物治疗DME患者短期内黄斑区视网膜厚度、光感受器层连续性及血流密度变化,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1~11月在安徽医科大学第一附属医院眼科诊断为DME并接受抗VEGF治疗的患者23例(30眼),其中,男性16例(21眼),女性7例(9眼)。按照DR国际分期标准[7]分为轻度非增殖期(non proliferative DR,NPDR)、中度NPDR、重度NPDR和增殖期DR(proliferative DR,PDR)。本研究纳入的11例(17眼)重度NPDR患者作为重度NPDR组,男性7例(11眼),女性4例(6眼),年龄38~70岁,平均(54.55±10.22)岁。12例(13眼)PDR患者作为PDR组,男性9例(10眼),女性3例(3眼),年龄32~70岁,平均(59.00±11.65)岁。两组患者性别、年龄进行比较,差异无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准:①年龄>18岁,Ⅰ或Ⅱ型糖尿病史者;②符合世界卫生组织关于DME[6]的诊断标准者;③未进行过抗VEGF、糖皮质激素及黄斑区激光治疗者。排除标准:①严重的屈光介质浑浊影响眼底检查或扫描质量,如严重白内障、玻璃体出血者;②高血压等基础疾病者;③影响视网膜和脉络膜的疾病,如视网膜静脉阻塞、老年性黄斑变性、黄斑前膜等者;④青光眼、眼外伤、高度近视、任何形式的眼内手术等者。所有患者及家属均获得知情同意,且通过安徽医科大学第一附属医院医学伦理委员会的审批。
1.3 方法 对两组患者均进行全面的眼部检查,包括眼压、眼前节、散瞳后的裂隙灯眼底检查。血管扫描图像由美国Optovue OCTA设备获得,以中心凹为中心进行6 mm×6 mm矩形扫描。对两组患者行玻璃体腔抗VEGF(雷珠单抗)注药术,用OCTA观察两组患者术前及术后2周黄斑区视网膜厚度、光感受器层连续性及血流密度变化。
1.4 观察指标 ①定量观察治疗前后两组患者黄斑中心凹子区厚度(foveal retinal thickness,FRT)和旁中心凹视网膜厚度(parafoveal retinal thickness,PRT)。FRT是指中心凹1 mm直径范围内平均视网膜厚度,PRT是指以黄斑中心凹为圆点,直径为1~3 mm的平均视网膜厚度;②定性观察治疗前后两组患者中心凹1 mm区域内视网膜感光细胞层中外界膜(exteral limiting membrance,ELM)、内节/外节(inner and outer segment,IS/OS)的完整性[8]。其中,连续率(%)=(每组结构连续眼数/每组样本数)×100%;③定量观察治疗前后两组患者中心凹无血管区(foveal avascular zone,FAZ)旁300 μm范围全层视网膜血流密度(以下简称FD-300)、浅层(superficial capillary plexus,SCP)、深层视网膜旁中心凹血流密度(deep capillary plexus,DCP),旁中心凹是指黄斑中心凹为圆点,直径1~3 mm的视网膜血流密度。

2 结果
2.1 黄斑区视网膜厚度比较 治疗后,两组患者FRT、PRT较治疗前均降低,差异有统计学意义(P<0.05)。两组患者治疗前后FRT、PRT比较,差异无统计学意义(P>0.05)。两组患者治疗前后FRT、PRT差值比较,差异无统计学意义(P>0.05)。见表1。
2.2 视网膜光感受器层连续性变化比较 治疗后,ELM结构不连续,由8只眼减少为5只。见图1。IS/OS不连续,由21只眼减少为10只。见图2。,两组患者治疗前后ELM连续率比较,差异均无统计学意义(P>0.05)。见表2。治疗前,两组患者IS/OS连续率比较,差异无统计学意义(P>0.05),治疗后,重度NPDR组IS/OS连续率高于PDR组,差异有统计学意义(P<0.05)。见表3。

表1 两组患者治疗前后视网膜厚度比较(μm)
注:与治疗前相比,*P<0.05
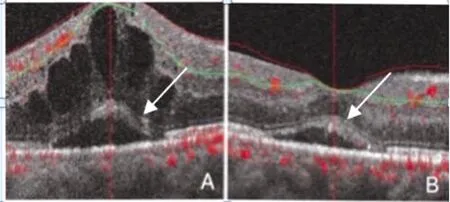
图1 ELM连续性变化
注:A为术前ELM不连续,B为术后ELM连续
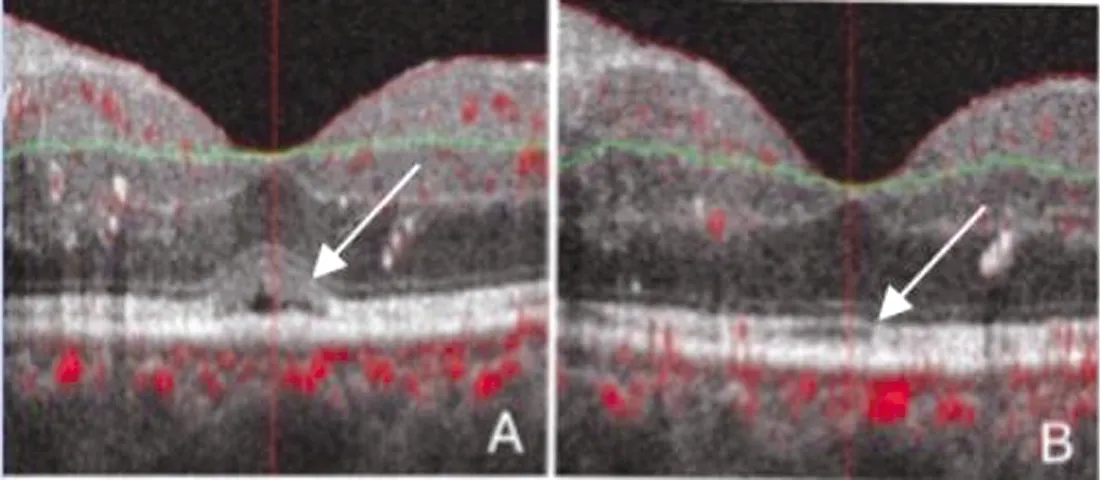
图2 IS/OS连续性变化
注:A为术前IS/OS不连续,B为术后IS/OS连续

表2 两组患者治疗前后ELM层连续性比较[眼(%)]
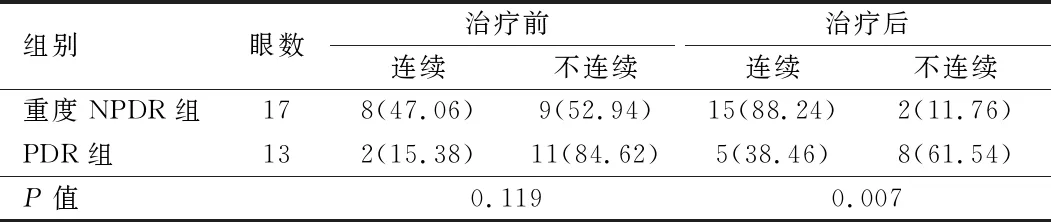
表3 两组患者治疗前后IS/OS层连续性比较[眼(%)]
2.3 黄斑区中心凹微循环参数比较 治疗后,两组患者FD-300、SCP、DCP旁中心凹血流密度与治疗前比较,差异无统计学意义(P>0.05)。两组患者治疗前后FD-300、SCP、DCP旁中心凹血流密度比较,差异无统计学意义(P>0.05)。两组患者治疗前后FD-300、SCP、DCP旁中心凹血流密度差值比较,差异无统计学意义(P>0.05)。见表4。

表4 两组患者注射抗VEGF前后FD-300、SCP及DCP旁中心凹血流密度比较(%)
注:与治疗前相比,*P>0.05
3 讨论
尽管DME的致病机制尚未明确,但目前公认的是VEGF介导的细胞凋亡、血视网膜屏障被破坏,导致视网膜水肿[9]。近年来,抗VEGF药物通过拮抗作用抑制新生血管、调控血视网膜屏障通透性,达到促进视网膜内渗液快速吸收和改善DME的目的。既往研究[10]表明,抗VEGF治疗在促进黄斑水肿及新生血管消退方面有效,但对抗VEGF术后短期内黄斑区光感受器层形态结构变化及血流密度定量改变的研究尚不多见。
本研究发现,治疗后,重度NPDR和PDR患者FRT、PRT较治疗前均降低(P<0.05)。两组患者治疗前后FRT、PRT差值比较,差异无统计学意义(P>0.05)。提示抗VEGF药物通过结合VEGF阻断信号传导,进而减轻因血管渗漏引起的视网膜水肿。但也有研究[11]发现,抗VEGF治疗后,视网膜会呈现复发状态,这可能与抗VEGF治疗的作用时效有关,需要反复注射。
ELM是感光细胞内节和Muller细胞基底膜之间的膜样结构,IS/OS带对应的是光感受器内外节连接处,正常生理情况下,OS段每天都在新生,完全更新所需时间<10 d[12]。本研究结果显示,术前,有8只眼ELM层不连续,21只眼IS/OS层不连续,提示IS/OS层中富含线粒体,为光感受器细胞提供能量,较易受到损伤。术后,ELM结构不连续由8只眼减少为5只,IS/OS不连续,由21只眼减少为10只。付浴东等[13]研究发现,术前IS/OS缺损19眼,术后4周降低至10眼,与本研究结果类似,可能与抗VEGF治疗后水肿消退,有利于OS段正常功能的恢复有关。已有研究[14]表明,DME的发生与DR的严重程度密切相关,治疗后,重度NPDR组患者IS/OS连续率高于PDR组,差异有统计学意义(P<0.05)。提示当发展到PDR时,IS/OS层对抗VEGF药物的反应更差。但本研究结果只是描绘了OCTA图像上光反射的差异,并不一定表明组织病理学背景下的感光细胞紊乱。
对DME患者行抗VEGF治疗抑制病理性新生血管生成的同时,会不会也抑制了生理情况下正常血管的新生过程?本研究中,治疗后,重度NPDR和PDR组患者FD-300、SCP、DCP旁中心凹血流密度较治疗前比较,差异无统计学意义(P>0.05)。两组患者治疗前后FD-300、SCP、DCP旁中心凹血流密度差值比较,差异无统计学意义(P>0.05)。与对视网膜静脉阻塞继发黄斑水肿患者的研究结果类似[15],抗VEGF治疗后,SCP和DCP水平上的平均视网膜毛细血管密度与术前比较,差异无统计学意义(P>0.05)。提示单次抗VEGF治疗DME后,短期内可以抑制黄斑区新生毛细血管的生长,不会恶化黄斑区缺血状况。
综上所述,DME患者行抗VEGF治疗后,短期内FRT、PRT降低,并且未加重黄斑区视网膜缺血。但本研究的局限性在于样本量相对较小,时间较短,结果可能存在偏差。

