普萘洛尔抑制前列腺癌发展的分子机制
王仕钦,江春,黄卫,黄辉虎
(1.海南省中医院外二科,海口 570203;2.中山大学孙逸仙纪念医院泌尿外科,广州 510120)
前列腺癌(prostate cancer,PC)是男性泌尿生殖系统最常见的恶性肿瘤,严重危害人类健康[1]。目前前列腺癌常用化学治疗(化疗)药物有多柔比星[2]和紫杉醇[3]等,但患者对现有化疗药物产生的耐药性严重限制化疗的疗效,因此亟待寻找针对前列腺癌新的化疗药物。普萘洛尔(propranolol)是一种治疗心律失常的药物,近年来发现普萘洛尔也能够对新生儿血管瘤[4]、前列腺癌[5]、新生儿面部横纹肌瘤[6]和乳腺癌[7]等癌症具有一定效果。BROHEE等[8]发现普萘洛尔能够通过控制糖代谢抑制前列腺癌的发展,除此之外,普萘洛尔也能够明显降低前列腺癌的发病风险[9],但目前尚不明确其具体机制。小分子核糖核苷酸(microRNA,miRNA)是一类长约22个核苷酸的非编码小分子RNA,在肿瘤发病过程中具有重要作用[10],是一种治疗肿瘤的理想药物[11]。LU等[10]报道普萘洛尔能够靶向下调miR-1的表达水平。miR-382是一种抑癌因子,对食管鳞状细胞癌[12]、前列腺癌[13]和非小细胞肺癌[14]等癌症的发展具有调控作用。此外,普萘洛尔能够上调新生儿血管瘤细胞内miR-382的表达水平,抑制新生儿血管瘤细胞的发生和转移[15],同时,miR-382对PC细胞的增殖和迁移能力具有抑制作用[13]。SETD8是一种甲基转移酶,能够使p53信号通路失活[16]。CHEN等[14]报道miR-382能够通过靶向下调SETD8的表达,抑制非小细胞肺癌(non-small cell lung cancer,NSCLC)的发生。VESCHI等[17]报道SETD8能够通过p53信号通路,促进神经母细胞瘤的凋亡。笔者前期研究发现,miR-382和SETD8在前列腺癌组织和细胞内表达水平呈负相关,并且普萘洛尔对其表达水平具有调控作用。笔者通过研究,推测普萘洛尔通过miR-382/SETD8/p53分子轴抑制前列腺癌的发展,为临床治疗前列腺癌提供新的思路。报道如下。
1 材料与方法
1.1临床资料 选取2017年1—5月在中山大学孙逸仙纪念医院进行手术前列腺癌患者18例,TNM 分期:Ⅰ期6例,Ⅱ期12例。年龄45~78岁,平均年龄(56.3±5.4)岁。留取其前列腺癌组织及对应的癌旁组织,-80 ℃冰箱冷冻保存备用。所有患者术前均未接受放化疗,均签署知情同意书。
1.2细胞系 人前列腺癌细胞系(LNCaP和PC3)和人源胚胎肾细胞(HEK-293T)均购自中国科学院上海细胞库,RWPE-1细胞购自ATCC细胞库,分别用标准条件下培养细胞,待密度达80%时,收集细胞备用。
1.3实验动物 雄性NIH小鼠,体质量18~22 g,购自广东省医学实验动物中心,实验动物生产许可证号:SCXK(粤)2018-0002,饲养于无特定病原体(SPF)级实验动物环境中。
1.4主要试剂 胎牛血清(批号:16000-044,Gibco,San Diego,CA,USA),DMEM培养液(批号:C11885500BT,Gibco,San Diego,CA,USA),0.25%胰酶(批号:25200056,Thermo Fisher Scientific,USA),TRIzol试剂(批号:15596026,Invitrogen,USA),LipofectaminTM2000(批号:11660-027,Invitrogen,USA)。荧光基因报告载体pGL3-Luciferase Reporter由Ambion公司设计并合成,内参载体pRL-TK和双荧光素酶报告检测试剂(批号:E1910,Promega Corporation,USA)均购自Promega公司,兔抗人SETD8(批号:ab3798)、N-钙黏蛋白(N-cad,批号:ab18203)、E-钙黏蛋白(E-cad,批号:ab1416)、波形蛋白(Vimentin,批号:ab193555)、Bcl-2(批号:ab185002)、Bax(批号:ab32503)、Caspase 9(批号:ab219590)、p53(批号:ab32389)和p21(批号:ab218311) 抗体均购自美国Abcam公司;miR-382Mimic、miR-382 inhibitor和miR-382 control由上海吉玛基因公司设计合成,CCK-8细胞增殖及毒性试剂盒(批号:CA1210,Solarbio)。
1.5仪器 多功能酶标仪(SynergyTM2)购自BioTek公司,荧光定量PCR仪(Light-Cycler 480Ⅱ)购自Roche公司,化学发光仪(BDMAX)购自BD公司,Olympus1×51倒置显微镜(日本奥林巴斯公司)。
1.6qRT-PCR检测前列腺癌和癌旁组织中miR-382和SETD8 mRNA的表达 患者前列腺癌和癌旁组织标本各取约100 mg,加入1 mL Trizol,用PRO-200组织匀浆机(Pro Scientific,USA)充分破碎后,按照RNA提取试剂盒说明书提取总RNA。抽提总RNA测定浓度及纯度后,设计并合成miR-382逆转录引物:正向5′-ACACTCCAGCTGGGGAAGTTGTTCGTGGTG-3′,反向:5′-CGAATC CCTCAACTGGTGC-3′。SETD8 mRNA的逆转录引物为:正向5′-TCAGGCCTCA AAGCCACCTGAT-3′,反向5′-TAGGCCATCCAACC-TGCATTACCG-3′。U6的逆转录引物为:正向 5′-CTCGCTTCGCAGCACA-3′,反向 3′-AACGCTTCACG AATTTGCGT-3′。用逆转录试剂盒逆转录合成cDNA,置于-80 ℃冰箱冷冻保存备用。以β-actin作为内参,qRT-PCR引物见表1。用ABI PRISM 7500型荧光定量PCR扩增仪(Thermo fisher Scientific,USA)检测miR-382和SETD8 mRNA表达水平,Real-Time PCR反应体系及条件:2×SYBR Premix 10 μL,ddH2O 0.8 μL,cDNA1 μL,PCR上游和下游引物各0.5 μL,95 ℃预变性30 s,95 ℃ 20 s,60 ℃ 30 s,共40个循环。将miR-382和SETD8 mRNA表达量分别与内参U6和β-actin表达量的比值作为其相对表达水平,每个样本设3个复孔,实验重复3次。

表1 qPCR引物序列
1.7Western blotting检测蛋白表达水平 根据蛋白提取试剂盒说明书提取组织或细胞总蛋白,BCA法检测蛋白浓度。8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离胶电泳分离目的蛋白,湿转法将分离后的蛋白转至聚偏氟乙烯(PVDF)膜,浸入5%脱脂奶粉中,摇床上室温封闭2 h。洗膜后加入一抗,4 ℃孵育过夜。洗膜后加入辣根过氧化物酶(HRP)标记的鼠抗兔二抗(1:10 000),室温振荡孵育1 h。按照A液:B液(1:1)配制电致化学发光(ECL)发光液,混匀放置1 min后均匀加在膜正面。利用凝胶成像系统(美国Bio-Rad公司)观察蛋白条带,采用Image J软件进行灰度分析,实验重复3次。
1.8CCK-8检测前列腺癌细胞增殖能力 根据预实验将0.01 mg·mL-1普萘洛尔与PC细胞系LNCaP和PC3在37 ℃、5%二氧化碳(CO2)条件下共培养0,12,24,36和48 h,向每孔加入CCK-8液10 μL,继续孵育4 h后进行检测。SynergyTM2多功能酶标仪在波长450 nm处检测各孔吸光度值(A值),以A值代表细胞相对增殖水平,绘制细胞增殖曲线。
1.9小鼠动物模型的构建 将前列腺癌细胞系LNCaP和PC3在37 ℃、5%CO2饱和湿度培养箱中传代培养,待单细胞生长密度达到60%~80%时,用0.25%胰酶消化,收集细胞并将细胞浓度调整至1×105·mL-1,每只NIH小鼠皮下注射200 μL,共30只小鼠,在相同饲养条件下饲养10~14 d,建立前列腺癌动物模型。向每只小鼠肿瘤原位注射0.01 mg·mL-1普萘洛尔和磷酸盐缓冲液(PBS)100 μL,分为对照组(PBS)、普萘洛尔组,普萘洛尔+miR-382抑制剂组,每日观察小鼠,并记录小鼠死亡时间。
1.10瞬时超表达/敲降miR-382前列腺癌细胞系的构建 将处于对数生长期LNCaP和PC3细胞分别接种于6孔板中,每孔细胞2×106个,37 ℃、5%CO2饱和湿度培养箱中培养,细胞融合度达70%~80%时进行转染。分为转染试剂对照组、阴性对照组(NC)、miR-382 Mimic组和miR-382 Inhibitor组,miR-382 Mimic和Inhibitor终浓度为80 nmol·L-1。按照说明书将各组转染物与LipofectamineTM2000混合后转染细胞48 h之后,采用qRT-PCR鉴定转染是否成功。
1.11双荧光素酶报告基因法检测miR-382转染293T细胞后SETD8 3’-UTR的报告基因活性 生物信息学方法预测SETD8基因上miR-382靶向位点,以PC3细胞的cDNA为模板,设计引物扩增出野生型SETD8 3’-UTR序列,并以3’-UTR野生型载体为模板构建突变型SETD8(mu)3’-UTR报告载体。实验分组为:空白对照组(转染报告载体pGL3-Luciferase空载体、内参载体pRL-TK和Ctrl-Mimic);阴性对照组(转染报告载体pGL3-Luciferase空载体、内参载体pRL-TK和miR-382 Mimic);实验组[转染SETD8 3’-UTR或SETD8(mu)3’-UTR报告载体、内参载体pRL-TK和Ctrl-Mimic或miR-382 Mimic]。将293T细胞制成细胞悬液,接种至96孔板,每孔3 000个细胞,在37 ℃、5%CO2条件下培养24 h。待细胞密度达到约50%时进行转染,按照说明书将各组转染物与LipofectamineTM2000混合后转染细胞,48 h后加入PLB裂解液室温裂解15 min,采用双荧光素酶报告基因法上机检测,以Firefly与TK Renilla荧光活性的比值作为报告基因活性值,实验重复3次。
1.12Transwell侵袭实验检测前列腺癌细胞迁移能力 Transwell小室内膜预先用Matrigel胶包被,实验开始前向每个小室内加入含10 g·L-1BSA的无血清培养基50 μL,37 ℃孵育30 min,水化基底膜。分别将LNCaP和PC3细胞胰酶消化后计数,分为对照组、超表达miR-382组(miR-382 Mimic)和同时超表达miR-382和SETD8组(382-Mimic+SETD8),用无血清培养基调整细胞浓度为5×105·mL-1,向上层小室内加入细胞悬液200 μL,小室下层加入含10%胎牛血清的完全培养基400 μL。培养24 h后弃去培养基,用PBS洗2次,使用棉签轻轻拭去微孔膜上层的细胞。4%多聚甲醛溶液固定30 min,PBS洗2次,结晶紫染色30 min后,再用PBS洗2次。倒置显微镜下计数转移至微孔膜下层的细胞(选取5个视野),每组设置3个重复孔。
2 结果
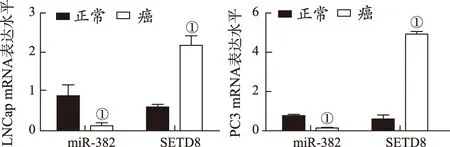
2.1miR-382和SETD8 mRNA在前列腺癌组织和细胞内的表达差异 Real-Time qPCR检测结果表明,miR-382在前列腺癌组织内的表达水平显著低于癌旁正常组织[(0.398±0.012)比(0.882±0.023),P=0.031],而SETD8在前列腺癌组织内的表达水平则明显高于癌旁正常组织[(2.83±0.141)比(1.526±0.083),P=0.002]。细胞实验结果见图1。与人正常前列腺上皮细胞系RWPE-1比较,miR-382在前列腺癌细胞系LNCaP和PC3内的表达水平明显下调(P=0.003,0.001),而SETD8的表达水平则明显上调(P=0.014,0.008)。表明miR-382在前列腺癌组织和细胞内低表达,而SETD8高表达,两者表达水平呈负相关。
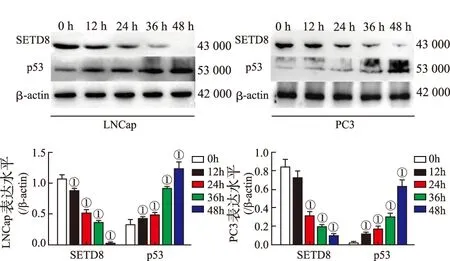
2.2普萘洛尔调控前列腺癌细胞内miR-382、SETD8和p53的表达 Real-Time qPCR结果见图2,与对照组(0 h)比较,随着共培养时间的延长,普萘洛尔明显提高miR-382在PC细胞系内的表达水平(P<0.01),抑制SETD8 mRNA的表达(P<0.01或P<0.05)。Western blotting结果见图3。与对照组(0 h)相比,共培养12,24,36和48 h后,普萘洛尔能够明显降低前列腺癌细胞系内SETD8蛋白的表达水平(P=0.005,0.003,0.002,0.012),并提高p53蛋白的表达水平(P=0.043,0.021,0.008,0.004)。表明普萘洛尔能够上调前列腺细胞系内miR-382和p53的表达水平,抑制SETD8的表达,并且随着共培养时间的延长,普萘洛尔的作用越明显。
①与正常组织比较,P<0.01。
①Compared with normal tissue,P<0.01.
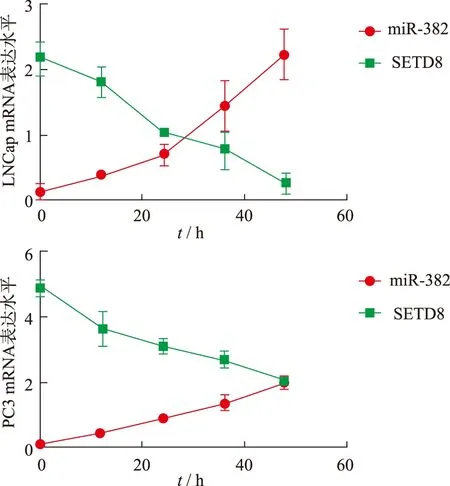
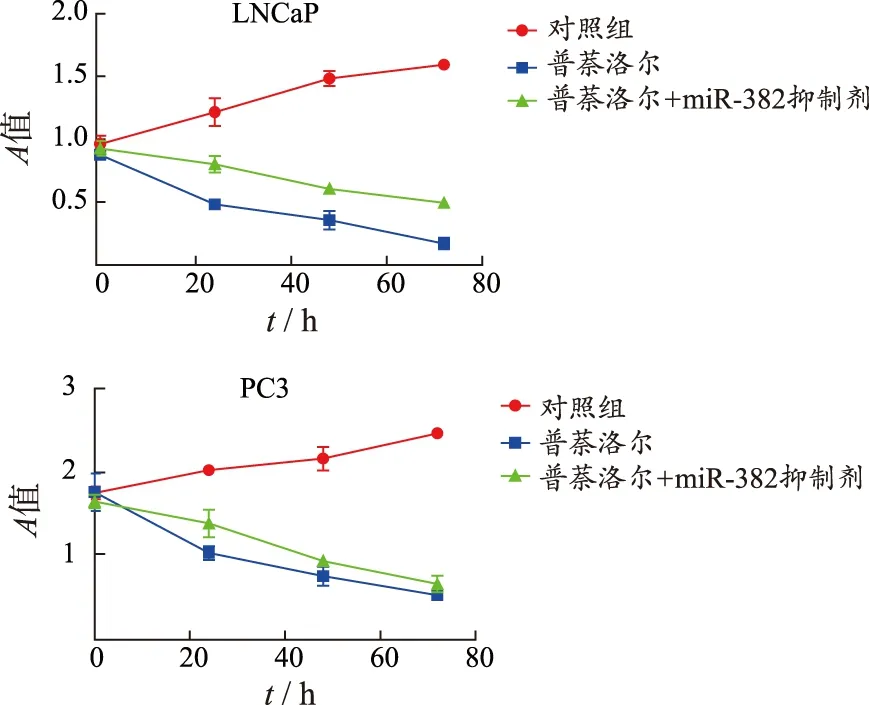
2.3前列腺癌细胞增殖抑制结果 将普萘洛尔与前列腺癌细胞共培养12,24,36和48 h,CCK-8检测细胞增殖能力结果见图4。与对照组比较,共培养48 h,普萘洛尔能够明显抑制两株前列腺癌细胞的增殖能力(P=0.053,0.048),共培养时间越长,效果越明显。实验结果表明,与普萘洛尔单独组比较,普萘洛尔和miR-382抑制剂同时共培养能够使前列腺癌细胞的增殖能力得到部分恢复,差异有统计学意义(P=0.015,0.017)。分别采用前列腺癌细胞系建立小鼠肿瘤模型,与对照组比较,肿瘤内单独注射普萘洛尔能够明显延长小鼠的存活时间(P=0.025,0.013),同时注射miR-382抑制剂则部分延长小鼠的存活时间(P=0.036,0.032)(图5)。以上结果表明,普萘洛尔通过miR-382抑制前列腺癌细胞的增殖。
①与0 h比较,P<0.05。
①Compared with 0 h,P<0.05.

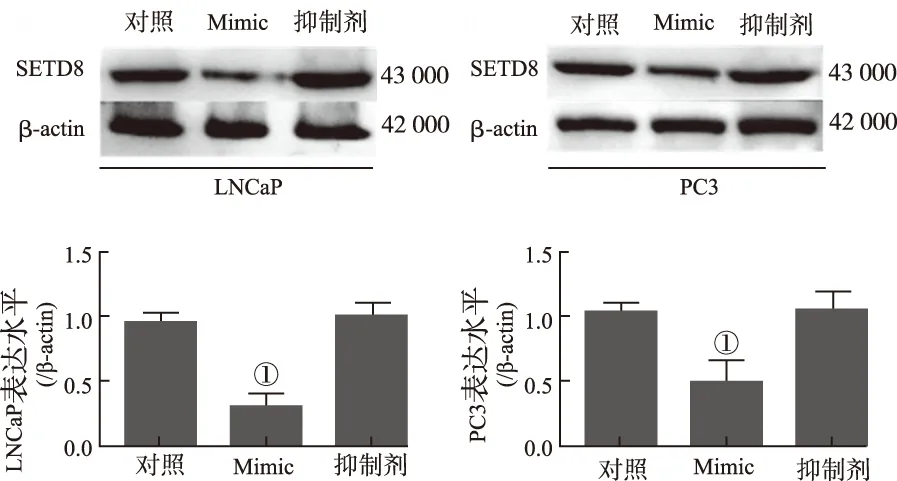
2.4miR-382通过SETD8调控p53/p21信号通路 Western blotting结果见图6,与对照组比较,miR-382 Mimic能够明显降低前列腺癌细胞系LNCaP和PC3内SETD8的表达水平[(0.286±0.016)和(0.493±0.028)比(0.963±0.083)和(1.112±0.321),P=0.008,0.013],而miR-382抑制剂对SETD8表达水平无明显影响[(0.963±0.083)和(1.112±0.321)比(1.064±0.201)和(1.031±0.032),P=0.241,0.883]。双荧光素酶报告基因检测结果显示(图7),miR-382能够靶向抑制SETD8的表达水平。为了进一步探究miR-382是否通过SETD8调控p53信号通路,在前列腺癌细胞系内超表达SETD8或采用miR-382 Mimic转染细胞,Western blotting结果表明(图8),与对照组比较,超表达SETD8能够明显降低前列腺癌细胞系内p53和p21的表达水平(P=0.008,0.024;P=0.013,0.041),miR-382 Mimic明显提高p53和p21的表达水平(P=0.001 2,0.006 3;P=0.004,0.021)。回复实验表明,与单独超表达SETD8组比较,同时采用miR-382 Mimic转染细胞能够回复p53和p21的表达水平(P=0.013,0.037;P=0.043,0.008)。以上结果提示,miR-382通过靶向调控SETD8,提高p53信号通路的活性。

图5 3组小鼠存活时间
①与对照组比较,P<0.01。
图6 Western blotting法检测前列腺癌细胞系LNCaP和PC3内SETD8表达水平
①Compared with control group,P<0.01.
Fig.6 The expression levels of SETD8 in prostate cancer LNcaP and PC3 cells detected by Western blotting
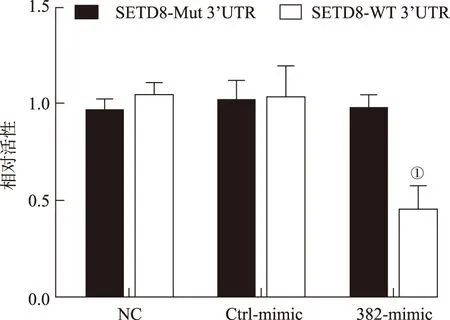
①与SETD8-Mut3'UTR比较,P<0.01。
图7 3组基因检测结果双荧光素酶报告基因
①Compared with SETD8-Mut3'UTR,P<0.01.
Fig.7 Results of dual-luciferase report gene for three groups
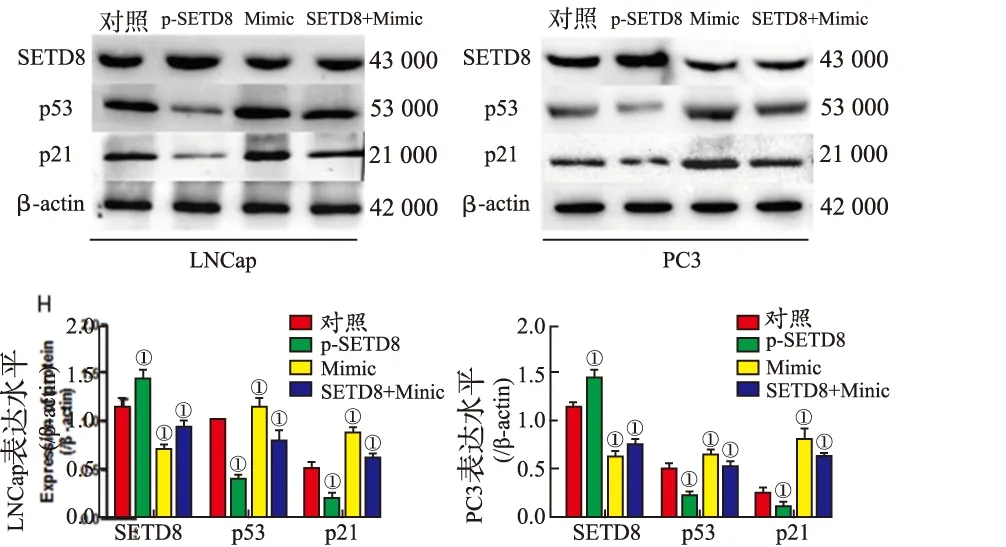
①与对照组比较,P<0.01。
图8 超表达SETD8对前列腺癌细胞系内p53和p21表达水平的影响
①Compared with control group,P<0.01.
Fig.8 Effect of overexpressed SETD8 on the expression of p53 and p21 in prostate cancer cells
2.5miR-382/SETD8分子轴调控前列腺癌细胞凋亡 由于p53信号通路与细胞凋亡相关,因此推测miR-382/SETD8分子轴能够调控前列腺癌细胞的凋亡。Western blotting结果表明(图9),与对照组比较,超表达SETD8能够明显提高前列腺癌细胞系(LNCaP和PC3)内凋亡抑制因子Bcl-2的表达水平(P=0.001,0.006 8),抑制凋亡促进因子Bax(P=0.009,P=0.012)和Caspase 9(P=0.042,0.036)的表达。而转染miR-382 Mimic则能够明显提高细胞内Bax(P=0.026,0.015)和Caspase 9(P=0.049,0.019)的表达水平,降低Bcl-2的表达水平(P=0.025,0.008)。回复实验表明,与单独超表达SETD8组比较,同时转染miR-382 Mimic能够抑制Bcl-2的表达(P=0.039,0.043),并促进Bax(P=0.012,0.006)和Caspase 9(P=0.021,0.043)的表达。表明miR-382能够促进细胞凋亡,而SETD8能够抑制细胞凋亡。该结果提示,miR-382可能通过SETD8促进前列腺癌细胞凋亡。
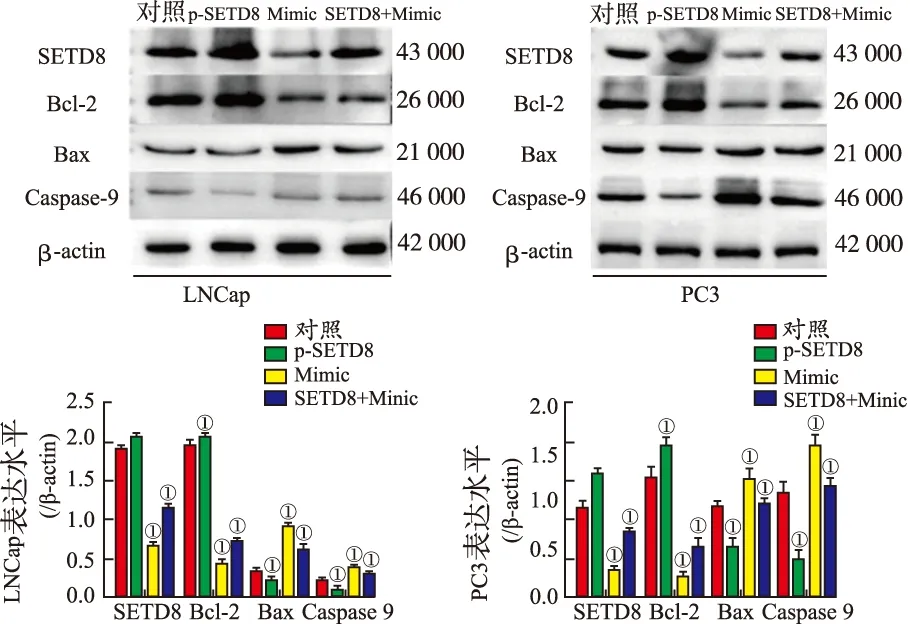
①与对照组比较,P<0.01。
图9 Western blotting法检测miR-382/SETD8分子轴调控细胞凋亡结果
①Compared with control group,P<0.01.
Fig.9 Regulation of miR-382/SETD8 axis on apoptosis detected by western blotting
2.6miR-382通过SETD8调控前列腺癌细胞迁移 Transwell细胞迁移实验结果见图10,与对照组比较,miR-382 Mimic能够明显降低前列腺癌细胞LNCaP和PC3的迁移能力[(334.4±38.18)和(176.8±19.56)比(129.8±16.65)和(50.6±11.36),均P<0.01]。但是与单独转染miR-382 Mimic组相比,同时超表达SETD8并转染miR-382则能够提高细胞的迁移能力[(129.8±16.65)和(50.6±11.36)比(214.8±31.35)和(81.8±10.65),均P<0.01]。Western blotting结果见图11。与对照组比较,超表达SETD8能够提高前列腺癌细胞内N-cad(P=0.008,0.004 3)和Vimentin(P=0.015,0.035)的表达水平,并抑制E-cad的表达(P=0.003,0.001)。转染miR-382 Mimic能够抑制N-cad(P=0.001,0.004)和Vimentin(P=0.029,0.018)的表达,提高E-cad的表达水平(P=0.023,0.031)。与单独转染miR-382 Mimic组比较,同时转染miR-382 Mimic并超表达SETD8能够明显提高N-cad(P=0.003,0.045)和Vimentin(P=0.008,0.012)的表达水平,抑制E-cad(P=0.007,0.028)的表达。以上结果说明miR-382能够抑制前列腺癌细胞迁移,而SETD8则能够促进细胞迁移。提示miR-382可能通过调控SETD8抑制前列腺癌的转移。
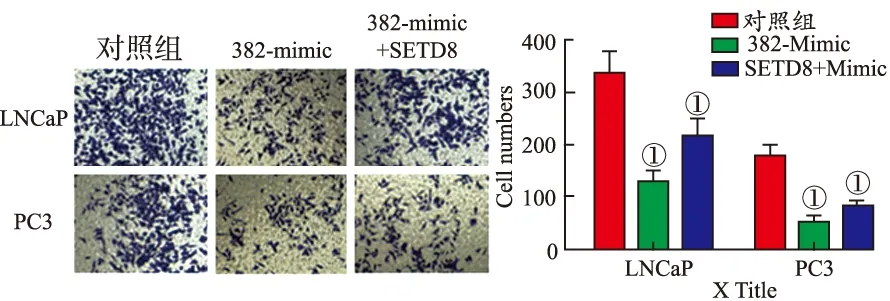
①与对照组比较,P<0.01。
图10 Transwell细胞迁移实验结果
①Compared with control group,P<0.01.
Fig.10 Result of cell migration test by transwell
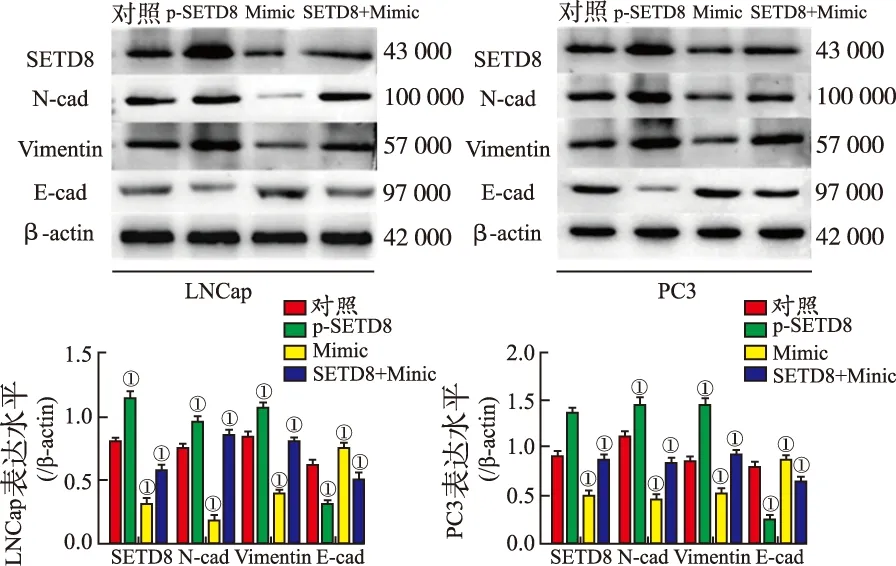
①与对照组比较,P<0.05。
图11 Western blotting检测miR-382/SETD8分子轴调控细胞迁移结果
①Compared with control group,P<0.05.
Fig.11 Regulation of miR-382/SETD8 axis on cell migration detected by western blotting
3 讨论
前列腺癌严重危害男性健康,目前患者已对多种化疗药物产生耐药性,严重限制化疗的疗效[19]。普萘洛尔是一种治疗心律失常的药物,目前已被应用于多种癌症的治疗[20],本课题组前期实验发现普萘洛尔能够抑制前列腺癌的发生、发展,但目前尚不清楚其具体机制。
miRNAs已被报道参与癌症的发生,但笔者目前尚未见文献报道普萘洛尔通过miRNAs抑制前列腺癌。本研究发现,与对照组比较,抑癌因子miR-382在前列腺癌组织和细胞内低表达,并且超表达miR-382能够抑制前列腺癌细胞的增殖和迁移,并促进细胞凋亡,与ZGANG等[13]研究结果一致,提示miR-382可能是前列腺癌的潜在治疗因子。SETD8能够促进前列腺癌的发生[21],高表达SETD8能够通过失活p53/p21信号通路,抑制细胞凋亡,促进细胞增殖[17]。而miR-382能够靶向下调SETD8的表达水平[22],这与本研究结果一致,笔者发现SETD8在前列腺癌组织和细胞内异常高表达,与miR-382的表达水平呈负相关,并且p53/p21信号通路处于失活状态,提示miR-382/SETD8/p53/p21分子轴可能在前列腺癌的发生、发展过程中扮演重要角色,但尚不清楚普萘洛尔是否通过调控miR-382/SETD8/p53/p21分子轴治疗前列腺癌。
进一步研究发现,普萘洛尔能够明显提高前列腺癌细胞内miR-382的表达水平,降低SETD8的表达并激活p53/p21信号通路。实验结果证实,普萘洛尔能够通过提高前列腺癌细胞内miR-382的表达水平,miR-382抑制SETD8的表达,解除SETD8对p53/p21信号通路的抑制作用,激活p32/p21信号通路,抑制前列腺癌细胞的增殖和迁移能力,促进细胞凋亡,并延长荷瘤小鼠的生存时间。LI等[15]研究发现,普萘洛尔能够抑制婴儿血管瘤细胞内miR-382的表达水平,进而抑制其发展。本研究结果与之不一致,提示普萘洛尔和miR-382可能对不同癌症具有不同的效果,其具体机制仍需进一步探究。以上结果表明,普萘洛尔能够通过调控miR-382/SETD8/p53/p21分子轴抑制前列腺癌的发生、发展和转移。值得注意的是,有文献报道发现p53基因在前列腺癌细胞系PC3中存在缺失突变[23],但目前也有文献证实p53在PC3细胞的增殖和凋亡等生命活动中扮演重要角色。有研究发现lncRNA LINP1能够通过靶向p53,调控前列腺癌细胞系p53的增殖能力[24]。除此之外,4-FTSC(4-Fluorobenzaldehyde limonene-based thiosemicarbazone)能够通过调控p53蛋白的表达,诱导PC3细胞发生凋亡[25],其具体机制仍需进一步探究。
综上所述,本研究证实普萘洛尔可以作为前列腺癌的潜在治疗药物,并且揭示普萘洛尔通过miR-382/SETD8/p53分子轴抑制前列腺癌细胞的增殖和迁移,促进细胞凋亡的分子机制,为前列腺癌的治疗提供了新的靶标。

