原发性干燥综合征患者外周血调节性B细胞表达水平及意义
孙超,王健,王信,郭文静,李志军
(蚌埠医学院第一附属医院风湿免疫科,安徽 蚌埠 233000)
干燥综合征是一种主要侵犯机体唾液腺、泪腺、外分泌腺,且随病情进展可累及其他器官、系统损害的自身免疫性疾病,患者主要临床表现为口咽干燥等[1]。目前,对于干燥综合征的发病机制尚处于研究探索阶段。研究指出,体液因子、细胞因子、环境、遗传等因素在干燥综合征发病中起到了重要作用,是多种因素共同作用的结果[2-3]。在干燥综合征发病过程中,部分细胞因子具有辅助机体免疫系统中细胞之间信号传递,趋化免疫细胞到达泪腺、唾液腺等分泌腺体,以及调节免疫功能的作用[4]。近年来研究发现,调节性B细胞 (Bregs)能够通过分泌转化生长因子β1(TGF-β1) 及白介素-10(IL-10) 等细胞发挥负向调控免疫的作用[5]。研究显示,在多种自身免疫性疾病如类风湿关节炎中,Bregs表达水平均出现异常[6]。本研究通过检测原发性干燥综合征患者外周血Bregs细胞水平变化情况,分析了Bregs在原发性干燥综合征发病机制中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料 选取蚌埠医学院第一附属医院2017年1月至2019年4月收治的36例干燥综合征患者作为病例组,入选标准: (1)均符合干燥综合征的诊断标准[7]; (2) 均为初治者; (3) 入组前均未接受免疫抑制剂、糖皮质激素等治疗;(4)均为原发性干燥综合征;(5)研究对象及家属均对本研究知情同意。排除标准: (1)存在精神障碍、智力障碍以及认知功能障碍者; (2)伴有恶性肿瘤或者肾功能衰竭者; (3)合并其他免疫性疾病者;(4)入组时存在急慢性感染者;(5)长期服用甲氨蝶呤、青霉胺、激素等抗风湿药物者;(6)年龄在18岁以下者。36例患者中,男4例,女32例;年龄19~76岁,平均年龄 (50.29±7.84)岁;欧洲风湿病联盟制定的干燥综合征病情评估指数 (ESSDAI):0~2分11例,3~5分22例,6~8分3例;有系统损伤24例,无系统损伤12例;抗 SSA抗体阳性20例,阴性16例;抗SSB抗体阳性10例,阴性26例。另选取同期门诊健康体检者30例作为对照组,均无急慢性感染、自身免疫性疾病或者自身免疫性疾病家族史,其中男5例,女25例;年龄20~75岁,平均年龄(50.76±7.29)岁。2组研究对象性别、年龄等比较差异均无统计学意义 (P>0.05)。本研究经医院伦理委员会批准同意。
1.2 方法
1.2.1 流式细胞术检测Bregs细胞水平 抽取研究对象清晨静脉血2 ml,经抗凝处理后取100μl加入至流式细管中,顺序编号之后送检;于流式细管中各加入20μl的APC-CD19单抗、FITCCD24单抗、PE-CD38单抗 (均为美国 BD Biosciences公司产品),并设置同型抗体的对照组,加入20μl的APC-IgG1单抗、FITC-IgG2b单抗、PE-IgG1单抗 (均为美国BD Biosciences公司产品);混匀之后室温下避光保存30 min,以确保试剂与样本能够充分反应;然后加入红细胞裂解液150μl,震荡混匀,放置于冰箱中避光保存 20 min,温度为4℃;以2 000 r/min离心10 min,弃去上清液,取白细胞沉淀用PBS液洗涤3次,然后分别于2 000 r/min离心10 min,循环离心2次,于沉淀中加入500 ml的PBS液制成单细胞悬液,滤网过滤,使用美国BD公司生产FACSCalibur流式细胞仪进行检测。Bregs细胞水平以Bregs细胞占CD19+B比例进行表示。
1.2.2 ELISA法检测血清IL-10和TGF-β1水平
抽取所有研究对象清晨静脉血5 ml,离心后取血清置于-70℃冰箱中保存待检;采取ELISA法检测血清IL-10和TGF-β1水平,于检测TGF-β1之前对血清进行酸化处理,以激活血清中的TGF-β1,严格按照试剂盒说明进行。
1.2.3 治疗方法 病例组所有患者均给予醋酸泼尼松联合硫酸羟氯喹治疗,醋酸泼尼松片 (许昌奥森制药有限公司,国药准字H41021232)口服,每天1次,每次5~10 mg;硫酸羟氯喹片 (上海中西制药有限公司,国药准字H19990264)口服,每天1次,每次0.2 g;治疗4周后再次检测外周血Bregs细胞水平和血清IL-10和TGF-β1水平。
1.3 观察指标 比较2组研究对象外周血Bregs细胞水平及血清IL-10和TGF-β1水平,比较病例组不同临床特征患者外周血Bregs细胞水平,比较治疗前后外周血Bregs细胞水平和血清IL-10和TGF-β1水平,分析治疗前外周血Bregs细胞水平与血清IL-10、TGF-β1水平的相关性。
1.4 统计学方法 采用SPSS 17.0软件进行统计学分析,计量资料采用均数±标准差表示,组间比较采用t检验,多组计量资料采用方差分析、q检验,相关性分析采用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 2组研究对象外周血Bregs细胞水平和血清IL-10、TGF-β1水平比较 病例组外周血Bregs细胞水平和血清IL-10、TGF-β1水平均显著高于对照组 (P<0.01), 见表1。
表1 2组研究对象外周血Bregs细胞水平和血清IL-10、TGF-β1水平比较 (±s)

表1 2组研究对象外周血Bregs细胞水平和血清IL-10、TGF-β1水平比较 (±s)
组别 n Bregs (%) IL-10 (pg/ml) TGF-β1 (pg/ml)对照组 30 1.34±0.67 27.45±7.62 12.05±4.37病例组 36 4.69±1.83 53.89±14.43 17.86±7.49 t值 10.206 9.033 3.924 P值 0.000 0.000 0.000
2.2 不同临床特征干燥综合征患者外周血Bregs细胞水平比较 抗SSA抗体、抗SSB抗体阳性患者外周血Bregs细胞水平均显著高于抗SSA抗体、抗SSB抗体阴性患者 (P<0.05);不同年龄、性别、ESSDAI评分以及有无系统损伤患者之间外周血Bregs细胞水平比较,差异均无统计学意义 (P>0.05), 见表 2。
表2 不同临床特征患者外周血Bregs细胞水平比较 (±s)

表2 不同临床特征患者外周血Bregs细胞水平比较 (±s)
指标 n Bregs(%) 统计值 P值年龄 (岁)≥60 14 4.86±1.94 0.501 0.620<60 22 4.53±1.92性别男4 4.89±1.89 0.349 0.729女32 4.63±1.95 ESSDAI评分 (分)0~2 11 4.12±1.79 1.134 0.273 3~5 22 4.65±1.84 6~8 3 5.26±2.06系统损伤有24 5.21±1.97 1.129 0.267无12 4.48±1.49抗SSA抗体阳性 20 5.34±1.68 2.207 0.034阴性 16 4.07±1.76抗SSB抗体阳性 10 5.48±1.79 2.256 0.030阴性 26 4.03±1.57
2.3 干燥综合征患者治疗前后外周血Bregs细胞水平和血清IL-10、TGF-β1水平比较 治疗4周后,干燥综合征患者外周血Bregs细胞水平和血清IL-10、TGF-β1水平均显著低于治疗前 (P<0.01), 见表 3。
2.4 干燥综合征患者治疗前外周血Bregs细胞水平与血清 IL-10、TGF-β1水平的相关性Spearman相关性分析结果显示,外周血Bregs细胞水平与血清IL-10、TGF-β1水平均呈正相关 (r分别为 0.589、 0.004,P<0.05)。
表3 干燥综合征患者治疗前后外周血Bregs细胞水平和血清IL-10、TGF-β1水平比较 (±s)
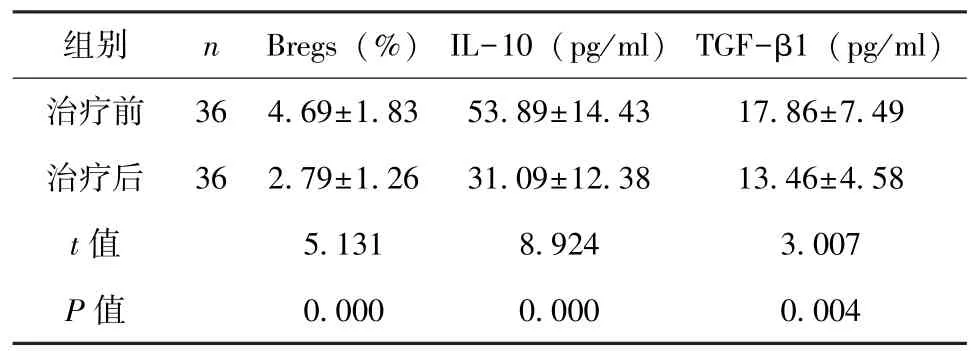
表3 干燥综合征患者治疗前后外周血Bregs细胞水平和血清IL-10、TGF-β1水平比较 (±s)
组别 n Bregs (%) IL-10 (pg/ml) TGF-β1 (pg/ml)治疗前 36 4.69±1.83 53.89±14.43 17.86±7.49治疗后 36 2.79±1.26 31.09±12.38 13.46±4.58 t值 5.131 8.924 3.007 P值 0.000 0.000 0.004
3 讨论
干燥综合征是一种累及机体外分泌腺体,主要是以侵犯泪腺以及唾液腺为主的自身免疫性疾病,多见于中老年女性,对患者生活质量造成严重影响。干燥综合征病理特征为唾液腺以及泪腺等外分泌腺体中IgG型浆细胞、单核细胞、淋巴细胞大量浸润为特点,进而引起外分泌腺功能障碍,患者临床表现为眼干、口干等,部分患者还会出现脏器与系统损伤。干燥综合征病因及发病机制目前并未完全明确,研究认为该病的发生与多种细胞因子异常释放相关[8]。干燥综合征起病缓慢,在诊断时容易出现漏诊误诊,临床中该病主要以对症治疗为主,延缓病情发展,改善口干、眼干等临床症状。
部分学者认为,机体中B淋巴细胞所介导的体液免疫,可以产生多种免疫复合物、多克隆免疫球蛋白以及自身抗体,造成外分泌腺破坏以及多系统损害[9]。Bregs可以通过分泌多种细胞因子,间接或者直接作用于其他免疫细胞,进而发挥抑制炎症反应的作用。本研究中,病例组外周血Bregs水平显著高于健康对照组,这与相关研究结果[10]一致,说明Bregs可能参与了干燥综合征的发病过程。进一步对不同临床特征患者外周血Bregs细胞水平分析发现,不同年龄、性别患者之间,外周血Bregs细胞水平比较差异无统计学意义;而且在不同ESSDAI评分以及有无系统损伤患者之间,外周血Bregs细胞水平比较差异亦无统计学意义,说明Bregs可能与干燥综合征疾病活动并无密切关系。抗SSA抗体、抗SSB抗体阳性患者外周血Bregs细胞水平均显著高于抗SSA抗体、抗SSB抗体阴性患者,说明干燥综合征患者Bregs细胞水平异常可能与免疫功能紊乱有密切关系[11]。
研究指出,Bregs水平在干燥综合征患者及健康人当中,具有减轻CD4+T细胞所介导的炎症反应的作用[12]。本研究中,治疗4周之后,干燥综合征患者外周血Bregs表达水平较治疗前显著降低。经过治疗之后,Bregs相应减少,机体内的炎症反应减轻,患者免疫调节功能改善,病情得到缓解。Bregs可以分泌抑制性细胞因子TGF-β1以及IL-10,在介导免疫耐受以及调节免疫应答当中具有重要作用。Bregs通过分泌TGF-β1可以促进效应T细胞凋亡,减少与炎症相关的CD8+T细胞的数量,减少效应性T细胞上T细胞抗原受体的表达数量,削弱辅助T细胞的活化,抑制自身免疫性疾病的进展。IL-10能够有效地抑制炎症因子释放及T细胞增殖,对于调节性T细胞分化或者维持起到重要作用[13]。本研究中,外周血 Bregs表达水平与血清IL-10、TGF-β1水平均呈显著正相关性,说明Bregs可能通过分泌TGF-β1及IL-10影响机体其他免疫细胞,即发挥负向调节作用,从而维持自身免疫耐受。
综上所述,干燥综合征患者外周血Bregs表达水平显著升高,可能与干燥综合征的发病有一定关系,且患者Bregs表达水平异常可能与自身免疫功能紊乱有关,但Bregs表达水平与干燥综合征的疾病活动无直接相关性。

