无花果总黄酮闪式提取工艺优化及其抗氧化活性
莫一凡,姚凌云,冯 涛,宋诗清,孙 敏
(上海应用技术大学香料香精技术与工程学院,上海 201418)
无花果(FicuscaricaL.)桑科榕属,其新鲜果实极易腐败,因而被加工为粉、粒、糕等[1]。研究表明,无花果在抗癌、抗肿瘤、抗氧化、抗病毒、抗菌、治疗白癜风等方面有显著作用[2]。抗氧化作用的探究一直以来是医学研究的重要环节[3]。黄酮类物质是一种母核结构为2-苯基色原酮的多酚类化合物,多以糖苷的形式存在[4-5],它具有高度的化学反应性能,能够清除生物机体内的自由基,具有良好的抗氧化功效[6-7],不同品种无花果中均有定量的黄酮。

本研究以新疆无花果干为原料,对其总黄酮进行了提取并且通过响应面优化最佳提取工艺,随后将无花果总黄酮与抗坏血酸的抗氧化活性进行了对比分析,为无花果干总黄酮在功能性食品、药品、化妆品等领域应用提供理论依据。
1 材料与方法
1.1 材料与仪器
无花果干 新疆比巴哈农牧科技有限公司;无水乙醇、NaNO2、Al(NO3)·9H2O、水杨酸、FeSO4、H2O2、NaCl、KH2PO4、Na2HPO4·12H2O、KCl、NaOH、盐酸、邻苯三酚、叔丁基对苯二酚、三羟甲基氨基甲烷、抗坏血酸 分析纯,上海阿拉丁生化科技股份有限公司;芦丁标品 纯度>98%,上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 分析纯,国药集团化学试剂有限公司。
FA1604型电子天平 上海天平仪器厂;JHBE-60T型闪式高速提取器 上海钒帜精密设备有限公司;SUS304型科满仕高速多功能粉碎机 永康市铂欧五金制品有限公司;UV2350型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;DHG-9140型电热恒温鼓风干燥箱 上海-恒科学仪器有限公司;SK5200BT型超声清洗器 上海科导超声仪器有限公司;FE20-Plus型实验室pH计 上海梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 无花果总黄酮的提取工艺 方法参考文献[19]并做适当修改,无花果干粉碎过60目筛,精确称取无花果粉末(1.000±0.001) g按一定液料比加入一定体积分数乙醇作为提取溶剂,在设定电压下,在闪式提取器中提取一定时间,离心(4 ℃,10000 r/min,10 min)、过滤,将所得溶液用50%乙醇定容于70 mL即可得到提取物原液,最终将提取原液放置冰箱4 ℃冷藏保存。
1.2.2 单因素实验
1.2.2.1 乙醇体积分数对无花果总黄酮提取的影响 固定提取电压150 V,提取时间为60 s,料液比为50∶1 mL/g,考察乙醇体积分数分别为40%,50%,60%,70%,80%时对无花果总黄酮提取量的影响,确定适宜的乙醇体积分数。
1.2.2.2 电压对无花果总黄酮提取的影响 固定乙醇体积分数为60%,提取时间为60 s,液料比为50∶1 mL/g,考察提取电压分别为75、100、125、150、175 V对无花果总黄酮提取量的影响,确定适宜的提取电压。
1.2.2.3 时间对无花果总黄酮提取的影响 固定提取电压为150 V,固定乙醇体积分数为60%,液料比为50∶1 mL/g,考察提取时间分别为20、40、60、80、100 s时对无花果总黄酮提取量的影响,确定适宜的提取时间。
1.2.2.4 液料比对无花果总黄酮提取的影响 固定提取电压为150 V,固定乙醇体积分数为60%,提取时间为60 s,考察液料比分别为30∶1、40∶1、50∶1、60∶1、70∶1 mL/g时对无花果总黄酮提取量的影响,从而确定适宜的液料比。
1.2.3 响应面试验 在单因素实验结果的基础上,按照Box-Benhnken中心组合实验设计原理,采用Design-Expert 8.0.6软件设计响应面试验。本实验以无花果总黄酮提取量为响应值,选取提取电压、乙醇体积分数、提取时间以及液料比四个因素三水平进行实验探究,因素水平见表1。
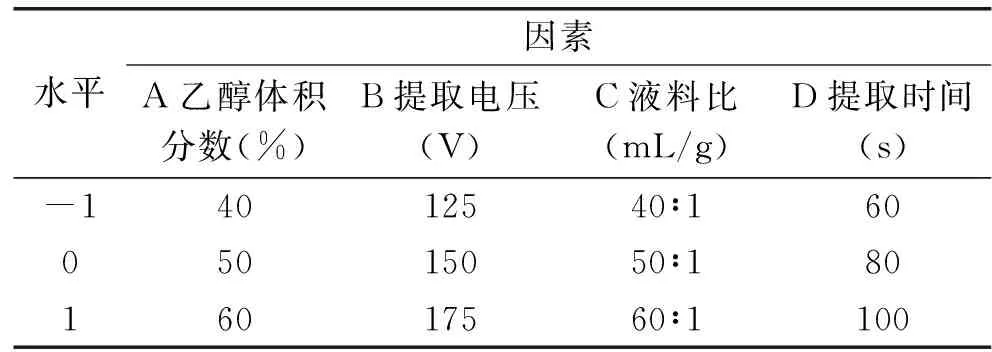
表1 因素水平编码Table 1 Coded of factors and levels
1.2.4 黄酮提取量的计算
1.2.4.1 标准曲线的绘制 称取芦丁标准品25 mg置于50 mL容量瓶中,加入无水乙醇溶解并且将其定容至刻度线,摇匀即得芦丁对照品溶液。精确吸取芦丁对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于10 mL的容量瓶中,各加入5 mL蒸馏水,加入5% NaNO20.6 mL,摇匀后静置6 min,加入10% AgNO30.6 mL,摇匀后静置6 min,加入5% NaOH 3 mL,加水至刻度,摇匀后放置20 min。于波长510 nm处测定吸光度A,以吸光度为横坐标,芦丁浓度(mg/mL)为纵坐标,绘制标准曲线为:y=1.0472x+0.0116,R2=0.9996
1.2.4.2 无花果黄酮含量的测定及提取量计算 准确量取0.7 mL的样液于10 mL的比色皿中,在紫外可见分光光度计中测得样液的吸光度,根据标准曲线计算黄酮浓度,按照公式(1)即可计算出无花果黄酮提取量。
式(1)
式中:W为无花果总黄酮提取量(mg/g),c为总黄酮浓度(mg/mL),D为提取溶液体积(mL),m为无花果粉的质量(g)。
1.2.5 无花果总黄酮体外抗氧化试验
1.2.5.1 无花果总黄酮对DPPH自由基清除活性测定 方法参照文献[20-22]并做适当修改,取最佳提取工艺条件下的无花果总黄酮提取物,加无水乙醇配制成含总黄酮浓度为0.03、0.06、0.08、0.10、0.14、0.20、0.26、0.30 mg/mL的样品溶液。抗坏血酸标准品为阳性对照,加无水乙醇配制成与总黄酮浓度相同的8种不同浓度。于试管中加入3 mL 2×10-4mol/L的DPPH溶液,再分别加入1 mL配制好的无花果溶液或抗坏血酸溶液(0.03~0.3 mg/mL),充分混匀,并在室温避光放置30 min后在517 nm处测定各组吸光度A1,以无水乙醇为空白对照组在517 nm处测定吸光度值A2,对照组用无水乙醇代替样品测定吸光度A0,按公式(2)计算清除率以及IC50。
DPPH自由基清除率(%)=[(A0-A1+A2)/A0]×100
式(2)
1.2.5.2 无花果总黄酮对OH自由基清除能力的测定 方法参照文献[23]并做适当修改,双氧水与二价铁离子反应生成OH,加入水杨酸与OH生成有色物质,在517 nm处有最大吸收峰。取1 mL配制好的样品溶液或抗坏血酸溶液(0.03~0.3 mg/mL)分别加入1 mL浓度为9 mmol/L的水杨酸,然后加入1 mL浓度为9 mmol/L的硫酸亚铁,最后加入1 mL浓度为9 mmol/L双氧水,反应30 min,在517 nm处测定吸光度A1。空白对照组用1 mL水代替双氧水,其余步骤同上,测定吸光度A0。最后用水代替黄酮提取液,测定吸光度A2。按公式(3)计算清除率以及IC50。
OH自由基清除率(%)=[1-(A1-A0)/A2]×100
式(3)
1.2.5.3 无花果总黄酮对ABTS+自由基清除能力的测定 方法参考王晶晶[24]以及Re等[25]的测定方法并作适当调整,测定无花果总黄酮对于ABTS自由基的清除能力。配制磷酸缓冲盐(PBS),用PBS作为溶剂配制出浓度为7 mmol/L的ABTS溶液并置于0~4 ℃保存。用PBS作为溶剂配制浓度为2.5 mmol/L的K2S2O8溶液。取50 mL ABTS溶液与50 mL K2S2O8溶液等体积混合,25 ℃避光反应12~16 h,使用前用无水乙醇将其稀释,使其在25 ℃,734 nm波长下吸光度为0.7±0.02。分别取1 mL配制好的样品溶液或抗坏血酸溶液(0.03~0.3 mg/mL)和3 mL ABTS工作液充分混匀,在室温下反应30 min后,于734 nm波长下测定吸光值为A1。取1 mL PBS溶液加3 mL ABTS自由基稀释液并测定吸光值为A0,取1 mL无花果总黄酮稀释液加3 mL PBS溶液测定其吸光度值为A2按(4)即可计算出清除率以及IC50值。
ABTS+自由基清除率(%)=[(A0-A1+A2)/A0]×100
式(4)
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对无花果总黄酮提取量的影响 由图1可见,乙醇体积分数对无花果总黄酮的提取有较大影响。当乙醇体积分数为40%~50%时总黄酮提取量随着乙醇体积分数的增大而增大,进一步提高乙醇体积分数后总黄酮提取量呈下降趋势,这与苏适等[26]、黄丹丹[27]的无花果黄酮提取研究结果一致。这是由于在乙醇体积分数大于50%时,无花果中的色素,脂溶物质和糖类等杂质大量溶出从而降低了总黄酮物质的溶解[28]。在乙醇体积分数为50%时,溶剂与无花果黄酮类物质极性最接近因而总黄酮提取量达到最大,为28.53 mg/g。
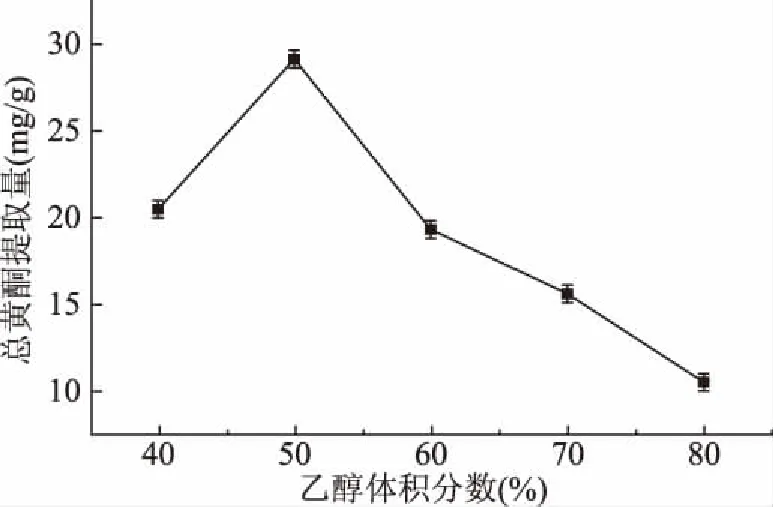
图1 不同乙醇体积分数对无花果总黄酮提取量的影响Fig.1 Effect of different ethanol concentrationson the yield of total flavonoids in figs
2.1.2 提取电压对无花果总黄酮提取量的影响 从图2可见,提取电压对无花果总黄酮的提取有较大影响。当提取电压为75~150 V时,总黄酮提取量随着电压的增大而增大,进一步提高提取电压后无花果总黄酮提取量呈下降趋势。这是由于当提取电压大于150 V,闪式提取器的刀头转速也增大,无花果粒径变小从而引起表面能增大,使其被吸附在固体表面或细微粒间相互粘联,不易溶解,因而总黄酮提取量降低[29]。当提取电压为150 V时,总黄酮提取量达到最大,为19.16 mg/g。

图2 不同提取电压对无花果总黄酮提取量的影响Fig.2 Effect of different extraction voltageson yield of total flavonoids in figs
2.1.3 提取时间对无花果总黄酮提取量的影响 从图3可见,提取时间对无花果总黄酮的提取有较大影响。当提取时间为20~80 s时,无花果总黄酮提取量随着温度的升高而增大,进一步延长提取时间后无花果总黄酮提取量呈下降趋势。当提取时间大于80 s时,黄酮提取量下降可能是由于随着提取时间延长,闪式提取器头部产生大量的热量,提取溶剂温度升高,使黄酮类物质发生如氧化或分解等副反应,从而导致黄酮类化合物含量下降[30]。在提取时间为80 s时,总黄酮提取量达到最大,为20.48 mg/g。

图3 不同提取时间对无花果总黄酮提取量的影响Fig.3 Effect of different extraction timeson the yield of total flavonoids in figs
2.1.4 液料比对无花果总黄酮提取量的影响 从图4可见,液料比对无花果总黄酮的提取有影响。当液料比为30~50 mL/g时,无花果总黄酮提取量随着液料比增大而增大,进一步加大液料比后,无花果总黄酮提取量呈下降趋势,这与彭珊珊等[31]的无花果黄酮研究结果一致。这是由于当液料比过小时溶剂未能与样品充分接触,细胞内外的浓度差较低影响了总黄酮的传质效率所以其提取量较低,随着液料比的增大,无花果总黄酮提取量随之增大,当液料比大于50 mL/g时单位体积溶剂内总黄酮含量降低,被溶解的黄酮容易发生变性分解,因而总黄酮提取量降低[32]。液料比为50 mL/g时,总黄酮提取量达到最大,为19.16 mg/g。
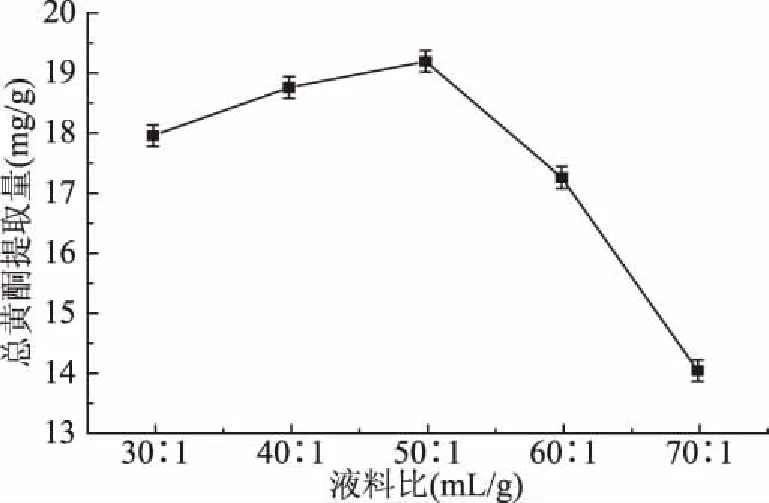
图4 不同液料比对无花果总黄酮提取量的影响Fig.4 Effect of different liquid materialson the yield of total flavonoids in figs
2.2 Box-Behnken响应面法试验结果
2.2.1 响应面回归模型建立与分析 采用Box-Behnken的中心组合的原理为依据,以乙醇体积分数(A)、提取电压(B)、液料比(C)、提取时间(D)为自变量,无花果总黄酮提取量为因变量,采用四水平三因素响应面优化无花果总黄酮提取工艺条件,结果见下表2。
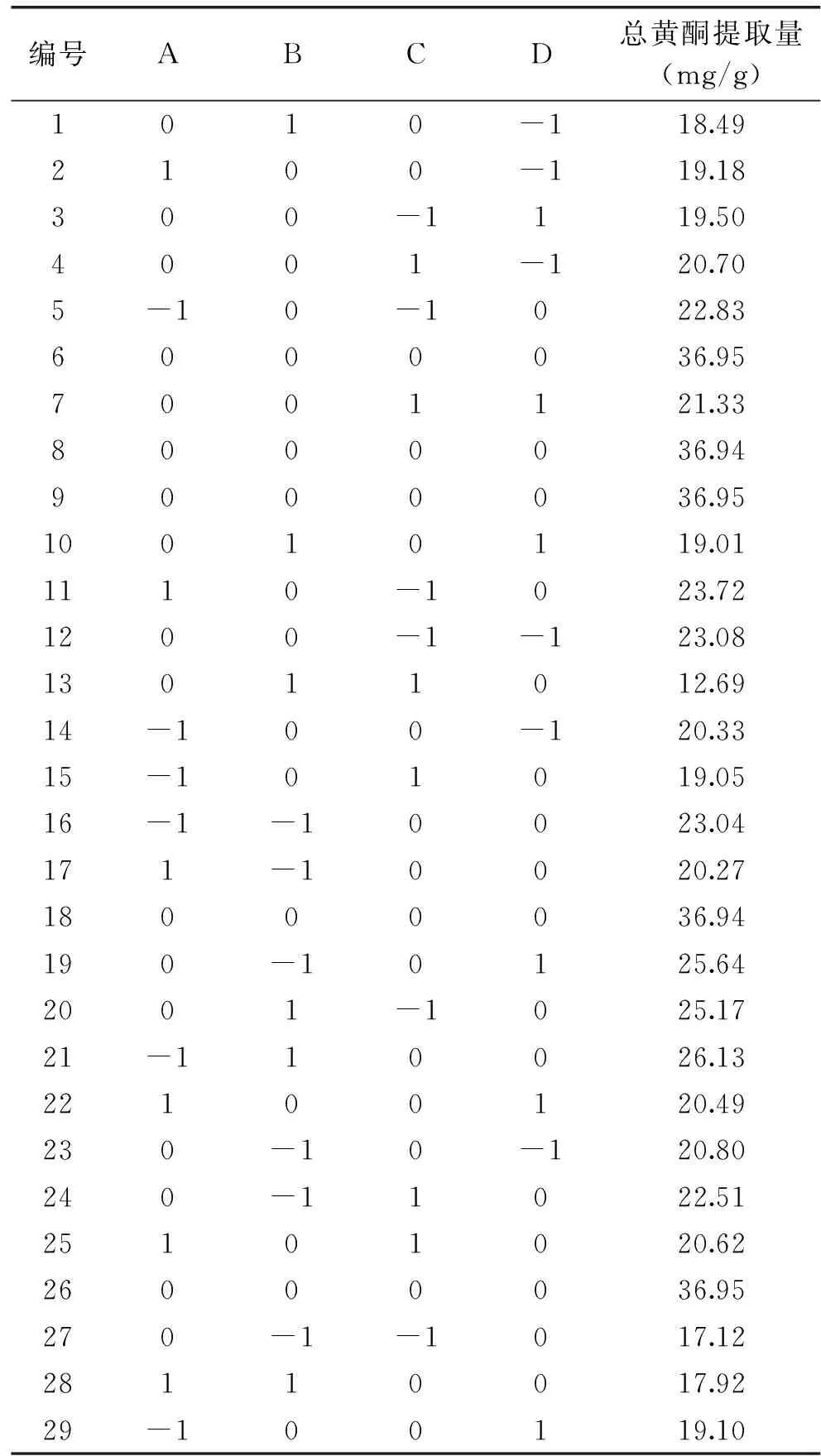
表2 响应面试验结果Table 2 Response surface experiment results and analysis
利用软件对试验结果进行二次多项式回归模型拟合获得如下的回归模型Y=36.94-0.94A-0.82B-1.29C+0.049D-1.36AB-4.47BC-1.06BD+1.3CD-7.88A2-7.98B2-8.17C2-8.62D2
式中:Y为无花果总黄酮提取量。


表3 回归模型分析Table 3 Regression model analysis
由四个自变量的F值可以得出各因素对无花果总黄酮提取量的影响顺序为提取电压>液料比>乙醇体积分数>提取时间,提取时间对无花果总黄酮提取量有较大的影响,模型一次项B、C,二次项A2、B2、C2、D2以及交互项AB、BC对指标影响极显著(P<0.01),一次项A对指标影响显著(P<0.05),而一次项D,交互项BD、CD对指标影响不显著(P>0.05)。
2.2.2 响应曲面分析 通过多元回归模型,进行两因素交互分析,可以得到两因素对类黄酮提取量的影响的响应面及等高线图,如图5。

图5 提取参数显著性交互作用对无花果总黄酮提取量的响应面曲面图Fig.5 Response surface plots of the significant interactionson the yields of fig total flavonoids
对于响应面来说,三维图曲面越陡峭说明这两个因素对于因变量影响就越大,而曲面越平缓,说明这两种因素对于因变量的影响就越小。如图5所示,在有交互作用的影响下,乙醇体积分数和提取电压、液料比和提取电压的曲面比较陡峭,说明这些因素对于无花果黄酮提取量影响较大。
2.3 最佳提取条件的确定及验证
软件分析结果显示,无花果总黄酮的最佳提取工艺条件为:乙醇体积分数49.44%,提取电压149.29 V,液料比49.83∶1 mL/g,提取时间81.04 s。考虑实际实验操作因素,可将实验条件调整为:乙醇体积分数50%,提取电压150 V,液料比50∶1 mL/g,提取时间80 s。无花果总黄酮提取量的实际实验值为(36.94±0.02) mg/g,而预测值为36.98 mg/g,预测误差仅为0.103%,小于3%,因此证实了预测值的准确性。
2.4 无花果总黄酮体外抗氧化活性研究
2.4.1 无花果总黄酮对DPPH自由基清除作用 在无花果总黄酮提取液浓度为(0.03~0.08 mg/mL)范围内,随着浓度的增加,黄酮对DPPH自由基的清除能力呈上升趋势。在浓度为(0.08~0.14 mg/mL)时其清除能力随着浓度的增加而缓慢增加,当浓度到达0.14 mg/mL时,无花果总黄酮对于DPPH溶液的清除率高达98.79%,此后清除率基本不变。由此可知无花果总黄酮对DPPH自由基具有很好的清除能力且具优于相同浓度的对照(抗坏血酸)(图6)。

图6 无花果总黄酮对DPPH自由基清除作用Fig.6 Determination of DPPH free radicalscavenging rate of figs total flavones
2.4.2 无花果总黄酮对OH自由基清除作用 随着无花果总黄酮的浓度从0.03 mg/mL提升到0.10 mg/mL时,对OH自由基的清除能力呈现上升趋势。当总黄酮浓度达到0.10 mg/mL后,进一步增大总黄酮浓度,清除率继续提高但趋势变缓,当浓度达到0.30 mg/mL时,对OH自由基的清除率高达95.2%,表明无花果总黄酮具有较好的清除OH自由基的能力,且均高于相同浓度的对照(抗坏血酸)(图7)。并计算得到无花果总黄酮IC50=0.098 mg/mL,抗坏血酸的IC50=0.159 mg/mL,说明在同等浓度下无花果总黄酮对于OH自由基的清除效果较好。这是由于无花果总黄酮中某些成分与OH自由基进行结合,同时还阻止了Fenton反应的发生[2]。

图7 无花果总黄酮对OH自由基清除作用Fig.7 Determination of OH free radicalscavenging rate of figs total flavones
2.4.3 无花果总黄酮对ABTS+自由基清除作用 在(0.03~0.14 mg/mL)浓度范围内,随着无花果总黄酮浓度的提升,ABTS+自由基的清除率在不断提高,当总黄酮浓度达到0.14 mg/mL时,进一步增大总黄酮浓度,清除率继续提高但趋势变缓。当浓度为0.30 mg/mL时,ABTS+·清除率达到79.8%,表明无花果总黄酮有较好的清除ABTS+自由基的能力,但低于相同浓度的抗坏血酸对照(ABTS+自由基清除率为93%)(图8),说明在相同浓度条件下抗坏血酸对于ABTS自由基的清除效果较好。

图8 无花果总黄酮对ABTS+自由基清除作用Fig.8 Determination of ABTS+ free radicalscavenging rate of figs total flavones
3 讨论与结论
本实验在单因素实验的基础上,通过响应面建立了无花果提取工艺的二次项回归方程,该模型显著性良好,所得的方程拟合度高。最终确定的最佳提取方案条件为:提取电压150 V,提取时间80 s,液料比50∶1 mL/g,乙醇体积分数50%,并且最终提取量高达(36.94±0.02) mg/g。无花果总黄酮的提取量比文献[8]和[9]分别提高了76.84%、47.53%。可能是提取方法不同,闪式提取法更有利于黄酮的充分溶解;也可能与产地有较大的关系,具体新疆无花果与别的地区所产无花果的总黄酮提取量和抗氧化性能有何差异,还待进一步研究。
抗氧化实验结果显示无花果总黄酮具有较好的抗氧化活性,与对照抗坏血酸相比,其对DPPH自由基和OH自由基清除效果更好,而对于ABTS+自由基的清除效果弱于抗坏血酸。人体内过量的自由基会导致炎症、肿瘤等健康问题[33],相关结果表明无花果总黄酮具有应用在抗氧化功能性食品、药品上的潜能。

