miRNAs调控骨关节炎软骨细胞自噬的研究进展
辛艺 李新志 周游
三峡大学附属仁和医院(湖北宜昌443001)
骨关节炎是一种多发于老年人的慢性退行性关节病,其特点是关节软骨受损和关节功能丧失,表现为关节疼痛、肿胀和活动受限,其病理特征包括关节软骨细胞减少、软骨下骨硬化、滑膜炎和软骨基质降解等[1,2],主要与性别、年龄、肥胖、关节损伤、机械性压力、遗传等因素有关[3-5]。自噬是细胞中一种自我保护的动态回收机制,通过降解受损或功能失调的细胞器或大分子来回收生物合成的原材料,循环利用,以实现某些细胞器的更新和细胞本身新陈代谢需要[6]。近年来研究发现骨关节炎的发生和发展与软骨细胞自噬相关基因(autophagy associated gene,ATG)异常表达和自噬功能障碍密切相关[7,8]。自噬抑制被认为与骨关节炎软骨退变和软骨细胞凋亡有关。软骨细胞自噬由于具有保护和抗凋亡的功能[9,10],逐渐成为近年来骨关节炎研究的热点。miRNAs 是一类内源性的非编码单链RNA 分子,大约由22 个核苷酸组成。miRNAs 作为基因表达的重要调节因子,通过与特定的mRNAs 的3'-非翻译区(3’-untranslated region,3’-UTR)互补结合,降解mRNA 靶基因或诱导翻译沉默,介导生物过程中蛋白编码基因的转录后调控。很多研究分析了miRNAs 在骨关节炎中的功能和机制,并证实了miRNAs可以调节骨关节炎软骨细胞的自噬[11-13]。
本文就近些年来参与自噬调控的miRNAs 在骨关节炎软骨细胞自噬中的作用及机制做一综述,以引起对潜在机制的探索,提高对自噬中miRNAs调控网络的认识,为后期研究提供参考。
1 自噬及其调控机制
自噬是真核细胞中一个动态的、连续的、由溶酶体介导的胞内蛋白的降解过程,主要包括以下几个过程:诱导、成核、延伸、成熟、融合和降解。双层膜结构自噬体的形成是细胞自噬的关键。ATGs 在自噬体的形成过程中除了编码蛋白外,还调控整个自噬过程,这也是自噬体活动的最重要的形态学特点。
自噬过程中涉及许多必要的信号通路,其中PI3K/AKT/mTOR 信号通路最为人熟知,是自噬过程中的主要调控因子。雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,是多种信号(氨基酸、ATP 或DNA 损伤)的感受器,作为自噬起点的门户分子,在自噬过程中发挥门户作用。mTOR 可以与Raptor 或Rictor 偶联,形成mTOR复合物1(mTORC1)或mTOR 复合物2(mTORC2),两者都能够调控自噬[14]的过程。在哺乳动物细胞中,自噬起始于形成一个unc-51 样激酶(uncoordinated 51-like kinase,ULK)复合物,该复合物由ULK1/2、ATG13、ATG101、局部粘着斑激酶(Focal Adhesion Kinase,FAK)和FAK家族激酶相互作用蛋白(FAK-family kinase interacting protein of 200 kDa,FIP200)组成,由Ⅲ型磷脂酰肌醇3-激酶/ 丝氨酸/苏氨酸激酶(phosphatidylinositol 3-kinase/Protein Kinase B,PI3K/AKT)通路激活的上游信号诱导,结合的mTOR 和ULK1/2蛋白解离,激活该复合体内各类ATG的磷酸化/去磷酸化,启动细胞自噬[15]。mTORC1可以整合上游信号,通过结合ULK 复合物进一步抑制自噬。随后形成PI3K 复合物,该复合物由Ⅲ类PI3K、Beclin1、ATG14L、p150 等一系列相关调节剂组成,介导自噬体的成核过程,促进自噬体磷脂双分子膜的形成与延伸。其中,自噬关键蛋白Beclin1有助于招募并激活各类膜分子,包括Bax 相互作用因子1(bax-interacting factor-1,Bif-1)、紫外线照射耐受相关基因(ultraviolet resistance-associated gene,UVRAG)、Beclin1 调节的自噬激活分子(Autophagy/Beclin 1regulator 1,Ambra1)、Rubicon 蛋白[16]和B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)[17]。最后在膜上形成泛素样蛋白偶联系统,用于被溶酶体识别。ATG12 和微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)作为泛素样蛋白分子,在自噬体的延伸和成熟过程中是必需的[16]。ATG16L1-ATG12-ATG5 复合物是由ATG12、ATG7、ATG10、ATG5、ATG16L1 等多个ATG 连续偶联而成。当LC3 首先被ATG4B 裂解成胞质形式(LC3-I)时,LC3-I 依次与ATG7、ATG3、磷脂酰乙醇胺(PE)结合,形成一种称为LC3-II 的脂质形式。在此过程中,ATG16L1-ATG12-ATG5 复合物对LC3 完成后续的组装至关重要。另外两个重要的结构是跨膜蛋白ATG9和液泡膜蛋白1(vacuole membrane protein 1,VMP1),直接参与复杂装配[16]外的延伸和成熟过程。成熟的自噬体与溶酶体融合完成后,形成自噬溶酶体并降解细胞内容物。
此外,腺苷酸激活的蛋白激酶(AMP-actived protein kinase,AMPK)是一种高度保守的蛋白质,是代谢和能量感受器,直接促进自噬,使软骨细胞不退变。在ATP/AMP 比值较低的情况下,AMPK 能够激活ULK1[18]。同时,肝激酶B1(liver kinase B1,LKB1)/AMPK信号通路也能够通过磷酸化Raptor成分和中间因子结节性硬化复合体1/2(TSC1/2)[19]抑制mTORC1活性,进而诱导自噬。沉默信息调节因子1(Sirtuin-1 ,SIRT1)被认为是一种延长因子,介导衰老和自噬的进程。已有研究表明SIRT1 在AMPK 和mTOR 通路调节中的级联反应[20,21]。此外,由于SIRT1 去乙酰化酶活性,可以通过增加LC3-II[22]水平,保护软骨细胞免受氧化应激介导的死亡,也可以干扰乙酰化p53 和下游基因,包括Bax 和Bcl-2[23,24]。事实上,已有研究阐明了骨关节炎的致病机制,即软骨细胞中mTOR 的激活和自噬的抑制[25,26]。
2 软骨细胞自噬中的miRNA
miRNA 由于其靶基因的广泛性而成为骨关节炎发病的关键因素。通过靶向特定的ATGs、信号通路或其他相关蛋白,以及介导软骨内稳态的干预,越来越多的miRNA 被认为可以调节软骨细胞自噬的不同过程,见表1。
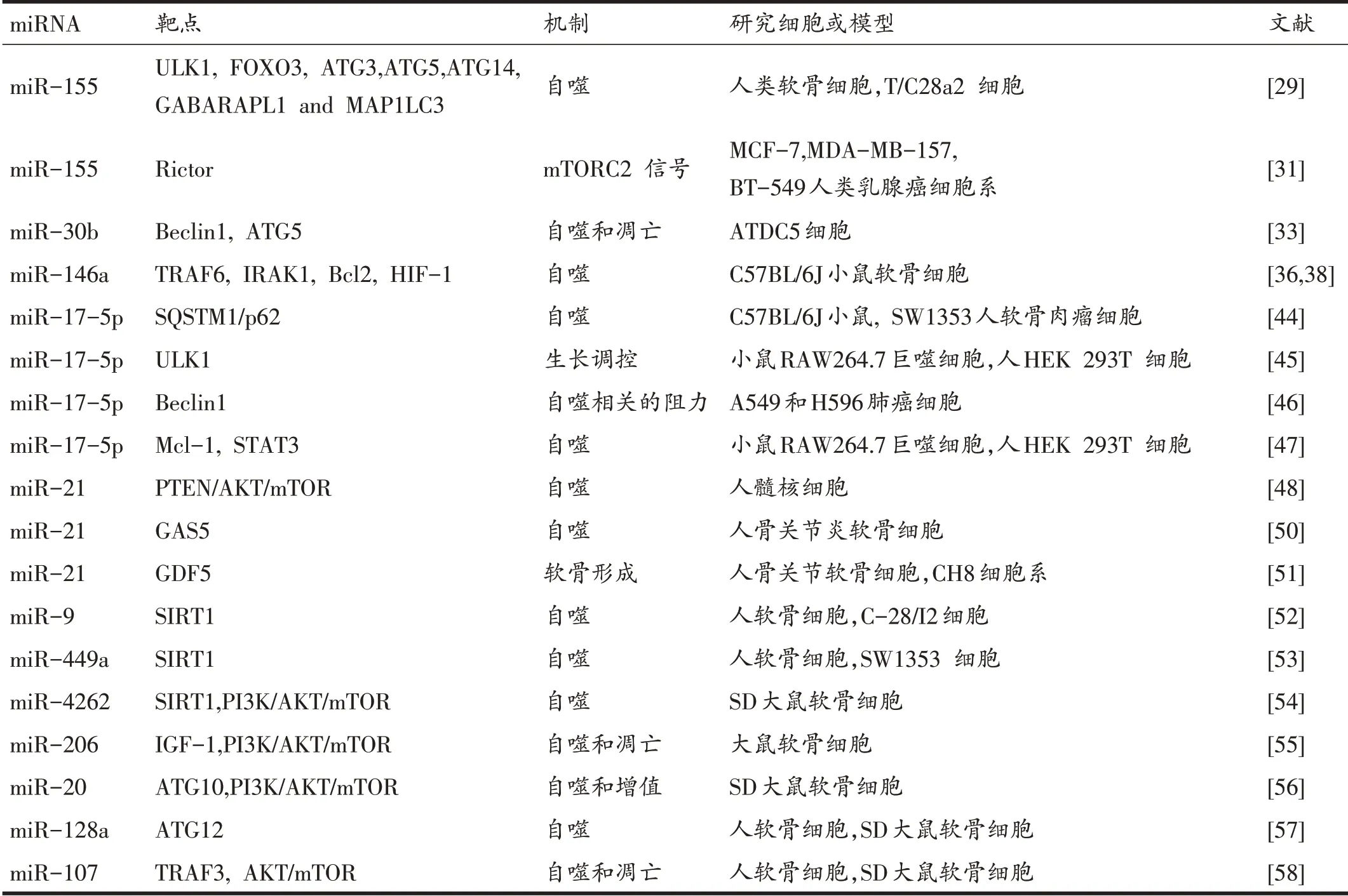
表1 骨关节炎软骨细胞自噬过程中的miRNA及其靶点
2.1 miR-155
综合组学分析发现miR-155在骨关节炎软骨中高度上调[27]。另有研究结果发现,miR-155通过mTOR信号诱导自噬[28],基于此,研究人员开展了探索人类软骨细胞自噬机制的研究并证实miR-155确实通过靶向调节ULK1、FOXO3、ATG3、ATG5、ATG14、GABA A 型受体相关蛋白(Gamma-Aminobutyric Acid Receptor-Associated Protein-Like 1,GABARAPL1)[29]等ATGs,还显著抑制这些ATGs的mRNA和蛋白水平,从而参与下调自噬,而沉默miR-155则显示出相反的作用。同时,miR-155的过表达也降低了LC3-I的转化率,从而影响自噬体的延伸和成熟。然而,通过miR-155抑制mTOR活性并不能下调软骨细胞自噬,可能是因为抑制mTOR活性是通过mTORC2 的重要组成部分Rictor[30]实现的,Rictor可能是miR-155的靶点之一,能够磷酸化AKT并激活mTORC1[31]。
2.2 miR-30b
miR-30 家族在自噬中表现出特殊的作用。据报道,miR-30a、miR-30b、miR-30c、miR-30d、miR-30e等家族成员可直接与Beclin1的3-UTR结合,并对噬菌体成核[32]有很大影响。在所有家族成员中,miR-30b在调节软骨细胞自噬方面最为突出。Chen 等[33]通过TNFα、3-甲基腺嘌呤和雷帕霉素在ATDC5 细胞中构建了自噬的分化模型,证实了以miR-30b 为靶点的Beclin1和ATG5的相互作用。与miR-30b过表达相反,其抑制作用最终导致自噬上调,并抑制细胞凋亡和软骨降解。总之,miR-30b 被认为是可以维持TNF-α诱导的自噬与凋亡平衡的关键因素。Song等[34]进行的另一项研究明确了通过PI3K/AKT/MTOR 抑制软骨细胞自噬与Beclin1表达下降密切相关,与骨关节炎进展密切相关。这表明可能存在一种由miR-30b启动的潜在信号通路,其具体机制在骨关节炎软骨中尚不清楚。
2.3 miR-146a
Li等[35]发现了在软骨细胞凋亡中miR-146a的诱导作用。进一步研究发现,在体外模拟对骨关节炎软骨细胞的机械压力,发现当受到机械性损伤时miR-146a可以靶向作用于Smad4[11]。尽管如此,Smad4被认为与软骨细胞自噬无关,而靶基因肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6)和白介素受体相关激酶1(Interleukin-1 receptor-associated kinase 1,IRAK1)与自噬密切相关[36]。TRAF6 是一种泛素连接酶,在细胞信号传输中发挥作用。激活的TRAF6 可与磷酸化的IRAK1 结合并启动NF-κB 信号通路,在骨关节炎软骨降解过程中介导炎症性细胞因子和炎症反应[37]。Zhang 等[38]研究者证实了TRAF6和IRAK1是miR-146a的直接靶点,是在低氧诱导软骨细胞自噬[37]中调控Bcl-2的中间因子。低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的诱导作用应该得到重视。在OA和正常软骨中都可以检测到HIF-1,其表达水平可能受到初级细胞因子或生长因子的影响[39]。Beclin1/Bcl-2调制[40]、AMPK 激活和mTOR 抑制[41]都与HIF-1 诱导的自噬有关。在低氧状态下,阻断HIF-1后,未观察到miR-146a增加[38]。一般来说,HIF-1作为上游位点,直接靶向作用于miR-146a,调节下游基因并诱导软骨细胞自噬。
2.4 miR-17-5p
miR-17-5p 是miR-17-92 簇的成员之一,对生长和骨骼发育至关重要[42]。近些年来,miR-17-5p在自噬过程中受到越来越多的关注。固位体1(Sequestosome-1,SQSTM1)作为一种选择性自噬适应蛋白,在泛素介导的蛋白降解中起着重要作用。由于自噬过程中的泛素化途径,已有研究报道p62的表达降低[43]。最近研究表明,miR-17-5p通过p62促进人软骨肉瘤细胞的自噬[44]。在细胞实验中,miR-17-5p的过度表达抑制p62的表达并增加LC3 点,从而激活自噬。另有研究人员也观察到骨关节炎小鼠膝关节中LC3斑点降低,p62蛋白水平升高[44]。基于此,我们推测,人骨关节炎软骨中的miR-17-5p和自噬水平可能都较低。在其他非骨关节炎研究中发现一些ATG 与miR-17-5p 相关,如ULK1[45]、Beclin1[46]和髓细胞白血病蛋白-1(myeloid cell leukemin-1,mcl-1)[47]。
2.5 miR-21
已有研究报道在髓核细胞[48]中miR-21 对自噬的抑制作用,以及miR-21 在软骨中有差异表达[49],但miR-21在软骨细胞中的研究进展甚微。Song等[50]研究发现,与正常细胞相比,骨关节炎中miR-21表达降低,抑制miR-21导致ATGs和LC3B下调。此外,他们还发现生长阻滞剂特异性转录5(growth arrest-special transcript 5,GAS5)在软骨细胞自噬抑制中的关键作用。GAS5 属于长链非编码RNA(long non - coding RNAs,lncRNAs),作为海绵与一系列miRNAs结合,阻断了miRNAs与mRNA之间的相互作用。外源性GAS5的诱导能够降低miR-21 的表达,导致Beclin1、ATG7、LC3B的下调,表明自噬[50]水平下降。Zhang等[51]证实了生长分化因子5 (growth diferentiation factor 5,GDF5)是miR-21在软骨细胞中潜在的下游靶点,并且miR-21 在骨关节炎软骨细胞中过表达,但是,它们在自噬过程中的靶向性联系尚不清楚。关于miR-21 的高表达,Zhang 等人与Song 等人研究相矛盾,不同的组织来源和OA分期导致了这种分化。前者比较OA软骨标本与创伤性截肢者软骨标本,后者比较股骨髁和胫骨平台软骨标本,采用相对正常的OA概念。
2.6 其他miRNAs
除了上述已被深入研究的miRNAs 外,一些新型miRNAs逐渐被关注。miR-9[52]和miR-449a[53]可以直接靶向作用于SIRT1,SIRT1 对软骨细胞具有保护作用并调节自噬。miR-4262 过表达可抑制SIRT1,激活PI3K/AKT/mTOR,最终降低软骨细胞自噬,诱导骨关节炎发生发展[54]。miR-206 靶向作用于胰岛素样生长因子-1(insulin-like growth factors -1,IGF-1),通过PI3K/AKT/mTOR 通路负调控自噬过程[55]。miR-20[56]在PI3K/AKT/mTOR 通路中的机制与miR- 206 相似。此外,miR-20 还可以靶向调控ATG10 进而抑制自噬。miR-128a靶向调控ATG12[57]影响自噬的延伸过程进而触发自噬终止。Zhao等[58]在骨关节炎模型中发现miR-107是自噬的启动子,在miR-107过表达时miR-107可以靶向作用于TRAF3和抑制AKT/mTOR活化。
3 结论和展望
在软骨细胞自噬过程中,miRNAs调控的体内平衡紊乱是骨关节炎进展的一个关键机制。尽管已经取得了一些成果,但对miRNA 在自噬中的干预作用的理解仍处于起步阶段。在ATGs不断被识别的情况下,在不久的将来,我们将探索ATGs 和其他具有潜在作用的miRNA。随着生物信息学预测的日益普及,在miRNA、靶基因和信号通路之间形成了一个巨大的自噬调控网络。独立的一对多或多对一的靶向关系和特异的串扰现象在干扰软骨细胞自噬过程中起着至关重要的作用。此外,竞争性内源性RNA理论揭示了lncRNA或环状RNA上游调控通路的存在,为miRNA研究开辟了新的领域。参考近期研究,许多lncRNA可以通过调节自噬直接参与骨关节炎进展[59,60]。与这些结果相比,目前还没有关于骨关节炎软骨细胞中环状RNA 的明确或类似的报道。为了更全面地了解软骨细胞的自噬,迫切需要对环状RNA 及其靶向miRNA 进行研究。在维持自噬的治疗中,miRNAs的基因干扰已成为一个有希望和必要的方向。在体外和体内模型中都对几种已知的miRNA 进行了干预,如miR-206 inhibitor 和miR-128a反义寡核苷酸[5,64],最终实现满意的自噬恢复和软骨细胞存活。然而,自噬并不是决定软骨细胞命运的唯一因素。OA 进展是整体性的,与软骨细胞自噬、凋亡和衰老密切相关,其中miRNA 可能同时参与。考虑到miRNA 的多靶点特性,单一的功能研究似乎无法阐明复杂的自噬网络。在临床应用基因调控自噬技术之前,需要对miRNA 调控的软骨细胞功能进行全面的研究。

