有氧运动干预父系C57BL/6小鼠对雄性子代IGF-1表达及其甲基化的影响
黄嵩 王巍 牛燕媚 傅力,
1 天津医科大学生理学与病理生理学系(天津300070)
2 天津市天津医院康复科(天津300210)
3 天津医科大学医学技术学院康复医学系(天津300070)
有氧运动在促进骨骼肌代谢及重塑中发挥重要作用,研究发现长期有氧运动通过增强蛋白质合成而加快修复受损的骨骼肌[1]。此外,有氧运动能明显降低体脂含量并改善机体脂质代谢[2]。但是有氧运动作用于何种内分泌因子增加骨骼肌合成代谢并降低机体脂肪含量,目前尚不清楚。胰岛素样生长因子1(insulinlike growth factor 1,IGF-1)是一种具有促生长作用的内分泌性多肽类物质,肝脏产生的IGF-1 是血液循环中的主要来源[3]。研究发现,IGF-1能增加骨骼肌细胞蛋白质合成、加快肌纤维生长、刺激肌纤维增殖分化,这对骨骼肌重塑及损伤修复有促进作用[4]。在基因层面上,IGF-1存在6个外显子和5个内含子,其第5外显子选择性转录,另外IGF-1 含有2 个启动子,分别是启动子1 (promoter 1,P1) 和启动子2 (promoter 2,P2),其3’端含有多个转录终止位点,因此,IGF-1能编码多种IGF-1基因转录子[5]。IGF-1启动子和蛋白编码区含有多个CG位点,它们能发生不同的甲基化修饰。所谓DNA 甲基化是指在DNA 甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5’碳位共价键结合一个甲基基团。大量研究表明,DNA 甲基化能引起染色质结构、DNA 构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而抑制基因表达[6]。此外,运动能引起体内多种基因的甲基化水平发生改变,这当中的许多基因参与代谢和机体能量利用,提示运动通过影响基因的甲基化水平而调控机体能量代谢[7]。但是,迄今关于运动能否影响IGF-1的启动子甲基化水平则尚无定论。
流行病学数据发现,亲代所处的生活环境和生活习惯能对后代健康产生影响[8]。高脂饮食能改变大鼠后代胰岛β细胞DNA甲基化修饰从而引发后代产生肥胖和胰岛素抵抗[9]。低蛋白饲料喂养的雄性小鼠,其雄性子代肝脏中参与脂质、胆固醇合成的有关基因表达增加[10]。这些均提示父源性(F0)的生活习惯可影响子代生长发育,但是有关运动干预父系小鼠对子代健康的影响却少有研究。我们的前期研究发现,高脂饮食/有氧运动干预父代C57BL/6 小鼠能影响雄性子代的糖、脂代谢,但该影响仅见于雄性后代[11]。研究发现,性别差异造成的表型差异与X/Y染色体有关,X/Y上的基因表达影响个体对环境的适应和疾病易感性[12]。因此,本研究对父系C57BL/6小鼠进行为期6周的跑台运动干预,检测雄性F1 代小鼠的表型数据及IGF-1 表达和甲基化情况,探究运动干预父系小鼠对雄性子代IGF-1表达及其甲基化的影响。
1 材料与方法
1.1 实验动物分组
8周龄C57BL/6小鼠20只(雌雄各半),购买自北京华阜康生物科技股份有限公司,于天津医科大学实验动物中心饲养配繁,自由饮水,温度20~25°C,湿度40%~60%,12 小时光照。小鼠适应性喂养1 周后,随机选取雌、雄小鼠按1∶1 比例配笼,次日晨检查雌鼠受孕情况,将孕鼠分笼饲养至分娩。新生鼠(F0)母乳喂养21 天后断乳,每窝选取2~3 只雄性小鼠为F0 代运动组(E 组),另2~3 只同窝雄性小鼠为F0 代安静组(C组)。
1.2 运动干预方案
运动组F0 小鼠适应性喂养1 周后,进行6 周跑台运动干预:60 分/次,1次/天,5天/周,6周。在6周运动期间,运动强度均为12 米/分,相当于75% VO2max[13]。安静组F0 小鼠不进行跑台运动,其正常生理、生活活动不予干预。6周跑台干预后,运动组和安静组小鼠分别与同窝未干预的雌性小鼠按1∶1 合笼交配,次日晨检查雌鼠受孕情况,将孕鼠单独喂养至分娩。分娩后的小鼠为F1 代。分别从F0 代安静组与运动组小鼠后代中各选取11~12只F1代雄性小鼠分为安静组(CM)和运动组(EM)作为本实验研究对象。
1.3 小鼠取材及组织保留
F1小鼠自出生21天后断乳分笼,且F1代小鼠均处于与F0 代小鼠相同的饲养环境,正常饮食、自由饮水。不对其进行跑台运动,其正常生理、生活活动不予干预。饲养F1 代小鼠至9 周龄时,将小鼠禁食14~16小时,每组随机取11~12只小鼠,测量体重及体长后,经腹膜下注射水合氯醛溶液麻醉,摘眼球取血,同时立即分离股四头肌组织、肝脏、肾周脂肪、附睾周脂肪,称重后迅速置于液氮中速冻,后转入-80°C 冰箱保存备用。
1.4 ELISA 检测血清IGF-1 水平
各组动物所留血样,静止30 分钟后,4°C 离心(3000 rpm,15 分钟)后提取上清。将0.1 ml 待检血清加于已包被特异抗体的反应孔中,37°C 孵育1 小时后,加入0.1 ml 稀释的酶标抗体,37°C 孵育1 小时,洗涤。在各反应孔中加入0.1 ml 的TMB 底物溶液以显色,37°C孵育10~30分钟。最后在各反应孔中加入2M 硫酸50 μl 以终止反应。检测各孔OD 值,大于规定的阴性对照OD值的2.1倍,即为阳性。
1.5 Real-Time PCR 方法测定肝脏IGF-1 mRNA 的表达
Trizol法提取各组动物肝脏组织中的总RNA后,以总RNA 为模板,用First-Strand Synthesis System for RT-PCR 试剂盒(TaKaRa)来合成cDNA 第一链,按1∶9的比例用H2O稀释合成的cDNA,所得稀释cDNA为Real-time PCR 模板。Real-time PCR 反应按照SYBR Green Real-time PCR Master Mix 试剂盒的说明操作(Roche)。总量25 μl 的反应体系为:Supermix 12.5 μl,5’Primer 0.5μl,3’Primer 0.5 μl,cDNA 0.5 μl,ddH2O 11 μl。IGF-1 反应条件设定为:94°C 高温变性2 min; 然后以94°C 1 min,55°C 30 s,72°C 30 s,共40个循环。所用引物由上海生工生物技术有限公司合成,GAPDH 为内参(见表1)。

表1 Real-Time PCR所用引物
1.6 MeDIP-qPCR 方法检测肝组织中IGF-1 基因启动子甲基化状态
1.6.1 肝脏DNA提取及超声处理
细胞裂解法提取肝脏DNA 后,用超声法剪切DNA,剪切的DNA 长度应在200~1000 bp 之间,14,000 rpm 离心10分钟后提取上清。
1.6.2 DNA 甲基化免疫共沉淀反应(MeDIP)
MeDIP 过程参照文献[14],简述如下:将100 μl 片段DNA上清1∶1稀释后加入抗-5-甲基胞嘧啶抗体,室温下(22~25°C)孵育90~120 分钟,然后加入与磁珠偶联的IgG 抗体室温下孵育60 分钟。Input DNA 离心后取上清150 μl,免疫共沉淀DNA(immunoprecipitation DNA,IP DNA)用洗涤缓冲液清洗6 次后加入150 μl 1X TE 缓冲液溶解。将Input DNA 和IP DNA加入150 μl 90%乙醇,12000 rpm 离心30 秒,重复3次,最后加入溶解缓冲液,离心取上清,以备后续实验。
1.6.3 Real-Time PCR
将上述提取的甲基化DNA 按1∶9 比例用H2O 稀释,所得稀释DNA 作为Real-time PCR 模板。Realtime PCR 反应按照SYBR Green Real-time PCR Master Mix 试剂盒的说明操作(Roche)。反应体系同上所述。启动子1(P1)反应条件设定为:94°C 2 min,94°C 1 min,52°C 30 s,72°C 30 s,40 循环,启动子2(P2)反应条件设定为:94°C 2 min,94°C 1 min,50°C 30 s,72°C 30 s,40 循环。仪器采用 Step one and Step one plus Real-Time PCR Systems(Applied Biosystems)。待测DNA 甲基化状态可以通过Ct 值计算得到。计算公式为:%(MeDNA-IP/Total input)= 2^[(Ct(input)-Ct MeDNA-IP)] ×100。实验所需引物由上海生工生物技术有限公司合成(见表1)。
1.7 Western Blot 检测股四头肌组织与内脏脂肪组织IGF-1与IGF-1R 蛋白表达
NP-40 法提取股四头肌和内脏脂肪组织蛋白:每100 mg 组织加入裂解液500 μl,1×Protease Inhibitor 4 μl 和1× Phosphatase Inhibitor 4 μl,研磨器充分研磨组织,然后于4°C,12000 g 离心40 分钟,取上清,BCA法测定蛋白浓度后转置-80°C冰箱冻存备用。
根据分子量的不同制备不同浓度的分离胶,积层胶均为5%,用微量加样器加入样品孔内等量的总蛋白,并于一侧加样孔内加入预染蛋白Marker 10 μl。使用Tris-甘氨酸SDS 聚丙烯酰胺凝胶电泳缓冲液(250 mmol/L 甘 氨 酸,25 mmol/L Tris-Base,0.1%SDS;pH 7.6),60 V 电压下电泳30 分钟后,再转换成100 V 电压电泳2 小时。采用湿法电转印(转膜缓冲液:39 mmol/L 甘 氨 酸,48 mmol/L Tris- base,0.037% SDS,20% 甲醇;pH 8.3),30 V,2 小时。根据PVDF 膜上预染蛋白Marker 的转移情况,判断蛋白转移情况。转膜结束后,取出PVDF膜,用5%脱脂奶粉封闭1 小时后,用1×TBST 洗涤PVDF 膜,使用含5%BSA的抗体稀释液分别稀释一抗。4°C 孵育过夜。次日用1×TBST 洗膜3 次,每次5 分钟;用5%脱脂奶粉溶液按照1∶10000 稀释二抗,室温孵育1 小时,再用1×TBST洗膜3次,每次5分钟;最后用ECL反应液作为发光底物,于暗室内进行X 光胶片曝光,经显影、定影后观察分析结果。
1.8 统计学方法
所有实验数据由SPSS 统计软件(SPSS13.0 for Windows)处理。采用独立样本t检验(Independentsamplesttest);计算均值和标准差(±s),各组间差异性检验的显著性水平定为P<0.05。
2 结果
2.1 F1 代雄性小鼠生长指标分析
本实验以F1雄性小鼠为对象,检测的表型数据包括:体重、股四头肌湿重、股四头肌湿重/体重比。如表1所示,与CM 组小鼠进行对比,EM 小鼠的体重增加12.76%(CM:15.13± 2.08 g; EM:17.06± 1.37 g,P<0.05),股四头肌重量增加23.50% (CM:0.17±0.02 g; EM:0.21± 0.03 g,P<0.05),股四头肌湿重/体重(×100)增加9.73%(CM:1.13± 0.09; EM:1.24± 0.12,P<0.05),内脏脂肪重量降低21.21%(CM:0.33± 0.05 g; EM:0.26± 0.03 g,P<0.05)。

表1 运动组和对照组F1代雄性小鼠生长指标数据对比
2.2 F1 代雄性小鼠肝脏IGF-1基因的转录调控及表达结果
F1 代雄性小鼠血清中IGF-1 含量检测结果如图1A 所示,EM 组小鼠血清IGF-1 含量较CM 组增加73.15%(CM 组:1316.40± 180.13 ng/ml; EM 组:2279.34± 239.63 ng/ml,P<0.01),表明父系6周有氧运动显著增加子代血清中IGF-1的含量。
F1 代雄性小鼠肝细胞中IGF-1 mRNA 表达结果如图1B 所示,EM 组雄性小鼠肝细胞中IGF-1 mRNA的表达较CM 组增加4.12 倍(P<0.05)。这表明,父系6 周有氧跑台运动显著增加雄性子代肝细胞中IGF-1 mRNA的表达。

图1 F1代雄性小鼠血清IGF-1和肝脏IGF-1 mRNA水平
2.3 肝细胞中IGF-1基因启动子甲基化水平
IGF-1基因含有两个启动子,F1 代小鼠肝细胞中IGF-1 甲基化水平检测结果如图2所示,EM 组小鼠肝细胞中P1、P2 甲基化水平较CM 组分别降低38.78%(P<0.05)和52.80%(P<0.01)。由此可见,父系6 周有氧运动显著降低了雄性子代肝细胞中IGF-1基因启动子甲基化水平。
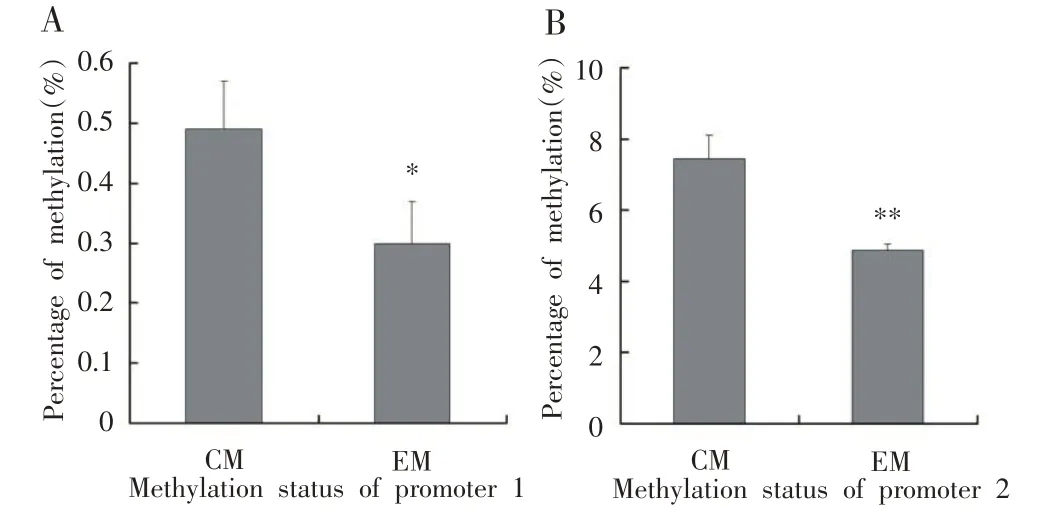
图2 F1代雄性小鼠肝脏IGF-1启动子P1和P2的甲基化水平
2.4 F1代雄性小鼠骨骼肌组织与脂肪组织中IGF-1与IGF-1R蛋白表达水平
F1 代雄性小鼠骨骼肌细胞中IGF-1、IGF-1R 蛋白表达结果如图3所示,EM 组小鼠骨骼肌细胞中IGF-1、IGF-1R 蛋白的表达较CM 组分别增加83.5%和41.2%(P<0.05)。EM 组内脏脂肪细胞中IGF-1、IGF-1R 蛋白的表达与其骨骼肌细胞中的表达变化趋势基本一致。如图4所示,EM组小鼠内脏脂肪组织中IGF-1蛋白表达较CM组升高1.36倍(P<0.05);IGF-1R蛋白表达较CM 组升高87.3%(P<0.05)。上述结果表明,父系6周有氧运动可显著促进子代骨骼肌组织与脂肪组织中IGF-1、IGF-1R蛋白的表达。
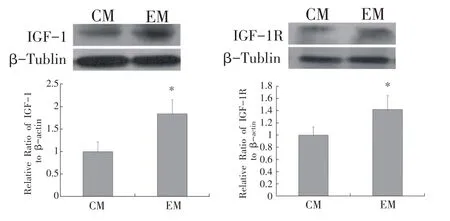
图3 F1代雄性小鼠股四头肌中IGF-1和IGF-1R的蛋白表达水平
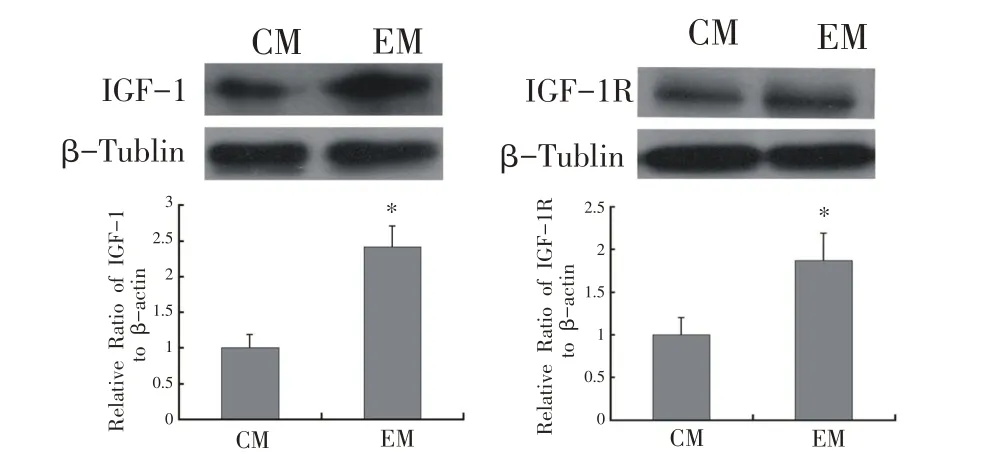
图4 F1代雄性小鼠内脏脂肪中IGF-1和IGF-1R的蛋白表达水平
3 讨论
本研究主要探究父系6周跑台运动对子代雄性小鼠IGF-1 表达及其甲基化的影响,通过有氧运动干预雄性C57BL/6 小鼠,采用生长指标的检测等方法研究其子代(F1)小鼠生长发育的差异,采用分子生物学技术分析子代(F1)小鼠生长发育产生差异的分子机理。本实验结果表明,父系6 周有氧跑台运动可促进子代雄性小鼠体重及股四头肌的增加,并可降低内脏脂肪组织的堆积。在分子层面上,父系6 周有氧跑台运动可降低子代雄性小鼠肝细胞IGF-1基因的甲基化水平,增加子代血清中IGF-1含量及肝细胞IGF-1 的mRNA 水平,并增加子代股四头肌和内脏脂肪组织中IGF-1 和IGF-1R 的蛋白表达水平,提示父系6 周有氧跑台运动通过降低IGF-1 启动子甲基化而增强IGF-1转录及表达,从而促进子代雄性小鼠的生长发育。
3.1 父系6 周有氧跑台运动对子代雄性小鼠生长发育的影响
本实验结果表明,EM组雄性小鼠的体重及股四头肌重量显著高于CM 组,然而其内脏脂肪组织重量却显著低于CM 组(表1)。骨骼肌约占全身重量的40%以上,它不仅在机体运动过程中发挥着重要作用,还在维持机体能量代谢平衡过程中起着关键作用[15]。骨骼肌组织具有高度的可塑性,其生长发育受到多种因素的影响。而规律的有氧运动,不仅可加快机体能量代谢、改善机体糖、脂代谢紊乱,而且还可调控骨骼肌的生长发育。此外,脂肪组织不仅可以储存能量,它还可以分泌多种因子调控机体生长及代谢,内脏脂肪组织可以释放大量细胞因子及游离脂肪酸,其代谢功能更强。研究发现,规律的有氧运动可以有效地促进脂肪酸的分解,降低体脂含量并改善与肥胖相关的代谢性疾病[2]。而我们的前期研究也表明,高脂饮食/有氧运动干预父代C57BL/6 小鼠能影响雄性子代的糖、脂代谢,且该影响仅见于雄性后代[11]。因此,我们的结果提示6周跑台运动通过增加骨骼肌组织重量并降低内脏脂肪组织重量而促进子代雄性小鼠的生长发育。
3.2 父系6 周有氧跑台运动对子代小鼠肝细胞IGF-1转录调控及表达水平的影响
IGF-1是一种由70个氨基酸组成的单链多肽激素蛋白,其结构与胰岛素相似,是一种具有促进生长作用的内分泌因子[3,16]。血液循环系统中的IGF-1主要是由肝细胞产生分泌的,而肝细胞中的IGF-1 是在生长激素(growth hormone,GH)刺激下诱导完成的,GH对机体的作用主要由IGF-1 介导完成,形成GH/IGF-1 轴[17]。骨骼肌等组织也可以自分泌或旁分泌产生IGF-1,但是,组织中的IGF-1 mRNA 表达来自组织细胞本身的基因,与血液循环系统无关。研究发现,IGF-1可通过增加骨骼肌细胞蛋白质合成、加快肌纤维生长、刺激肌纤维增殖分化而促进骨骼肌损伤修复[4]。其他研究也表明,GH 促进骨骼肌的生长是通过肝组织产生IGF-1介导的[18],但是运动是否能调控IGF-1的转录及表达从而调控骨骼肌生长则尚无定论。本研究结果表明,EM 组小鼠血清中IGF-1 含量及肝细胞中IGF-1 的转录水平都显著高于CM 组(图1),这说明父系6 周有氧跑台运动能增加子代雄性小鼠肝脏中IGF-1的转录及表达。另一方面,相比于CM 组,本实验中EM 组小鼠股四头肌重量与湿重比分别增加23.50%、9.73%,内脏脂肪重量降低21.21%。综合EM 组IGF-1 的转录及表达的增加,这提示子代小鼠骨骼肌重量的增加、内脏脂肪组织含量的降低与IGF-1 含量增加密切相关,父系6 周有氧跑台运动能增加子代小鼠IGF-1 的表达水平从而促进子代小鼠骨骼肌的生长。
3.3 父系6 周有氧跑台运动对子代雄性小鼠肝细胞IGF-1基因启动子甲基化水平的影响
基因启动子区的甲基化是DNA 甲基化修饰的重要组成部分,研究发现基因启动子甲基化能引起启动子区与蛋白质相互作用方式的改变,从而影响基因表达[6]。由环境因素和运动干预引起的DNA 甲基化水平的改变可能是代谢及生长发育过程中的一种重要调节因素[7]。IGF-1作为一种调控机体生长的内分泌因子,其基因的转录由两个启动子(P1与P2)调控,虽然运动能影响很多基因的甲基化修饰,但是有关运动能否调控IGF-1 启动子的甲基化却鲜有报道。在本实验中,EM组小鼠肝细胞中P1、P2甲基化水平较CM组分别降低38.78%(P<0.05)和52.80%(P<0.01)(图2),鉴于子代雄性小鼠肝脏中IGF-1的转录和蛋白表达水平增加(图1),这表明父系6周有氧跑台运动通过降低子代雄性小鼠肝脏中IGF-1两个启动子的甲基化水平从而增加了IGF-1基因的表达水平。
3.4 父系6 周有氧跑台运动对子代雄性小鼠骨骼肌与脂肪组织中IGF-1与IGF-1R蛋白表达的影响
如前所述,IGF-1在促进骨骼肌生长及重塑方面有重要作用[4,18]。近年研究也表明,限制饮食后骨骼肌纤维大小降低与IGF-1/IGF-1R 信号通路有关[19]。此外,IGF-1/IGF-1R 信号通路还能调节脂肪细胞分化和体脂沉积,从而改善脂肪代谢[16]。但是关于运动是否能影响骨骼肌与脂肪组织中的IGF-1/IGF-1R 信号通路则不是十分明确。我们的研究结果显示,EM组小鼠其股四头肌和内脏脂肪组织中的IGF-1/IGF-1R 表达均比CM 组显著增高(图3,图4),表明父系6 周跑台运动能增强子代雄性小鼠骨骼肌和脂肪组织中的IGF-1/IGF-1R 信号通路,而EM 组小鼠股四头肌组织重量的增加与内脏脂肪组织重量的下降可能与此有关。
3.5 6 周有氧运动对父代本身的影响通过遗传因素作用于子代
许多研究已经证明[20-23],运动能显著增加IGF-1的基因及蛋白表达水平。Eliakim 等的结果更是表明[21],在同等运动条件下的男性与女性相比,男性血液中IGF-1的表达在运动后显著增加,提示性别对运动影响IGF-1水平的作用。在我们的实验中,考虑到雄性性染色体-Y 染色体在性别遗传中的重要因素并为了探究父系运动对子代的影响,我们选择F1代雄性小鼠作为研究对象。如本研究结果所示,F1 代EM 组小鼠与CM组相比,其肝细胞IGF-1启动子甲基化水平降低从而增加了IGF-1的基因及蛋白表达水平,且EM组小鼠体重及股四头肌重量均显著增加,骨骼肌及脂肪组织中的IGF-1/IGF-1R 信号通路增强,这表明IGF-1 的表达增加促进了F1代EM组小鼠的骨骼肌生长发育。由于F1小鼠自出生后就一直处于安静的条件下饲养,无论EM 组还是CM 组,在其成长的9 周内均未对其进行跑台运动干预。因此EM 组相比CM 组如此显著的表型变化只能是来自于先天遗传物质的改变,即F0代的遗传因素。鉴于运动能直接增加父代IGF-1的表达水平[22],我们的结果表明了F1 代EM 组的表型遗传于F0代E组所受的6周父系有氧运动,性别遗传中的Y染色体遗传在运动介导IGF-1 启动子甲基化水平降低、促进IGF-1基因表达从而促进生长发育方面具有重要作用。
本研究通过探讨6周父系有氧运动对子代雄性小鼠IGF-1甲基化水平及IGF-1表达水平的影响,验证了有氧运动可以通过降低IGF-1 甲基化水平从而促进IGF-1的基因和蛋白表达,进而促进骨骼肌生长并减少内脏脂肪组织的含量,因此本实验解决了运动能否影响IGF-1甲基化水平的问题。而在父系有氧运动介导IGF-1表达过程中,本实验结果表明遗传因素起到了重要作用,父系有氧运动干预通过遗传物质的改变来影响子代的表型,这是本实验的创新之处。然而,本实验也存在不足之处。运动促进机体生长发育的因素十分复杂,除了通过影响IGF-1的表达外,运动还影响许多其他生长因子及信号通路。限于条件有限,本研究仅以IGF-1 为切入点。因此,在未来探究运动影响机体生长发育的研究中,除了关注IGF-1 这个已知的信号通路节点,研究者还应关注其他影响机体生长发育的信号通路,如mTOR 信号通路及AMPK 信号通路等。另一方面,未来探究遗传因素在介导运动促进生长发育的研究中,研究者可以具体从Y染色体的形态变化、基因改变等方面入手去探讨Y染色体如何具体承载父系运动干预对子代的影响,以期在遗传水平上做出深入揭示。
4 结论
在个体水平上,6周有氧运动干预父系小鼠增加了子代雄性小鼠骨骼肌重量,降低内脏脂肪组织重量,促进子代雄性小鼠的生长发育。在分子水平上,6周有氧运动干预父系小鼠增加了子代雄性小鼠骨骼肌、内脏脂肪组织中IGF-1/IGF-1R的蛋白表达,增加了子代雄性小鼠肝脏IGF-1的转录及蛋白表达,但降低了IGF-1启动子的甲基化水平。提示父系6周有氧跑台运动通过降低肝脏IGF-1 的P1、P2 甲基化水平而增加其基因转录及其在骨骼肌、内脏脂肪中的蛋白表达,从而显著促进子代雄性小鼠骨骼肌组织生长并减少其内脏脂肪堆积,从而促进子代雄性小鼠的生长发育。

