白皮杉醇抗肿瘤作用研究进展
王风仙,陈慧茹,解 伟,王 进
1上海中医药大学研究生院,上海 201203;2上海健康医学院药学院,上海 201318;3上海中医药大学,上海 201203
白皮杉醇(piceatannol,PIC)是一种广泛存在于葡萄、甘蔗、百香果、越橘属浆果、大黄、桂皮、白茶树和大戟属植物等多种水果和植物中的多酚类化合物[1],已被证实具有抗氧化、清除自由基、抗菌、抗炎、抗衰老、抗白血病、抗细胞增殖、提高免疫调节能力、心血管保护、防癌、抗癌等生物活性[2-4]。白藜芦醇(resveratrol)是一种具有多种生物活性的有益于人体健康的天然抗氧化剂,白皮杉醇是白藜芦醇的衍生物,白皮杉醇的化学结构具有比白藜芦醇更多的羟基基团,经研究证实白皮杉醇具有比白藜芦醇更高的抗氧化活性[5],同时,白皮杉醇的毒副作用相对较低,不易对机体产生副作用[6]。本文通过查阅白皮杉醇抗肿瘤作用的相关文献,对白皮杉醇抗肿瘤作用及其作用机制等方面进行综述,为其后续药物开发和临床应用提供理论参考依据。
1 白皮杉醇的理化性质
白皮杉醇是二苯乙烯类化合物,除了苯环上3-位碳上连有的单羟基外,化学结构与白藜芦醇相似。Rossi等[7]用X射线衍射分析白皮杉醇和白藜芦醇的晶体结构,指出由于邻位酚羟基的影响使得白皮杉醇的B环含有较强的分子内氢键,认为邻位酚羟基的存在增强了白皮杉醇捕获不成对电子的能力,分子内氢键和离域效应稳定了半醌式白皮杉醇的自由基,使白皮杉醇的活性强于白藜芦醇。白皮杉醇与白藜芦醇相比熔点低、分子量稍高,为灰白色粉末[8],顺反式两种结构均可溶于乙醇和二甲基亚砜(DMSO),不溶于水;而白藜芦醇为白色针状结晶[9],顺反式结构易溶于甲醇、乙醇、氯仿、乙醚等有机溶剂中,难溶于水,在避光和中性 pH 条件下稳定性较好[10]。白皮杉醇和白藜芦醇的分子结构和理化特性分别见表1和图1。

表1 白皮杉醇和白藜芦醇的分子结构和理化特性[11,12]Table 1 Molecular structure and physicochemical properties of piceatannol and resveratrol[11,12]
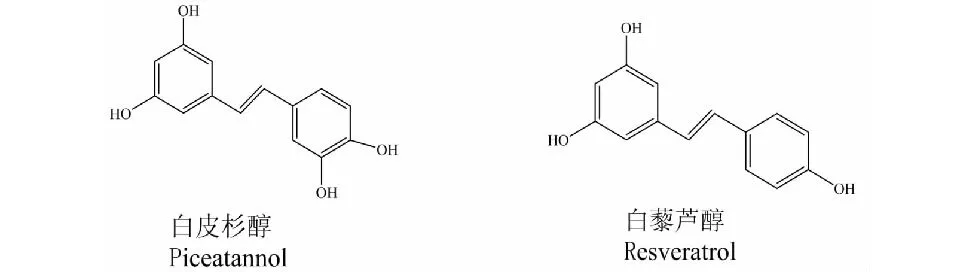
图1 白皮杉醇和白藜芦醇的化学结构Fig.1 The chemical structure of piceatannol and resveratrol
2 白皮杉醇对肿瘤细胞的作用
2.1 前列腺癌
Li等[13]将前列腺癌细胞系DU145细胞经不同浓度的PIC(0、5、10、20、40和80 μmol/L)作用不同的时间(12、24、36和48 h),研究发现,白皮杉醇可抑制前列腺癌细胞株DU145的增殖,随时间延长肿瘤细胞存活率降低;划痕和Transwell侵袭实验结果显示给予药物干预的DU145细胞的迁移和侵袭能力显著低于空白对照组,说明白皮杉醇能够明显抑制DU145细胞的迁移和侵袭能力。白皮杉醇能在信使RNA水平上降低DU145细胞中MMP-9、uPA和VEGF的分泌,使MMP-2的组织抑制剂蛋白水平呈浓度依赖性升高,抑制STAT3的磷酸化,还可以降低表皮生长因子(EGF)诱导的白细胞介素IL-6的分泌,影响前列腺癌细胞DU145 的生长、迁移和侵袭能力,结果表明,白皮杉醇对IL-6/STAT3信号的抑制可能是其调控DU145细胞迁移侵袭相关蛋白表达的机制之一[14]。另有文献报道,白皮杉醇通过抑制CDK的活性,阻断G1细胞周期的发展,抑制前列腺癌DU145细胞的增殖[15];白皮杉醇将前列腺癌细胞AD和AI CaP的细胞周期阻滞在G1/S期、LNCaP和PC-3的细胞周期阻滞在S期而抑制细胞的生长[16],通过增加DU145细胞内caspase-8、caspase-9、caspase-7、caspase-3表达和抑制PARP蛋白的表达量,增加线粒体的通透性使细胞色素C从线粒体向细胞质释放,增加Bid、Bax、Bik、Bok和 Fas蛋白水平,抑制Mcl-1 和Bcl-xL的蛋白水平,表明白皮杉醇可以通过激活caspases通路抑制DU145细胞的生长和诱导其凋亡[17]。Dias等[18]采用5~6周龄的雄性裸鼠灌胃给予50 mg/kg的白皮杉醇,隔两天给药一次,两周后,小鼠接种LNCaP-Luc细胞,再继续给药5周,实验结果发现,白皮杉醇能够有效抑制肿瘤的形成和发展,与对照组相比,经过白皮杉醇治疗后的小鼠血清中促炎细胞因子IL-6明显降低,肿瘤体积明显降低。
2.2 乳腺癌
Ko等[19]发现白皮杉醇能够抑制三阴性乳腺癌细胞株MDA-MA-231的迁移、侵袭和黏附能力,其机制可能与抑制MMP-9的活性、增加PTEN的表达、抑制PI3K/AKT信号通路,阻断NF-κB的激活有关。在人类乳腺癌中Ras基因的突变是不常见的,但在60%~70%的人乳腺癌中发现Ras蛋白的大量增多[20],Song等[21]通过对含有突变的H-Ras基因乳腺表皮细胞株MCF10A的一系列研究表明,白皮杉醇能够抑制H-Ras诱导的MMP-2蛋白表达和AKT的磷酸化活性且其对含有突变的H-Ras基因乳腺表皮细胞株MCF10A的抑制效果强于白藜芦醇;体外激酶测定实验结果表明,白皮杉醇抑制含有突变的H-Ras基因乳腺表皮细胞株MCF10A中PI3K和PIP3的表达,抑制乳腺癌细胞的生长、侵袭和迁移。有研究表明,在乳腺癌Cal51细胞株中通过NF-κB信号通路的激活使PD-L1的表达量上调4.5倍,白皮杉醇或白藜芦醇与抗PD-L1免疫抑制剂联合用药之后能有效的阻断PD-1/PD-L1相互作用,避免肿瘤细胞发生免疫逃逸,起到治疗肿瘤的效果[22]。Song等[23]将4T1乳腺癌细胞注射到同系雌性BALB/c小鼠的乳房脂肪垫中,一天后以每天10和20 mg/kg灌胃给药30天,研究发现,白皮杉醇可降低肿瘤组织中转录因子P-NFκB p65、P-STAT3和HIF-1α的表达以及多种参与细胞周期进程调节的蛋白(Ki67、Cyclin D1、Cyclin A、CDK2、CDK4),血管生成因子(VEGF-A、VEGFR-2、VE-cadherin、CD31)和淋巴管生成因子(VEGF-C、LYVE-1)以及巨噬细胞浸润,白皮杉醇显著增加肿瘤组织中的凋亡细胞以及Bax的表达,降低了肿瘤组织中Bcl-2的表达;体外实验显示白皮杉醇能抑制乳腺癌4T1细胞和单核细胞的迁移,抑制MCP-1和M-CSF的分泌,结果表明,肿瘤微环境的改变(巨噬细胞、转录因子等)是白皮杉醇抑制肿瘤增殖,血管生成和淋巴管生成的重要机制,从而抑制了乳腺肿瘤的生长和转移。
2.3 结直肠癌
对于结直肠癌细胞,有研究表明白皮杉醇能够影响结直肠癌Caco-2细胞株的生长、增殖、分化及细胞周期的分布,白皮杉醇对Caco-2和HCT-116细胞的生长呈剂量依赖的关系,Caco-2细胞在药物200 μmol/L下作用24 h,细胞增殖率约为83.7%±2.9%,72h后细胞增殖率约为60.0%±3.2%,HCT-116细胞在药物200 μmol/L下作用72 h后细胞增殖率约为58.3%±3.1%。细胞周期实验结果分析可得,在HCT-116细胞中,正常细胞的周期分布分别为G0/G1 占36.39%±0.74%,S 占46.53%±0.65%,G2/M占17.09%±1.38%,药物浓度100 μmol/L作用24 h后,G0/G1占13.33%±0.22%,S 占76.23%±0.82%,G2/M 占10.44%±1.03%,白皮杉醇可将细胞周期阻滞在S期;除此之外,白皮杉醇抑制Cyclin D1、Cyclin B1和CDK4的表达,降低了p27Kip1的积累[24]。白皮杉醇可以将结直肠癌细胞SW620抑制在G2/M期促进细胞凋亡,使S期的细胞积累可能于PD-L1的表达有关,上述研究提示,白皮杉醇可能具有双重作用机制:一是诱导PD-L1,使肿瘤细胞对抗PD-L1抗体的识别变得敏感;另一种是可以减少癌细胞逃避免疫监视的效果,通过诱导凋亡直接诱导细胞周期阻滞、DNA损伤增加和破坏癌细胞[22]。白皮杉醇通过促进结直肠癌细胞HCT116和HT29中的miR-129的表达,然后抑制Bcl-2的表达从而诱导肿瘤细胞的凋亡[25]。
2.4 白血病
研究表明,白皮杉醇能够诱导Fas和FasL的上调,促进mRNA的转录,下调XIAP的表达来诱导白血病细胞系的凋亡[9];Siedlecka等[26]发现白皮杉醇通过使细胞内LC3-II蛋白水平升高和p62/SQSTM1蛋白水平降低激活白血病MOLT-4细胞中的自噬,通过磷脂酰丝氨酸外在化,caspase-3激活,线粒体膜电位破坏,核小体DNA片段化,PARP1裂解,染色质浓缩和细胞核片段化诱导MOLT-4细胞的凋亡,MOLT-4细胞在长时间暴露于白皮杉醇后,发现白皮杉醇对MOLT-4细胞产生的毒性作用减弱,所以白皮杉醇有可能成为潜在的治疗白血病化学治疗剂。也有报道表明白皮杉醇通过下调抗凋亡基因Bcl-2和cIAP-2的表达,使caspase通路激活,从而诱导细胞的凋亡[27],对于白血病HL-60细胞,白皮杉醇也能够诱导其凋亡,并呈剂量和时间依赖性关系[28]。
2.5 肝癌
不同浓度的白皮杉醇对肝癌细胞通过不同的代谢方式影响细胞的增殖作用,Kita等[29]报道,当白皮杉醇浓度在25~50 μmol/L之间时能够将肝癌AH109A细胞株的细胞周期阻滞在G2/M期,从而抑制肿瘤细胞的生长,当白皮杉醇浓度在100 μmol/L时,通过促进细胞的凋亡抑制肿瘤细胞的生长。
2.6 黑色素瘤
白皮杉醇在1、5和10 μmol/L作用8 h时,对黑色素瘤细胞的活性没有明显的抑制作用,100 μmol/L时增加作用时间大于8 h后对细胞活性产生明显的抑制作用,且能将Sk-Mel-28细胞阻滞在G2/M期,降低G0/G1和S期的细胞数量,随着白皮杉醇浓度和作用时间的增加,Cyclins A、Cyclins E 和Cyclins B1的表达水平下调,诱导肿瘤细胞的凋亡[30]。Du等[31]研究发现,microRNA-181a在白皮杉醇处理的细胞中的表达水平明显高于正常对照组,在黑色素瘤癌组织中的表达水平低于邻近正常组织,Bcl-2是miR-181a的靶基因,所以白皮杉醇处理后microRNA-181a表达增加,促进Bcl-2的表达,诱导黑色素瘤细胞的凋亡。
2.7 其他
研究发现,白皮杉醇对人骨髓瘤细胞OPM-2、U-266、RPMI-8226、MPC-11细胞的IC50值分别是33、32、24、33 μmol/L,对正常细胞CCD-18Co的IC50值超过60 μmol/L,浓度在60 μmol/L时对正常细胞CCD-18Co没有影响[32]。白皮杉醇和顺铂联用可有效增强对喉癌细胞的杀伤作用有关[33]。白皮杉醇和吉西他滨联用能够有效增强吉西他滨对肺癌A549、NSCLC细胞株的细胞毒性和凋亡作用[34]。研究表明,白皮杉醇能够增强p53介导的促凋亡蛋白NOXA的表达,通过泛素-蛋白酶途径增加XIAP降解,增强caspase-3的激活,白皮杉醇和顺铂联用之后能够通过对P53、XIAP和线粒体裂变的影响增强顺铂对卵巢癌的敏感性[35]。白皮杉醇对U2OS细胞的IC50约为46.97 μmol/L,可下调细胞周期依赖性调节蛋白CyclinB、CDC2和CDK3,阻碍调控G2期蛋白复合物的形成,使细胞周期阻滞在G2/M期,抑制蛋白激酶B的活性,活化caspase及其家族相关蛋白,激活p53基因,活化P53通道相关蛋白,促进Bcl-2抑制Bax等蛋白表达,诱导细胞凋亡,发挥其抑癌作用[36]。有研究发现,用壳聚糖/聚乳酸包埋的白皮杉醇纳米粒对肝癌、肺癌和乳腺癌细胞也均具有体外凋亡活性,促进肿瘤细胞的凋亡,从而导致癌细胞存活率下降[37]。人类乙二醛酶I(GLO I)是糖酵解的副产物甲基乙二醛(MG)解毒的限速酶,是癌症的潜在治疗靶标,Takasawa等[38]发现白皮杉醇对GLO I的表达有强烈的抑制作用,通过对GLO I表达的抑制,抑制肺癌NCI-H522细胞的增殖。
3 白皮杉醇抗肿瘤作用机制
通过上述白皮杉醇对各种肿瘤细胞的研究结果表明,白皮杉醇通过抑制多种信号通路机制发挥抗肿瘤作用:白皮杉醇通过抑制ROS潜在的侵袭活性来抑制癌细胞的增殖和凋亡[39];通过抑制STAT3信号通路的激活,抑制肿瘤细胞的增殖、迁移和侵袭作用[16];通过扰乱细胞周期中G2/M、G1/S和S期的进展来抑制细胞生长等[17,22,24,28,30];通过激活caspases抑制DU145细胞的生长和诱导其凋亡[14];能够抑制Cyclin D1、Cyclin B1和CDK4的表达,降低p27Kip1的积累,增强Cyclin E的表达,使细胞周期阻滞在S期抑制肿瘤细胞的生长促进肿瘤细胞凋亡的能力[24]。白皮杉醇对不同肿瘤细胞株的抗肿瘤作用机制详见表2和图2。
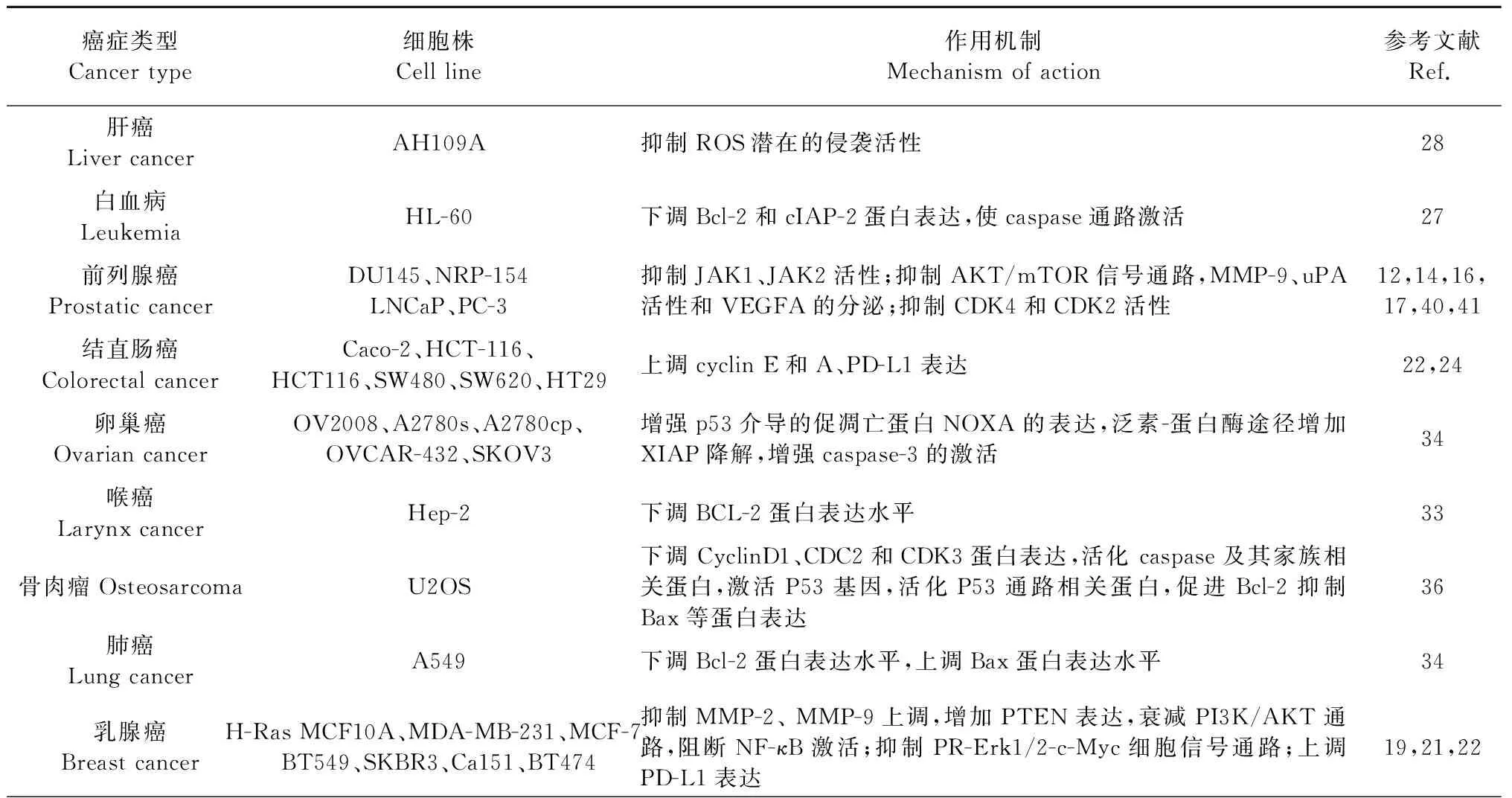
表2 白皮杉醇抗肿瘤作用机制Table 2 Anti-tumor mechanism of piceatannol
续表2(Continued Tab.2)

癌症类型Cancer type细胞株Cell line作用机制Mechanism of action参考文献Ref.淋巴瘤LymphomaBJAB使Caspase-3通路激活,通过CD95/Fas信号通路,诱导细胞凋亡42膀胱癌Bladder cancerT24、HT1376增强p21/WAF1、Fas/APO-1和mFasL表达43
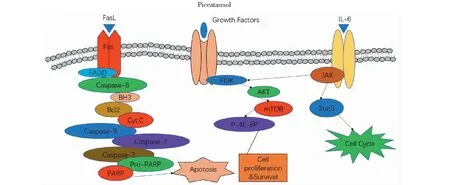
图2 白皮杉醇抗肿瘤作用信号通路图Fig.2 Signal pathway diagram of anti-tumor effect of piceatannol
5 结语和展望
目前研究已证实白皮杉醇是一种Syk家族激酶抑制剂、淋巴瘤细胞系BJAB和原发性白血病淋巴母细胞凋亡的强诱导剂、人类SK-Mel-28黑色素瘤细胞凋亡的强诱导剂、Wnt /β-catenin途径的抑制剂和骨髓瘤细胞凋亡的有效诱导剂[30,32,42,44]。对多种肿瘤细胞的增殖、迁移、侵袭都有一定的抑制作用,其抗肿瘤作用机制研究是现如今国内外研究的热点。
白皮杉醇来源十分广泛是一种很好的天然产物,在中药大黄,葡萄、百香果、甘蔗等中都能看到其踪影。韩国、印度、欧洲等主要从细胞和分子水平确证白皮杉醇生物活性方面研究比较多,对其在整体动物的药效学及临床试验方面的研究甚少,其临床治疗的有效性尚未明确,因此,如要进一步的开发和应用,仍需进行大量的科学实验研究。白皮杉醇与其他抗肿瘤药物联合用药,增强药物的抗肿瘤作用或降低其毒副作用,有望成为治疗肿瘤的一个新的治疗方法,虽然目前发现白皮杉醇可以作用于多种信号通路,但其抗肿瘤作用机制尚未明确,生物表达系统和技术方面也不够完善和成熟,需要我们进一步的去探索和研究,尽早确定白皮杉醇抗肿瘤作用的药用价值。

