厚朴酚与和厚朴酚衍生物的合成、表征及体外抗炎及抗肿瘤活性评价
郭明鑫,廖世莉,吴 霞,王娟霞,陈德琪,史可欣,谭有珍,冯毅凡
广东药科大学新药研发中心,广州 510006
为了继承和发展中药,研究者在中药植物中分离和提取了许多具有良好药理活性的天然单体,并基于有机化学和药物化学的理论基础对先导化合物进行结构修饰,从而保持或提高先导化合物的药理活性。厚朴酚(magnolol)与和厚朴酚(honokiol)(图1)是从厚朴中分离得到的含有烯丙基双酚的天然活性单体[1],具有抗炎、抗肿瘤、抗氧化等药理作用[2,3]。相关实验表明,厚朴酚可增强巨噬细胞的吞噬功能,下调丝裂原活化蛋白激酶(MAPK)和核因子κB(NF-κB)信号通路相关蛋白的表达[4,5]。和厚朴酚可以抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶、环氧合酶、谷氨酸过氧化物酶的产生,减少炎症介质的释放[6-8]。在抗细胞增殖方面,厚朴酚与和厚朴酚能抑制肿瘤细胞增殖、分化和转移,并能抑制肿瘤血管生成[9]。
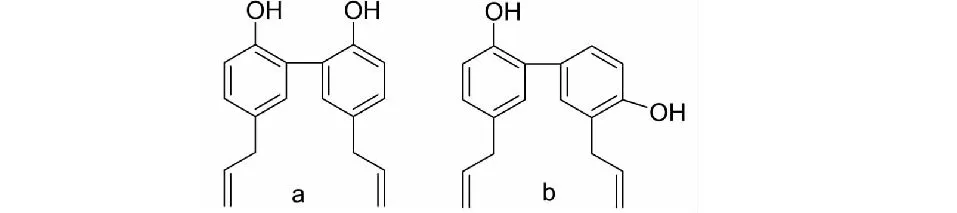
图1 厚朴酚(a)与和厚朴酚(b)结构图Fig.1 The chemical structures of magnolol(a) and honokiol(b)
然而,除了良好的药理活性外,相对较差的溶解性影响了它的生物利用度和临床疗效[10]。毒性应该引起更多的关注[11],厚朴酚与和厚朴酚对斑马鱼有很大的毒性[12]。同时,本课题组前期研究发现,厚朴酚与和厚朴酚对细胞有很强的毒性[13]。因此,作为一种具有一定潜力的先导化合物,对其进行结构改性是研究重点之一。研究人员发现,苯环上羟基被单甲基化或二甲基化的厚朴酚表现出良好的抗炎和抗皮肤癌活性,且厚朴酚甲基化产物的细胞毒性较厚朴酚明显降低[14-16]。通过分子模拟平台设计合成了一系列厚朴酚与和厚朴酚衍生物,酚羟基的甲基化衍生物对于Aβ蛋白和Tau蛋白的聚集均具有抑制作用[17]。另有研究表明,在厚朴酚苯环的羟基位置引入六元环,可以提高抗肿瘤活性,并且产物具有良好的水溶性(水溶性>1 000 mg/mL)[18]。Kim等[19]以和厚朴酚为原料,通过在酚羟基上引入酰基或葡萄糖,提高了其水溶性,并提高了其对大肠杆菌和铜绿假单胞菌的抑制作用。此外,研究还发现,当厚朴酚与和厚朴酚烯丙基上的双键被部分或完全改变时,其抗肿瘤活性会显著降低甚至消失[16,19,20]。因此,厚朴酚与和厚朴酚的烯丙基是抗肿瘤活性必需基团,而对其酚羟基的修饰则可改善其理化性质和药理活性。
作为合成1,3,4-噁二唑环化的先驱,Gibson[21]于1962年描述了1,3,4-噁二唑环化的反应机理,此后越来越多的研究者致力于1,3,4-噁二唑类化合物的合成,并不断尝试各种新方法合成具有特定生物效应的1,3,4-噁二唑类衍生物。Dewangan等[22]以苯甲酸和苯酰氯为原料合成了21个1,3,4-噁二唑类化合物,考察其体内抗炎和镇痛活性,结果显示所有化合物的抗炎活性都比阳性药吲哚美辛要强。BiJu等[23]以酰肼和醛为原料合成了九个具有1,3,4-噁二唑环的化合物,采用角叉菜胶诱导大鼠足肿胀法检测九个化合物的抗炎和镇痛活性,结果显示化合物具有较好的抗炎和镇痛活性,并且毒性较低。Ragab等[24]合成出13个含有二氢嘧啶的1,3,4-噁二唑类化合物,并对60多种癌细胞系进行了抗肿瘤筛查,筛选出白血病细胞株HL-60和MOLT-4效果最佳,可使MOLT-4细胞和HL-60细胞的细胞周期停滞在G2/M期,进而促细胞凋亡。胡昆等[25]设计合成鬼臼毒素4β-(1,3,4-噁二唑-2-氨基)衍生物,体外抗癌活性实验表明,目标化合物对正常细胞的毒性均远远小于阳性对照,部分化合物显示出较好的抗癌活性。
本课题组前期在厚朴酚的酚羟基上引入链状烃基或三嗪环后活性结果显示,其保留抗炎及抗肿瘤活性,并极大的降低了细胞毒性。因此,总结前人对构效关系的研究以及实验室前期研究基础上,在厚朴酚与和厚朴酚羟基的位置上引入酯基结构、酰肼结构及含氮杂环1,3,4-噁二唑结构,希望得到既能保持相当的生物活性,又能降低厚朴酚与和厚朴酚毒性的衍生物。
1 材料与方法
1.1 仪器与试剂
JASCO FT-IR-4600微型光谱仪、JASCO VV550紫外/可见分光光度计(JASCO Corporation,日本东京);X-6型显微熔点测定仪(北京技术公司,中国北京);AVANCEⅢ-500型超导核磁共振仪、VECTOR22FT-IR傅里叶红外光谱仪(Bruker Corporation,德国);UPLC-Q-TOF-MS质谱仪、2487/2996高效液相色谱仪(Waters Corporation,美国);Rigaku X射线衍射仪(Rigaku Corporation,日本东京)使用Cu-Kα辐射。本实验所用化学试剂均为分析纯;厚朴酚与和厚朴酚原料药(纯度大于98%),购买于Merck公司;无水试剂均按常规方法处理,使用屈臣氏纯净水;磺胺、盐酸萘乙二胺,购买于阿拉丁有限公司;胎牛血清(FBS)、高糖培养基(DMEM)及青霉素链霉素双抗等生物试剂购买于Gibco公司。小鼠巨噬细胞(RAW264.7)、人乳腺癌细胞株(MCF-7)、人肝癌细胞株(HepG2)、人非小细胞肺癌细胞株(H1299、A549),均购自中国科学院上海细胞库。
1.2 实验方法
1.2.1 厚朴酚与和厚朴酚衍生物的合成
1.2.1.1 合成策略
在图1中所述反应条件下,烯丙基双酚的酚羟基通过取代反应与溴乙酸甲酯反应生成MM酯和HM酯。该反应烷基化反应完全,所得MM酯和HM酯收率高,可通过简单纯化得到良好晶型。MM酯和HM酯与水合肼反应生成具有酰肼结构的MM和HM酰肼,随后MM酰肼和HM酰肼通过与二硫化碳环合并与碘甲烷反应生成具有1,3,4-恶二唑结构的MM-522和HM-522。用高效液相色谱(HPLC)法对结晶后衍生物进行了纯度测定,各衍生物的纯度均在95%以上。
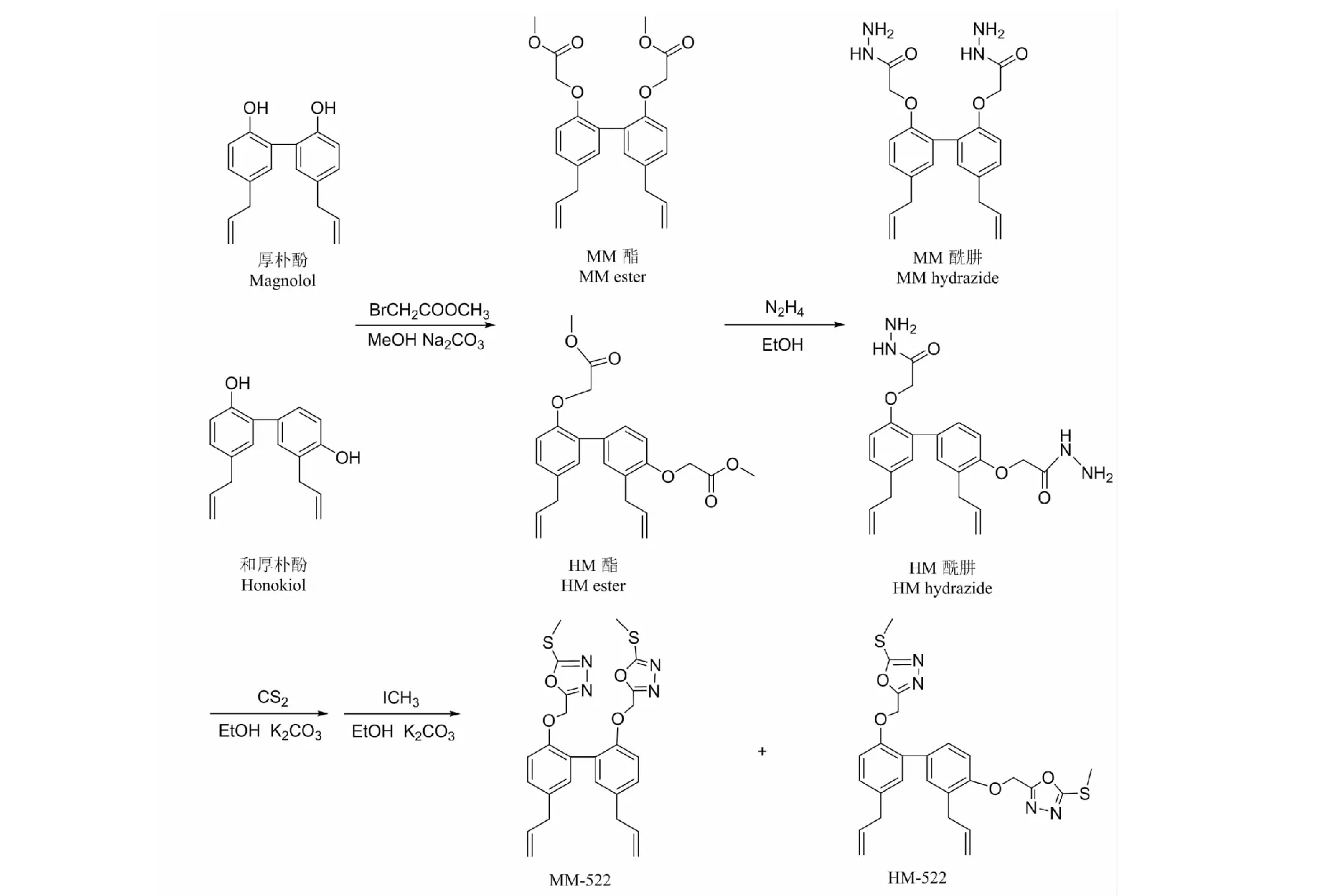
图1 厚朴酚与和厚朴酚衍生物合成路线Fig.1 The synthetic routes of magnolol and honokiol derivatives.
1.2.1.2 MM酯与HM酯的合成
称取0.01 mol厚朴酚或和厚朴酚,0.08 mol无水Na2CO3,加入洁净的三口烧瓶中,加入50 mL无水甲醇,搅拌升温至60~65 ℃,滴加入0.04 mol溴乙酸甲酯,加热回流8 h。反应结束后,趁热抽滤,滤液常温放置,析出白色条状结晶,得到化合物MM酯或HM酯。
1.2.1.3 MM酰肼与HM酰肼的合成
称取0.01 mol MM 酯或HM酯,加入洁净的三口烧瓶中,加入50 mL无水乙醇,搅拌升温至沸点,滴加0.04 mol水合肼,加热回流1 h。反应结束后,抽滤,滤液旋蒸至少量,加入少量纯净的去离子水,有白色沉淀析出,放置4 ℃冰箱过夜,抽滤,滤饼加适量乙腈重结晶,抽滤得MM 酰肼或HM酰肼。
1.2.1.4 1,3,4-恶二唑衍生物的合成
称取0.01 mol MM 酰肼或HM酰肼,0.02 mol氢氧化钾,加入洁净的三颈烧瓶中。加入100 mL无水乙醇,搅拌加热至沸点,滴加入0.02 mol二硫化碳溶液,加热回流12 h,温度降至室温,抽滤,滤液旋干,加入100 mL去离子水加浓盐酸调节pH=1~2,析出固体。取以上干燥的全部化合物,0.02 mol无水碳酸钾,0.02 mol碘甲烷溶液加入三颈烧瓶,加入50mL无水乙醇,室温搅拌12 h,抽滤,滤液加盐酸调节pH至中性,抽滤,滤液旋干,加入适量pH=12的碱水,超声30 min,抽滤,滤饼用无水乙醇反复重结晶得淡黄色膏状固体为化合物MM-522或HM-522。
1.2.2 细胞实验
1.2.2.1 MTT法测定衍生物的细胞毒性及抗肿瘤活性
将对数生长期生长良好的细胞,通过传代处理,调整细胞密度为5×105个/mL,接种于96孔板,每孔100 μL。细胞均匀贴壁后,吸去培养液,设调零组(仅含培养基)、空白组(含细胞、培养基)、给药组(含细胞、培养基、药物),给药组加入浓度梯度的含药完全培养基100 μL,分别为6.13、12.25、25.00、50.00、100.00、200.00、400.00、800.00 μM,每个浓度平行6个复孔,调零组和空白组加入同等体积的完全培养基。于培养箱培养24 h后,吸弃上清液,每孔加入100 μL含MTT的培养基,37 ℃培养4 h。小心吸弃上清,每孔加入150 μL DMSO,震摇10 min混匀,酶标仪490 nm测定吸光度,计算细胞存活率。同样,通过MTT法[26]评价衍生物对MCF-7、HepG2、A549及H1299的增殖抑制作用。
1.2.2.2 炎性因子NO、IL-1β及TNF-α的测定
将对数生长期生长良好的细胞,通过传代处理,调整细胞密度5×105个/mL,接种于96孔板,每孔100 μL,于37 ℃、5% CO2培养箱中稳定培养24 h,小心吸弃上清,分组给药,给药1 h后,炎症模型组与给药组加入适量LPS,使其终浓度为5 μg/mL,空白组给予等量的PBS,继续培养24 h,收集上清液,-20 ℃储存备用。分别取各给药组细胞上清液以及各浓度标准品稀释液50 μL于96孔板中,向其中加入50 μL A液(磺胺10 mg/mL+0.06%浓磷酸),再加入50 μL B液(N-1-萘乙二胺盐酸盐,1 mg/mL),振荡10 min,酶标仪测定546 nm处吸光度值,用ELISACalc软件进行计算。同法使用LPS诱导细胞炎症模型,收集上清液,按照各炎症因子ELISA试剂盒说明书操作,测定IL-1β、TNF-α的含量。
1.2.3 统计学方法
本实验数据采用SPSS(17.0版本)统计软件进行分析。实验结果以“均数±标准差”表示(Mean ± SD)。两组数据之间的均数比较采用t检验法,不满足方差齐性者采用两个独立样本非参数检验,当P<0.05时认同统计差异具有统计学意义。
2 实验结果
2.1 衍生物结构表征
MM酯:二甲基-2,2′-((5,5′-联丙烯-[1,1′-联苯]-2,2′-取代)二乙酸酯,白色晶状固体,产率85.3%;mp.89~93 ℃;紫外光谱显示其在208和282 nm处有最大吸收;IR(KBr)ν:3 071、2 965、2 908、1 762、1 631、1 596、1 211、1 079 cm-1;HR-ESI-MS:m/z411.182 5 [M+H]+(calcd for C24H27O6,411.180 8);1H NMR(500 MHz,DMSO-d6)δ:5.01~5.11(4H,m),5.92~6.00(2H,m,H-2),3.32(4H,d,J= 7.0 Hz,H-3),7.10,7.09(2H,dd,J= 2.5,2.0 Hz,H-5),6.88(2H,d,J= 8.5 Hz,H-6,H-6′),7.04(2H,d,J= 2.5 Hz,H-9,H-9′),4.67(4H,s,H-10,H-10′),3.65(6H,s,H-12,H-12′);13C NMR(125 MHz,DMSO-d6)δ:115.5(C-1,C-1′),137.8(C-2,C-2′),39.2(C-3,C-3′),132.1(C-4,C-4′),128.2(C-5,C-5′),112.6(C-6,C-6′),153.6(C-7,C-7′),127.3(C-8,C-8′),131.3(C-9,C-9′),65.4(C-10,C-10′),169.4(C-11,C-11′),51.6(C-12,C-12′)。MM酯为三斜晶系P-1空间群,a轴7.8593Å,b轴10.9479Å,c轴13.3607Å,α=107.548°,β=101.872°,γ=101.872°,体积1 066.65[13]。
HM酯:二甲基-2,2′-((3,5′-联丙烯-[1,1′-联苯]-2,4′-取代)二乙酸酯,白色晶状固体,产率82.6%;mp.76~79 ℃;紫外光谱显示其在211、255、287 nm处有最大吸收;IR(KBr)ν:2 908、2 856、1 766、1 492、1 443 cm-1;HR-ESI-MS:m/z411.184 6 [M+H]+(calcd for C24H27O6,411.180 8);1H NMR(500 MHz,DMSO-d6)δ:5.06~5.12(2H,m,H-1),5.00~5.04(2H,m,H-1′),5.99~6.06(1H,m,H-2),5.91~5.98(1H,m,H-2′),3.40(2H,d,J= 7.0 Hz,H-3),3.32(2H,d,J= 7.0 Hz,H-3′),6.92(1H,s,H-5),7.07,7.08(1H,dd,J= 2.0 Hz,H-6),7.35(1H,d,J= 2.0 Hz,H-6′),7.00(1H,s,H-7′),7.05(1H,d,J= 2.0 Hz,H-9);7.33(1H,d,J= 2.0 Hz,H-9′),4.76(2H,s,H-10),4.85(2H,s,H-10′),3.68(3H,s,H-12),3.71(3H,s,H-12′);13C NMR(125 MHz,DMSO-d6)δ:115.5(C-1),115.6(C-1′),137.9(C-2),136.8(C-2′),38.6(C-3),34.0(C-3′),132.7(C-4),129.5(C-4′),112.5(C-5),154.3(C-5′),127.9(C-6),128.1(C-6′),152.7(C-7),111.3(C-7′),130.8(C-8),127.6(C-8′),130.7(C-9),130.4(C-9′),64.9(C-10),64.8(C-10′),169.3(C-11),169.3(C-11′),51.8(C-12),51.7(C-12′)。如图2单晶衍射显示:HM酯为三斜晶系P-1空间群,a轴9.1932Å,b轴9.5749Å,c轴13.2782Å,α=99.755°,β=90.539°,γ=112.464°,体积1 061.0。
MM酰肼:2,2′-((5,5′-联丙烯-[1,1′-联苯]-2,2′-取代基)二(氧))二(乙酰肼),白色粉末状固体,产率48.9%;mp.135~138 ℃;紫外光谱显示其在214和285 nm处有最大吸收;IR(KBr)ν:3 316、3 184、3 042、2 913、1 667、1 428、1 408 cm-1;HR-ESI-MS:m/z411.200 9 [M+H]+(calcd for C22H27N4O4,411.203 2);1H NMR(500 MHz,DMSO-d6)δ:5.02~5.11(4H,m,H-1,H-1′),5.92~5.99(2H,m,H-2,H-2′),3.33(4H,d,J= 7.0 Hz,H-3,H-3′),7.12,7.10(2H,dd,J= 2.5,2.0 Hz,H-5,H-5′),6.91(2H,d,J= 8.5 Hz,H-6,H-6′),7.03(2H,d,J= 2.5 Hz,H-9,H-9′),4.43(4H,s,H-10,H-10′);13C NMR(125 MHz,DMSO-d6)δ:115.6(C-1,C-1′),137.9(C-2,C-2′),38.6(C-3,C-3′),132.3(C-4,C-4′),128.4(C-5,C-5′),112.5(C-6,C-6′),153.6(C-7,C-7′),127.4(C-8,C-8′),131.2(C-9,C-9′),66.9(C-10,C-10′),166.9(C-11,C-11′)。

图2 化合物HM酯的晶型(CCDC编号:19589)Fig.2 The crystal pattern of compound HM ester(CCDC Number:19589)
HM酰肼:2,2′-((3,5′-联丙烯-[1,1′-联苯]-2,4′-取代基)二(氧))二(乙酰肼),白色粉末状固体,产率56.3%;mp.129~134 ℃;紫外光谱显示其在210、254、286 nm处有最大吸收;IR(KBr)ν:3 419、1 675、1 501 cm-1;HR-ESI-MS:m/z411.204 9 [M+H]+(calcd for C24H27N4O4,411.203 2);1H NMR(500 MHz,DMSO-d6)δ:5.01~5.04(2H,m,H-1),5.06~5.12(2H,m,H-1′),5.91~5.99(1H,m,H-2),6.00~6.07(1H,m,H-2′),3.33(2H,d,J= 7.0 Hz,H-3),3.44(2H,d,J= 7.0 Hz,H-3′),6.93,6.92(1H,dd,J= 2.0 Hz,J= 3.0 Hz,H-5),7.08(1H,d,J= 2.5 Hz,H-6),7.40,7.38(1H,dd,J= 2.5Hz,J= 2.0 Hz,H-6′),6.91(1H,s,H-7′),7.06(1H,s);7.33(1H,d,J= 2.0 Hz,H-9′),4.43(2H,s,H-10),4.54(2H,s,H-10′);13C NMR(125 MHz,DMSO-d6)δ:115.6(C-1),115.5(C-1′),137.9(C-2),136.1(C-2′),38.6(C-3),33.9(C-3′),132.7(C-4),129.8(C-4′),113.2(C-5),154.6(C-5′),128.0(C-6),128.2(C-6′),153.1(C-7),111.4(C-7′),130.8(C-8),127.9(C-8′),130.6(C-9),130.4(C-9′),66.9(C-10),66.7(C-10′),166.9(C-11),166.8(C-11′)。
MM-522:5,5′-(((3′,5-联丙烯-[1,1′-联苯]-2,4′-取代基)二氧)二(亚甲基))二(2-(甲硫基)-1,3,4-噁二唑),淡黄色油状液体,产率36.9%;紫外光谱显示在217和283 nm处有最大吸收;IR(KBr)ν:3 073、2 933、1 589、1 641、1 486、1 431 cm-1;HR-ESI-MS:m/z523.143 4 [M+H]+(calcd for C26H27N4O4S2,523.147 4);1H NMR(500 MHz,DMSO-d6)δ:5.00~5.07(4H,m,H-1,H-1′),5.89~5.98(2H,m,H-2,H-2′),3.32(4H,d,J= 7.0 Hz,H-3,H-3′),7.15(2H,d,J= 1.0 Hz,H-5,H-5′),6.98(2H,d,J= 2.0 Hz,H-6,H-6′),7.14(2H,s,H-9,H-9′),5.25(4H,s,H-10,H-10′),2.66(6H,s,H-13,H-13′);13C NMR(125 MHz,DMSO-d6)δ:115.7(C-1,C-1′),137.7(C-2,C-2′),38.6(C-3,C-3′),132.9(C-4,C-4′),128.5(C-5,C-5′),113.6(C-6,C-6′),153.0(C-7,C-7′),127.4(C-8,C-8′),131.3(C-9,C-9′),60.2(C-10,C-10′),163.6(C-11,C-11′),165.5(C-12,C-12′),14.1(C-13,C-13′)。
HM-522:5,5′-(((3′,5-联丙烯-[1,1′-联苯]-2,4′-取代基)二氧)二(亚甲基))二(2-(甲硫基)-1,3,4-噁二唑),淡黄色液体,产率24.5%;紫外光谱显示在206、250、288 nm有最大吸收;IR(KBr)ν:3 073、3 013、2 973、2 930、1 638、1 692、1 483、1 428 cm-1;HR-ESI-MS:m/z523.140 8 [M+H]+(calcd for C26H27N4O4S2,523.147 4);1H NMR(500 MHz,DMSO-d6)δ:4.96~5.02(2H,m,H-1),5.04~5.11(2H,m,H-1′),5.87~5.94(1H,M,H-2),5.94~6.01(1H,m,H-2′),3.32(2H,s,H-3),3.35(2H,s,H-3′),7.14,7.12(1H,dd,J= 2.5,J= 2.0 Hz,H-5),7.16~7.18(1H,m,H-6),7.30,7.29(1H,dd,J= 2.5,J= 2.0 Hz,H-6′),7.11(1H,d,J= 2.0 Hz,H-7′),7.16~7.18(1H,m,H-9),7.27(1H,d,J= 2.5 Hz,H-9′),5.31(2H,s,H-10),5.43(2H,s,H-10′),2.68(3H,s,H-13),2.72(3H,s,H-13′);13C NMR(125 MHz,DMSO-d6)δ:115.3(C-1),115.7(C-1′),137.8(C-2),136.5(C-2′),38.6(C-3),33.7(C-3′),133.6(C-4),130.0(C-4′),114.1(C-5),154.1 C-5′),128.0(C-6),128.2(C-6′),152.6(C-7),112.6(C-7′),131.0(C-8),127.9(C-8′),130.8(C-9),130.5(C-9′),60.2(C-10),69.9(C-10′),163.6(C-11),163.5(C-11′),165.6(C-12),165.6(C-12′),14.2(C-13),2.7(C-13′)。
用结构分析的方法对6种衍生物的结构进行了分析。鉴于各衍生物的结构相似性,以化合物MM-522和HM-522的结构表征为例,证明反应的可靠性和真实性。HRMS(ESI)证实化合物MM-522的分子式为C26H26N4O4S2。红外光谱表明其含有芳香氢(3 073.98 cm-1)、甲基氢(2 933.2 cm-1)、碳链双键(1 589.06 cm-1)、羰基(1 641.13 cm-1)和苯环(1 486.85、1 431.89 cm-1)。化合物MM-522的1H NMR谱显示其结构中有1个甲基单峰位于最高场[2.66(6H,s)]为13和13′位上的氢信号,1个亚甲基双重峰[3.32(4H,d,J= 7.0 Hz)]为3和3′位上的氢信号,由于受到2及2′位上氢的影响使其分裂为双重峰,1个亚甲基单峰位于低场[5.25(4H,s)]为10和10′位上的氢信号,由于受到氧原子的影响,其化学位移向低场移动,1个烯键多重峰[5.01~5.09(4H,m)]为1和1′位上的氢信号以及1个次甲基多重峰[5.89~5.98(2H,m)] 为2和2′位上的氢信号,2个次甲基双重峰[7.15(2H,d,J= 1.0 Hz),6.98(2H,d,J= 2.0 Hz)],1个次甲基单峰[7.15(2H,s)]为苯环上氢的信号。根据13C NMR谱和DEPT谱显示有26个碳信号,其中包括6个亚甲基信号分别为3,3′,10,10′,1,1′位上的碳信号,10个甲基信号或次甲基信号,其中化学位移值位于最高场的为13和13′位上的碳信号,10个季碳信号。
如图3-a中所示,根据1H-1H COSY、HMBC表明H-3,3′与H-2,2′及H-1,1′互为偶合关系,验证了1H NMR里的推论;而H-5,5′与H-6,6′互为偶合关系,因此表明化学位移为7.15的2H单峰为9和9′的信号;根据HMBC显示H-10,10′与C-7,7′以及C-11,11′有远程偶合关系,可以得出1,3,4-恶二唑环通过10位亚甲基与厚朴酚7位上的酚羟基相连;又根据HMBC显示C-12,12′与H-13,13′有远程偶合得出1,3,4-恶二唑环的12位被甲硫基取代。综上所述,此化合物的结构被确定为5,5′-(((5,5′-联丙烯-[1,1′-联苯]-2,2′-取代基)二氧))二(亚甲基))二(2-(甲硫基)-1,3,4-噁二唑),简称为MM-522。
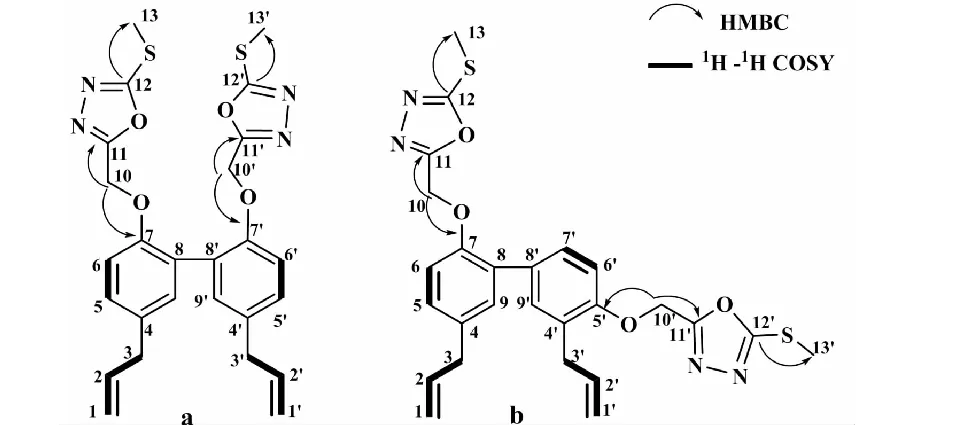
图3 MM-522(a)和HM-522(b)的HMBC和1H-1H COSY相关示意图Fig.3 The HMBC and 1H-1H COSY correlation of MM-522(a) and HM-522(b)
HM-522的分子式为C26H26N4O4S2。红外光谱表明HM-522的结构中含有芳香氢(3 073.98和3 013.23 cm-1)、甲基氢(2 973.70和2 930.31 cm-1)、碳氢链双键(1 638.23 cm-1)。羰基(1 692.23 cm-1)和苯环(1 483.96和1 428.99 cm-1)。化合物HM-522的1H NMR谱表明其结构具有两个甲基单峰[2.68(3H,s),2.72(3H,s)]分别为13和13′位上H的信号, 两个次甲基多重峰[5.87~5.94(1H,m),5.94~6.00(1H,m)]为2和2′位上H的信号,两个烯键多重峰[4.96~5.02(2H,m),5.04~5.11(2H,m)]分别为1和1′位上H的信号,四个亚甲基单峰[5.31(2H,s),5.43(2H,s),3.32(2H,s),3.35(2H,s)],苯环上六个H信号[7.14,7.12(1H,dd,J= 2.5 Hz,J= 2.0 Hz),7.16~7.18(2H,m),7.30,7.29(1H,dd,J= 2.5 Hz,J= 2.0 Hz),7.11(1H,d,J= 2.0 Hz),7.27(1H,d,J= 2.5 Hz)]。13C NMR谱和DEPT谱表明有26个碳信号,其中包括10个甲基或者次甲基信号,6个亚甲基和10个季碳。如图3-b所示,H-2,2′与 H-1,1′和H-3,3′具有关系,直接相连。H-10与C-7、C-11有远程偶合关系而H-10′与C-5′、C-11′,可以得出两个1,3,4-恶二唑环分别通过10和10′位亚甲基键与厚朴酚7和5′位上的酚羟基相连;又根据HMBC显示C-12与H-13,C-12′与H-13′有远程偶合得出1,3,4-恶二唑环的12和12′位被甲硫基取代。综上所述,此化合物的结构被确定为5,5′-(((3′,5-联丙烯-[1,1′-联苯]-2,4′-取代基)二氧)二(亚甲基))二(2-(甲硫基)-1,3,4-噁二唑),简称为HM-522。
由于第三步反应为环化反应,产率较低,影响因素较多,因此通过考察溶剂、温度、时间、催化剂、原料配比等因素对反应条件进行了优化。以无水乙醇、无水甲醇、N,N-二甲基甲酰胺(DMF)、异丙醇、二氯甲烷(DCM)、乙腈、1,4-二氧六环为反应溶剂,由于二氯甲烷的沸点太低,达不到反应要求的温度。当丙酮和1,4-二氧六环作为溶剂时,此反应不发生,而当乙腈和无水乙醇作为溶剂时产率较高,但两者产率相差不大,鉴于乙腈毒性较大,因此后续实验选择无水乙醇作为反应溶剂。在温度方面,我们发现当反应达到沸点时,产率达到最大。而当温度继续升高时,收率并没有随之增加。考察了氢氧化钾、氢氧化钠、无水碳酸钠、三乙胺和甲醇钠对反应收率的影响。结果表明,以无水碳酸钠为催化剂时,无水碳酸钠的收率最高。另外,当反应时间12 h,原料配比为酰肼∶无水碳酸钠∶二硫化碳=1∶2∶2时,中间体的收率最高,为66.01%。此外,值得注意的是,本研究采用溶剂法对各衍生物进行纯化,避免应用半制备液相色谱仪及硅胶层析柱等处理方式,所获得的衍生物纯度高且适用于体外活性研究。
2.2 生物学评价
2.2.1 衍生物对RAW264.7细胞增殖的影响
本实验采用MTT法研究厚朴酚与和厚朴酚各衍生物对细胞存活率的影响。实验结果如图4-a所示,厚朴酚与和厚朴酚对RAW 264.7细胞的毒性较大,厚朴酚浓度在200~400 μM时就能将细胞全部杀死,而和厚朴酚毒性较厚朴酚大,浓度在50~100 μM时就能将细胞全部杀死;在衍生物中,MM酯与MM-522在800 μM时对细胞毒性仍然较小,细胞存活率较高,而其他的衍生物随着药物浓度的升高,对细胞存活率的影响也增大,细胞存活率降低,但是所有衍生物的毒性与厚朴酚相比都有所降低。各处理组对正常细胞的IC50值如表1所示。
2.2.2 衍生物的体外抗炎作用研究
如图4-b所示,正常RAW 264.7细胞在未受LPS刺激的情况下几乎不分泌炎性介质NO;然而,细胞在受到LPS刺激后,炎症模型组较对照组分泌大量的NO,有显著性的变化(P<0.01),而阳性药布洛芬组NO浓度较炎症模型组显著性降低(P<0.01),说明此炎症模型造模成功。通过衍生物干预之后,各实验组中NO的分泌均受到不同程度的抑制作用,其中MM酯组(11.62 μmol/L)、MM-522组(10.52 μmol/L)、HM酰肼组(10.07 μmol/L)、HM-522 组(12.74 μmol/L)对NO的抑制作用与阳性药布洛芬相当,且HM 酰肼对NO的抑制作用最强。所有衍生物的抑制作用均强于厚朴酚组(14.47 μmol/L),并与和厚朴酚组(11.21 μmol/L)抑制作用相当。
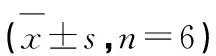
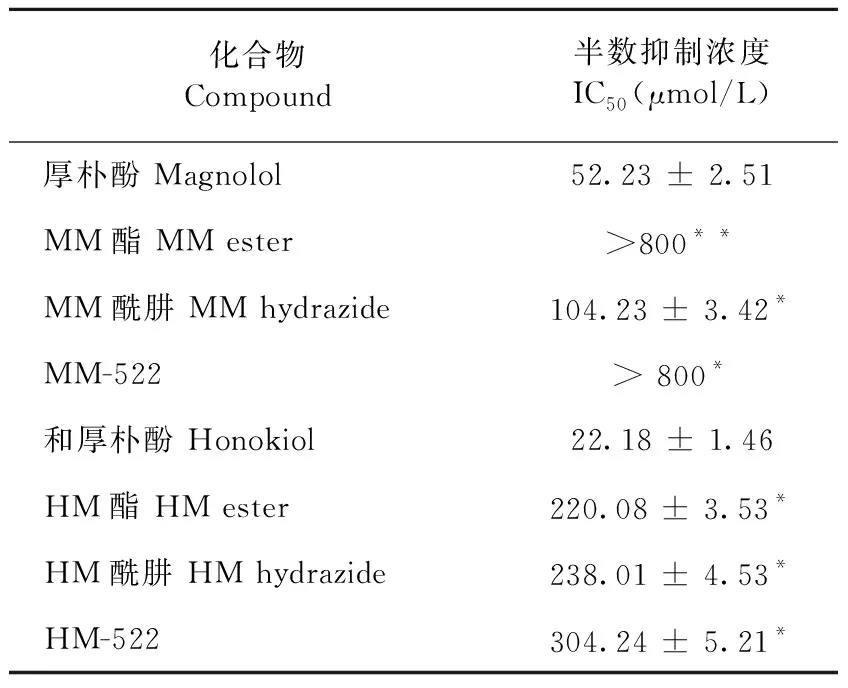
化合物Compound半数抑制浓度IC50(μmol/L)厚朴酚 Magnolol52.23 ± 2.51MM酯 MM ester>800**MM酰肼 MM hydrazide104.23 ± 3.42*MM-522 > 800*和厚朴酚 Honokiol22.18 ± 1.46HM酯 HM ester220.08 ± 3.53*HM酰肼 HM hydrazide238.01 ± 4.53*HM-522 304.24 ± 5.21*
注:与原料药对照组比较,*P<0.05;**P<0.01。
Note:Compared with control group,*P<0.05;**P<0.01.
根据4-c所示,RAW 264.7细胞受到LPS刺激后,炎症模型组较对照组分泌大量的IL-1β,有极显著的差异(P<0.01)。各实验组中IL-1β的分泌均受到不同程度的抑制作用,其中MM-522(12.87 pg/mL)的抑制作用最强,其他衍生物的抑制作用与布洛芬(16.68 pg/mL)相当或较强。所有衍生物的抑制作用与厚朴酚组(12.23 pg/mL)、和厚朴酚组(14.73 pg/mL)抑制作用相当。从图4-d可知,所有药物组TNF-α浓度与炎症模型组相比,都有显著性变化(P< 0.01),因此均能不同程度地抑制LPS刺激后的RAW 264.7巨噬细胞分泌TNF-α,抑制强度与厚朴酚(16 618.66 pg/mL)、和厚朴酚(16 326.89 pg/mL)以及阳性药布洛芬(15 028.40 pg/mL)相当,其中MM酰肼(12 554.76 pg/mL)与HM酰肼(12 407.54 pg/mL)抑制TNF-α分泌的作用最强。因此衍生物在体外抗炎活性方面到达了增效减毒的作用。
2.2.3 衍生物体外抗肿瘤作用研究
为了初步探究各衍生物的体外抗肿瘤活性,本实验以MCF-7、HepG2、H1299及A549为研究对象,采用MTT法以厚朴酚与和厚朴酚为对照对衍生物的体外抗肿瘤活性进行评价。结果如表2、表3中所示,经过结构修饰后,原料药厚朴酚与和厚朴酚对四种肿瘤细胞均有较好的抑制作用,而衍生物的抑制作用有所减弱,但也表现出明显的抑制作用。衍生物HM酯对MCF-7表现出较好的抑制作用,浓度在100 μmol/L的时候,细胞存活率大约是30%,并且具有浓度依赖性;对于HepG2抑制实验中,和厚朴酚在低浓度时就能将癌细胞全部杀死,衍生物HM酯和MM酯均表现出了较好的抑制作用,MM酯在低浓度时细胞存活率低于30%;衍生物HM酯、HM酰肼对A549表现出较好的抑制作用,HM酯在浓度为400 μmol/L的时候,几乎杀死全部A549;在H1299抑制实验中,衍生物MM酰肼、HM酯、HM酰肼均表现出较好的抑制作用。
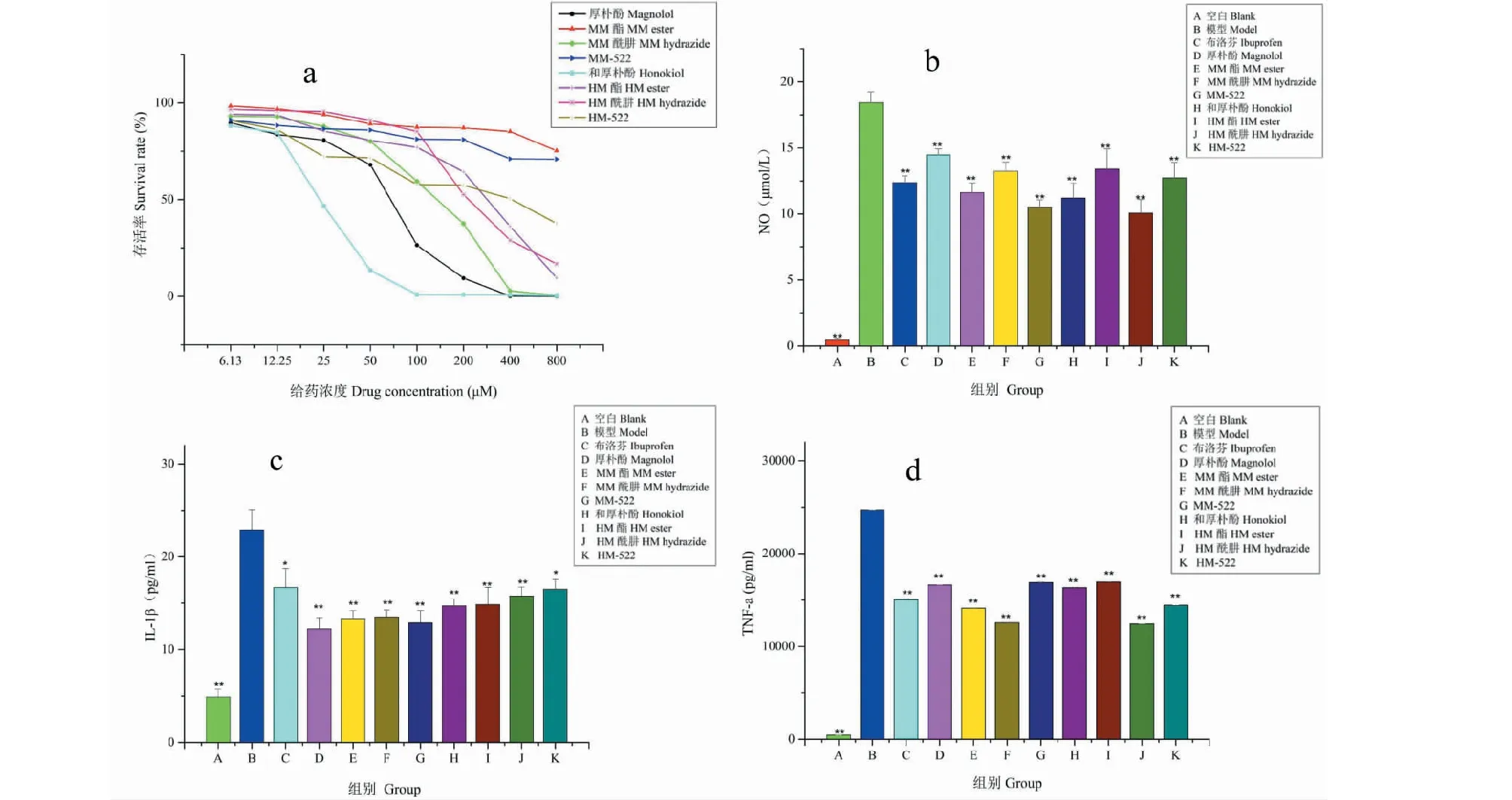
图4 各衍生物的细胞毒性及其对炎症因子影响Fig.4 Cytotoxicity of derivatives and their effects on inhibiting inflammatory factors
3 结论
基于“减毒增效”及总结前人研究的基础上,设计修饰并合成了6个衍生物,其中,MM酰肼、MM-522、HM酯、HM酰肼及HM-522国内外未见文献报道。所有衍生物的细胞毒性与原料相比都有所降低。在抗炎活性探究中发现,多数衍生物在保持较低细胞毒性的同时,衍生物MM酯、HM酰肼及MM-522具有良好抑制炎性介质生成的作用。在评价衍生物肿瘤的活性评价中,原料药厚朴酚与和厚朴酚具有良好的抗肿瘤活性,而衍生物的抗肿瘤活性略有下降。但是,MM酯、HM酯在保持低细胞毒性的情况下,仍然表现出一定的抗肿瘤活性。由此可知,原料药厚朴酚于和厚朴酚良好的的抗肿瘤作用与其较强的细胞毒性存在某种关联。本研究中的MM酰肼、MM-522、HM酯及HM酰肼等对细胞毒性较小,且抗炎及抗肿瘤活性优于阳性药物及原料药。因此,本研究达到降低毒性,维持药效的目的,对先导化合物的开发和修饰具有一定的研究意义。
表2 衍生物对MCF-7和HepG2的存活率Table 2 The survival ratio of derivatives against MCF-7 and HepG2
注:浓度单位:μmol/L,下同。
Note:Concentration unit:μmol/L,the same below.

表3 衍生物对A549和H1299的存活率Table 3 The survival ratio of derivatives against A549 and H1299

