扶芳藤提取物体内体外抗氧化作用研究
郑 璐,胡金贵,张佳智,葛 睿,李青山
1山西医科大学药学院,太原 030001;2山西中医药大学中药与食品工程学院 基于炎性反应的重大疾病创新药物山西省重点实验室,晋中 030619
扶芳藤(Euonymusfortunei(Turcz.) Hand.-Mazz),卫矛科卫矛属常绿藤本灌木,别名换骨筋、山百足、万年青、卫生草等[1],是我国少数民族常用的中药,具有益气血、补肝肾、舒筋活络、止血、化瘀等功效[2],其有效成分主要是山柰酚、槲皮素、甜醇等[3,4]。提取物中所含主要成分的差异,为更有效的利用民族中药资源提供科学依据。扶芳藤传统用于治疗风湿痹痛等症,对现代医学的类风湿关节炎以及骨关节炎疾病有显著疗效,且无明显毒副作用。同时,有文献资料显示[5],类风湿关节炎的发生与氧自由基产生过多有着密切的关系。本实验室前期研究发现扶芳藤的乙醇总提物具有较好的抗氧化作用,可以改善体内外丙二醛(malondialdehyde,MDA)的清除效果和谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)及超氧化物歧化酶(superoxide dismutase,SOD)活性,由此扶芳藤抗氧化方面有着进一步研发的价值。本研究对扶芳藤总提物进行进一步地有效部位分离,所得各萃取极性部位样品进行体内、体外抗氧化实验研究,以进一步确定扶芳藤抗氧化活性的有效部位。
1 材料与设备
1.1 材料与试剂
扶芳藤乙醇总提物;乙酸乙酯、正丁醇、石油醚及无水乙醇均为分析纯;DPPH(1,1-二苯基-2-三硝基苯肼)、WST-1水溶性四唑盐试剂(碧云天生物技术);LPS(北京索莱宝试剂);塞来昔布胶囊(辉瑞制药有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)、GSH-Px检测试剂盒(南京建成生物工程研究所)。
1.2 仪器
AMR-100型全自动酶标分析仪(杭州奥盛仪器有限公司);UV-1200型紫外分析仪(上海美普达仪器有限公司);万分之一内较电子天平(赛多丽斯科学仪器有限公司,京制00000246号);低速离心机(安徽中科中佳科学仪器有限公司,SC-2554);手术器械;HH-2数显恒温水浴锅(国华电器有限公司);移液枪(德国Eppendorf公司)。
1.3 动物
雄性昆明小鼠120只,体质量为22±2 g,来自山西医科大学实验动物中心(动物合格证编号:SCXK(晋)2015-0001),小鼠饲养于山西医科大学动物实验研究中心小鼠饲养室。
2 方法
2.1 受试物及对照品溶液的制备
2.1.1 扶芳藤不同提取部位
称取干燥扶芳藤乙醇提取物粗粉100.0 g,浸泡于蒸馏水中2~3天,用等体积石油醚[6]、乙酸乙酯、正丁醇萃取,然后减压浓缩,分别得到三个萃取部位[7]。
2.1.2 DPPH工作液及ABTS工作液的配置
参考试剂盒说明书完成。
2.2 体外抗氧化实验
2.2.1 对DPPH自由基的抑制作用
依据预实验的结果,设置扶芳藤正丁醇、乙酸乙酯、石油醚部位的浓度梯度分别为0.025、0.050、0.075、0.100、0.150、0.200、0.300、0.400、0.500 mg/mL;0.025、0.050、0.075、0.125、0.150、0.175、0.225、0.250、0.275、0.350、0.450、0.500 mg/mL及0.083、0.160、0.333、0.500、0.667、0.833、1.000 mg/mL。96孔板每孔加入DPPH溶液120 μL,加扶芳藤不同极性提取部位样品液60 μL,混匀,静置30 min后,用酶标仪在519 nm处测定OD样品值。扶芳藤不同极性提取部位对DPPH自由基清除性能按下式计算:清除率=(OD0-OD样品)/OD0×100%[8,9]。对DPPH自由基清除性能与扶芳藤不同提取部位的浓度做散点图,并计算IC50值。
2.2.2 对ABTS自由基的抑制作用
依据预实验的结果,设置扶芳藤正丁醇及乙酸乙酯部位的浓度梯度为:0.100、0.250、0.500、0.750、1.000、1.500、2.000、3.000、4.000、5.000 mg/mL;石油醚部位浓度梯度为0.250、0.500、1.000、2.000、4.000、6.000、8.000、10.000、12.000、14.000 mg/mL。96孔板每孔加入ABTS工作液200 μL,加扶芳藤不同极性提取部位样品液10 μL,轻轻混匀,室温避光静置5 min后,用酶标仪在734 nm处测定OD样品值。扶芳藤不同极性提取部位对ABST自由基清除性能按下式计算:抑制率=(OD0-OD样品)/OD0×100%[10-12]。对ABTS自由基清除性能与扶芳藤不同提取部位的浓度绘制的散点图,并计算IC50值。
2.3 体内抗氧化实验
2.3.1 试验剂量
前期急性毒性实验结果表明小鼠灌胃扶芳藤最大给药量为130.8 g生药/kg体重,几乎无急性毒性。因此参考扶芳藤临床日用量(10 g生药)计算扶芳藤不同提取部位的浓度,以5‰CMC-Na为溶剂按剂量配制成所需浓度。
2.3.2 动物分组及造模
取雄性昆明小鼠120只,随机分为正常对照组、模型组、阳性对照组(塞来昔布)、扶芳藤石油醚部位低中高剂量组、乙酸乙酯部位低中高剂量组、正丁醇部位低中高剂量组,共计12组,每组10只。各组小鼠灌胃给药,0.1 mL/10 g,每日1次,给药14天。对照组给予等体积的5‰CMC-Na溶液。14天后用100 g/L的水合氯醛对小鼠进行腹腔注射(4 mL/kg)麻醉,麻醉后用镊子牵拉小鼠的舌,用移液枪吸取1 g/L的LPS 50 μL滴于小鼠咽喉壁,并马上捏住小鼠的鼻子,20 s后松开舌及鼻,造成急性肺损伤模型[13-15],阳性药塞来昔布在造模前1 h灌胃给药。造模12 h后眼眶取血,离心取血清于0.5 mL的EP管中,冰箱-20 ℃冻存。
2.3.3 血清中SOD活力、MDA含量和GSH-Px酶活力的测定
MDA活性的测定采用硫代巴比妥酸法;SOD活性的测定采用WST-1法(WST-1水溶性四唑盐试剂),具体操作流程按照试剂盒的说明书进行[16-18]。在进行正式实验之前需进行预实验。
2.4 统计学方法
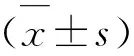
3 结果
3.1 体外抗氧化实验
3.1.1 对DPPH 自由基的抑制作用
按照前述公式计算清除率,不同浓度的扶芳藤提取部位对DPPH的清除率如图1所示。由图1可以看出扶芳藤不同提取部位对DPPH自由基都具有清除作用。其清除作用与扶芳藤不同提取部位的浓度在一定范围内呈一定的化学计量关系。在0.010~0.150 mg/mL的有效范围内,随着扶芳藤正丁醇部位的浓度不断增加,清除率也随之不断增加,IC50=0.100 mg/mL;在0.010~0.275 mg/mL的有效范围内,随着扶芳藤乙酸乙酯部位的浓度不断增加,清除率也随之不断增加,IC50=0.256 mg/mL;在0.080~1.000 mg/mL的有效范围内,随着扶芳藤石油醚部位的浓度不断增加,清除率也随之不断增加,IC50=0.700 mg/mL。
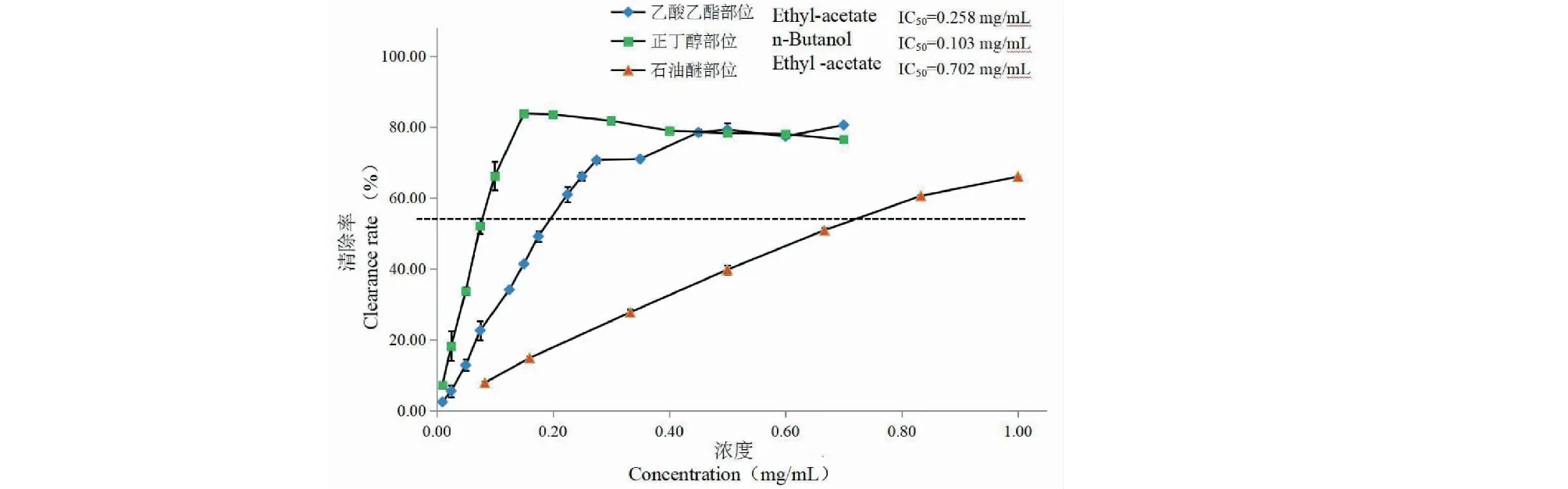
图1 扶芳藤不同提取部位对DPPH自由基的清除率Fig.1 Scavenging ratio of the extract components from E.fortunei on DPPH radical s,n = 3)
3.1.2 ABTS自由基清除率的测定
按照前述公式进行计算抑制率,不同浓度的扶芳藤不同极性提取部位对ABTS的抑制率如图2所示。由图2可以看出扶芳藤不同极性提取部位对ABTS的产生都具有抑制作用。
随着扶芳藤正丁醇部位的浓度不断增加,抑制率也随之不断增加,当浓度大于2 mg/mL后抑制作用进入平台期,抑制率最大在80%左右,IC50=0.814 mg/mL;随着扶芳藤乙酸乙酯部位的浓度不断增加,清除率也随之不断增加,当浓度大于4 mg/mL后抑制作用出现下降趋势,抑制率最大在70%左右,IC50=2.384 mg/mL;随着扶芳藤石油醚部位的浓度不断增加,清除率也随之不断增加,当浓度大于4 mg/mL后抑制作用出现下降趋势,抑制率最大在90%左右,IC50=2.059 mg/mL。
3.2 体内抗氧化实验
3.2.1 对小鼠体内SOD活性影响
乙酸乙酯中高剂量组(8.8和、17.6 mg/kg)和正丁醇低中高剂量组(6.7、13.4、26.8 mg/kg)对提高小鼠体内SOD活性均有良好的效果,与模型组比较有显著差异(P<0.05,P<0.01)。石油醚低中高剂量组均无显著影响。结果见表1和图3。
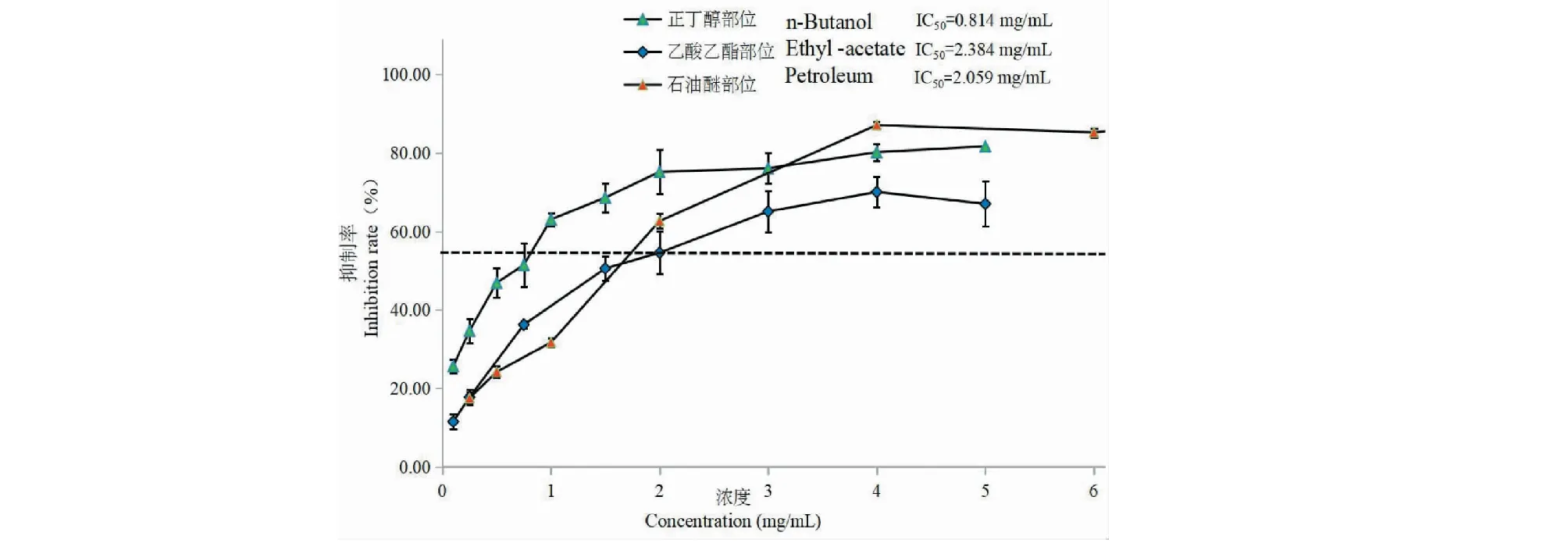
图2 扶芳藤不同提取部位对ABTS自由基的抑制率Fig.2 Scavenging ratio of the extract components from E.fortunei on ABST radical s,n =3)
3.2.2 对小鼠体内MDA含量的影响
乙酸乙酯低中高剂量组和正丁醇低中高剂量组能够降低MDA的含量,与模型组比较有显著差异(P<0.05,P<0.01),石油醚低中高剂量组均无显著影响。结果见表1和图4。
3.2.3 对小鼠体内GSH-Px活性影响
乙酸乙酯低中高剂量组和正丁醇低中高剂量组对提高小鼠体内GSH-Px活性均有良好的效果,与模型组比较有显著差异(P<0.05,P<0.01)。石油醚低中高剂量组均无显著影响。结果见表1和图5。
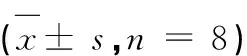
表1 扶芳藤各萃取极性部位对SOD、MDA、GSH-Px酶活力的影响Table 1 Effects of the extract components from the E.fortunei on SOD,MDA,GSH-Px activity s,n = 8)
注:a阳性对照;与空白组比较,#P<0.05,##P<0.01;与模型组组比较,*P<0.05,**P<0.01。
Note:aPositive control;Compared with control group,#P<0.05,##P<0.01,#P<0.05;Compared with model group,*P<0.05,**P<0.01。
4 讨论
4.1 体外抗氧化实验
体外DPPH、ABST自由基实验,常用于恒定植物抗氧化活性的体外实验指标。DPPH是一种很稳定的氮中心的自由基,它的稳定性主要来自3个苯环的π-π共轭作用及空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。作为一种稳定的自由基,DPPH可以捕获其他的自由基。因此通过加入DPPH后观察某一化学反应的速率是否减慢,来作为这一反应是否具有自由基反应本质的指标。
本实验以扶芳藤为原料,萃取扶芳藤各极性部位,并设计多个剂量组实验,其清除作用与扶芳藤不同极性萃取部位的浓度在一定范围内呈一定的化学剂量关系,说明扶芳藤萃取部位具有很好的体外抗氧化活性。分别以DPPH和ABTS自由基清除法测定不同扶芳藤萃取物的自由基清除能力,在DPPH实验中,正丁醇部位的清除力最好[19],在低浓度时就达到良好的清除效果,其IC50值为0.103 mg/mL,乙酸乙酯部位次之其IC50值为0.258 mg/mL,石油醚部位最末IC50值为0.702 mg/mL;在ABST实验中,同样也表现为正丁醇部位的清除力最好,在低浓度时就达到较好的清除效果,其IC50值为0.814 mg/mL,石油醚部位次之其IC50值为2.059 mg/mL,乙酸乙酯部位最末IC50值为2.384 mg/mL。
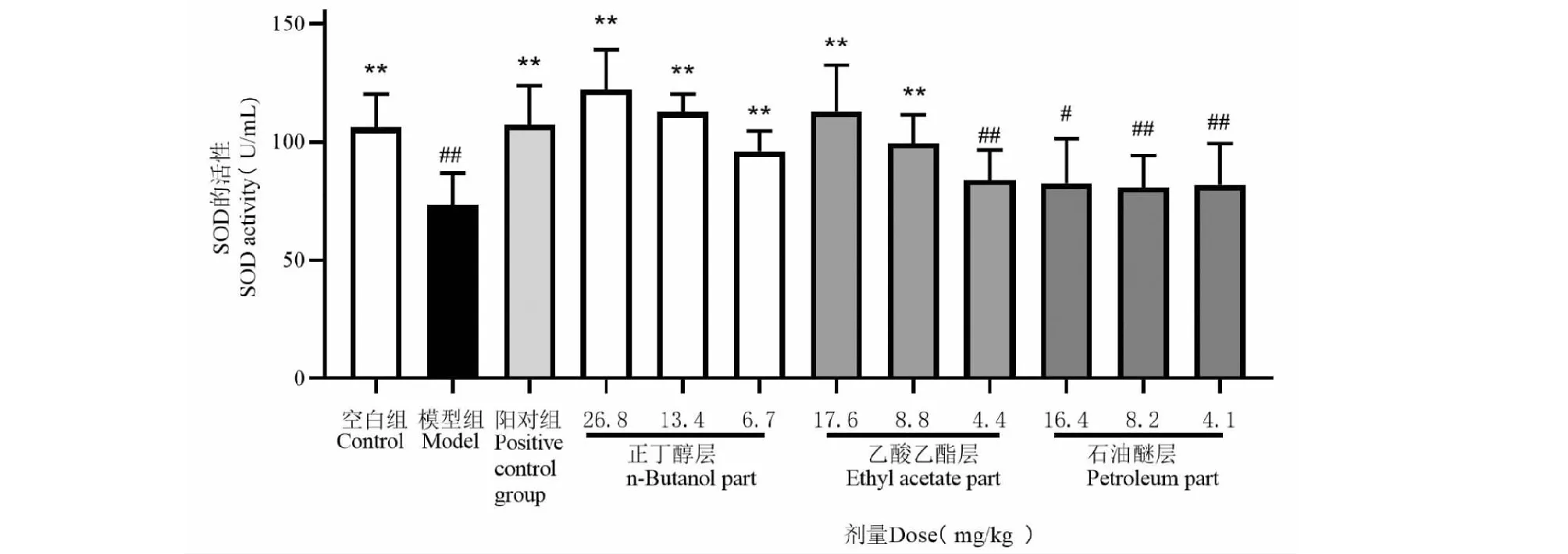
图3 扶芳藤不同极性萃取部位对SOD活性的影响Fig.3 Effects of the extract components from the E.fortunei on SOD activity注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:##P<0.01 vs control group;*P<0.05,**P<0.01 vsLPS group.
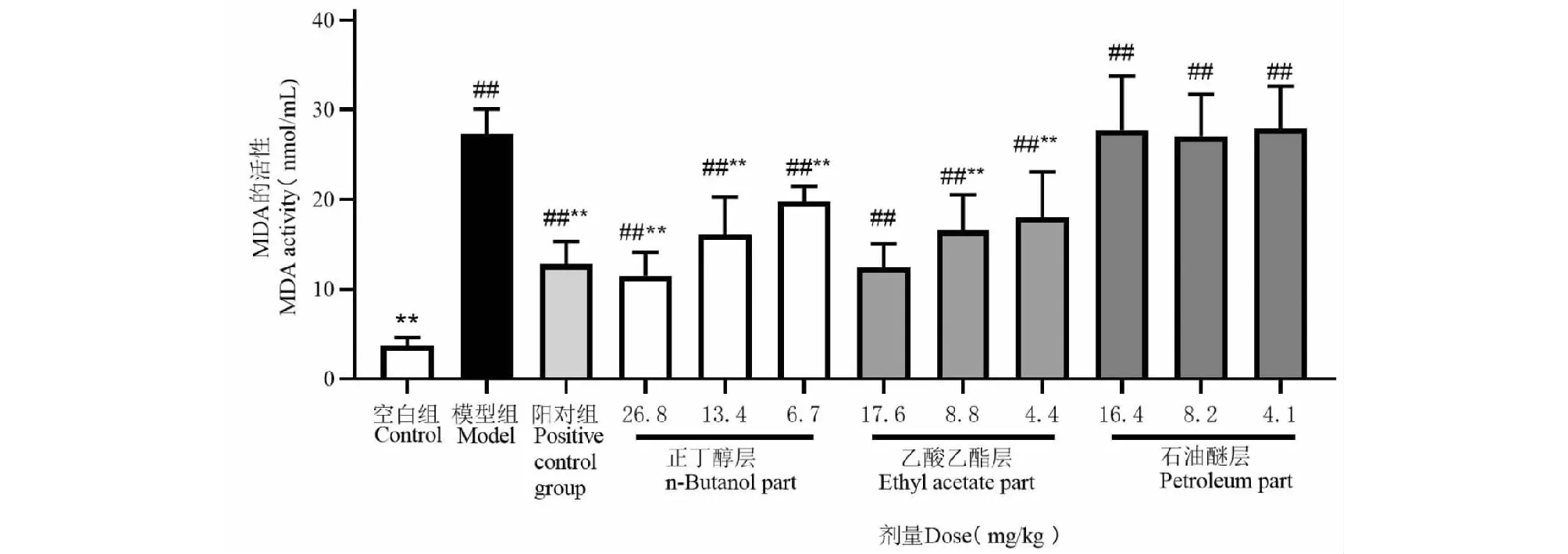
图4 扶芳藤不同极性萃取部位对MDA含量的影响Fig.4 Effects of the extract components from the E.fortunei on MDA activity注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:##P<0.01 vs control group;*P<0.05,**P<0.01 vsLPS group.
4.2 体内抗氧化实验
体内抗氧化研究主要通过检测扶芳藤不同萃取部位抗氧化物质对动物模型相关抗氧化指标的影响,来反应其抗氧化作用的强弱。机体内有许多酶及非酶保护屏障对抗自由基造成的DNA、蛋白质等大分子物质的损伤,如通过SOD和MDA、还原型谷胱甘肽(GSH)等酶的作用,可防御自由基造成的氧化损伤[20],从而实现机体内内源性自我保护系统,达到抗损伤的目的。体内MDA、SOD和GSH-Px酶活力三个实验结果显示,在SOD实验中,扶芳藤萃取正丁醇部位抗氧化效果最优;在MDA和GSH-Px酶活力这两个实验中,扶芳藤萃取乙酸乙酯部位抗氧化效果则最好。
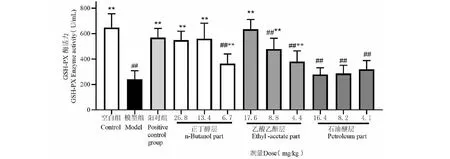
图5 扶芳藤不同极性萃取部位对GSH-Px酶活力的影响Fig.5 Effects of the extract components from the E.fortunei on GSH-Px activity注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group.
急性肺损伤(acute lung injury,ALI)是由各种因素所致的肺弥漫性炎症损伤,以呼吸窘迫及进行性低氧血症为特征,严重时会引发多脏器功能障碍,甚至导致死亡[21]。其发病机制非常复杂,多种病因均可诱发ALI,其中革兰阴性菌感染所致的肺炎是ALI最常见的发病因素,内毒素是革兰阴性菌感染时解体后所释放的一种毒性物质,可激活机体的免疫体统,诱使多种炎症细胞因子的释放,引起机体急性炎症,是目前研究ALI较理想的诱导剂。较多研究认为肺组织的炎症反应失衡是导致各种ALI的根本原因,而氧化损伤也是导致 ALI的重要原因之一[22]。前期课题组研究发现扶芳藤乙醇总提物对LPS诱导的ALI有一定的保护作用,抗氧化是否是该保护作用产生的原因之一就是亟待解决的问题。
塞来昔布是临床上常见的一种抗炎药物,但长期过量用药可引起较多的副作用,因此选择高效低毒的中药有着积极的意义。本研究选择公认的抗炎药物塞来昔布作为阳性对照药,对比扶芳藤各萃取部位对ALI的影响。
根据自由基学说,人体疾病的发生都和氧自由基有一定的关系。人体内,约95%以上的自由基都是氧自由基,由于氧自由基的外层电子不成对,因此它的化学性质很活泼,很容易和其他物质发生氧化反应。氧自由基的存在有着两面性,一方面,在人体的新陈代谢中氧自由基是有益的,比如氧化还原代谢反应;但另一方面,过多的氧自由基会对人体造成伤害,比如自由基介导炎症关节滑液中透明质酸的降解,破坏透明质酸、降解关节软骨并造成骨损伤,从而引起类风湿关节炎等。而本文的扶芳藤已证实其有着良好的抗氧化作用,能够清除氧自由基,对过多的氧自由基引起的关节炎疾病有着一定疗效。
综上所述,结合体内外实验结果可知扶芳藤萃取物乙酸乙酯及正丁醇部位具有较好的抗氧化活性,其中以乙酸乙酯部位的活性更为显著,结合扶芳藤中化学成分的考虑,萃取部位可能含有黄酮苷、酚酸类和多糖类等物质[23]。目前国内外对于黄酮类、酚酸类和多糖类的抗氧化能力也有报道,所以推测扶芳藤不同极性部位的萃取物都可能存在不同含量的黄酮类或者酚酸类等物质,从而表现出不同程度的抗氧化能力[24]。本研究为进一步验证扶芳藤中何种成分起主要作用,为寻找新的高效低毒的天然抗氧化剂及后续开发利用提供一定的理论依据。
本实验的极性部位是天然的提取物,提取过程中环保无污染,从而对其进行研究和将其开发成天然抗氧化剂或自由基清除剂对保障机体健康、预防心脑血管疾病有着重要的意义。

