艾灸对结肠炎相关性结肠癌大鼠 P2X7受体、Wnt/β-catenin信号通路影响的研究
陆嫄,顾沐恩,丁邦友,丁光宏,郑寒丹,李璟,马晓芃,吴璐一,李琪,黄艳,刘慧荣,吴焕淦
(1.上海市针灸经络研究所,上海 200030;2.复旦大学,上海 200433;3.上海中医药大学附属岳阳中西医结合医院,上海 200437;4.上海中医药大学针灸免疫效应重点研究室,上海 201203)
结肠炎相关性结肠癌(colitis-associated cancer,CAC)是结直肠癌的一种亚型,与溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)等炎症性肠病(inflammatory bowel disease,IBD)相关[1],其中UC发生癌变的几率远高于其他人群,且随病程延长发病率升高,病程 30年以上的UC患者CAC患病率高达33.2%[2]。
CAC是典型的炎症介导的癌症,结肠慢性炎症是癌变的催化剂[3]。法国研究者观察 P2X7R基因敲除对CAC小鼠的影响,研究发现,P2X7R基因敲除会导致TGFβ1的高表达、Treg细胞的募集以及TGFβ1介导的结肠上皮细胞增殖,表明P2X7R在CAC早期进展中发挥了肿瘤抑制作用[4]。P2X7R还能通过抑制GSK3β进而抑制Wnt/β-catenin通路的信号转导[5]。在CAC炎症介导的癌症中,Wnt/β-catenin信号通路可诱导上皮间质转化,与结肠组织肿瘤发生、发展密切相关,β-catenin是Wnt途径中最为关键的转导子,参与结肠炎相关癌变[6]。抑制异常激活的Wnt/GSK3β/β-catenin信号通路转导,能延缓CAC进展[7-9]。
目前 CAC的发病机制尚未完全阐明,对阻遏结肠慢性炎症进展为CAC,也尚无明确的治疗手段。笔者团队从事灸法治疗IBD 30余年,明确了艾灸能有效减轻IBD结肠炎症反应,隔药灸可下调UC中与癌变密切相关的p53和C-myc基因表达[10]。为了进一步研究艾灸对CAC的治疗作用,本研究从P2X7R和Wnt/β-catenin信号通路的角度,探讨隔药灸和隔姜灸对 CAC大鼠的干预效应及效应机制,现报道如下。
1 材料与方法
1.1 实验动物
实验动物为近交系雄性清洁级 SD大鼠,体质量(100±20)g,共 26只,由上海斯莱克实验动物有限公司提供[动物许可证号SCXK(沪)2012-0002]。将26只大鼠分笼饲养,适应性饲养 1周,温度控制在 18℃~22℃,湿度控制在 50%~70%,同时保持 12 h昼夜节律。实验中所有操作均遵循美国国立卫生研究院及上海市实验动物伦理委员会的规定。
1.2 试剂与仪器
葡聚糖硫酸(DSS,分子量 36000~50000,MP biomedicals公司,美国);氧化偶氮甲烷(AOM,Sigma公司,美国);戊巴比妥钠(国药集团化学试剂有限公司,中国);RIPA裂解液、BCA蛋白定量试剂盒、SDS凝胶配制试剂盒、ECL发光试剂盒、一抗二抗稀释液(上海威奥生物科技有限公司,中国);RNA酶抑制剂、Trizol(Invitrogen公司,美国);兔抗大鼠一抗P2X7R(Sigma公司,美国);GAPDH抗体(CST公司,美国)。
组织脱水机、组织包埋机、石蜡切片机、展片机(Leica公司,德国);小型Trans Blot转印槽(Bio-Rad公司,美国);NanoDrop超微量分光光度计(Thermo Scientific公司,美国);凝胶成像系统 GIS-1600(上海天能科技有限公司,中国);ABI ViiA 7 Real Time PCR System(Applied Biosystems公司,美国);光学显微镜(Olympus公司,日本)。
1.3 造模方法
大鼠适应性喂养1周,将26只SD大鼠随机分为正常组6只和造模组20只,参考Greten FR等[11]方法构建CAC模型。每只造模大鼠腹腔注射AOM(10 mg/kg),1周后予以反复3个周期的炎症刺激(3%-2%-2%)。其中第1个周期,3%DSS自由饮水4 d后改用正常饮水17 d;第2周期,2%DSS自由饮水4 d后改用正常饮水17 d;第3个周期采用2%DSS自由饮水4 d后改用正常饮水至结束(见图1)。每日称量体质量,观察并记录大鼠大体情况,造模结束随机抽取2只麻醉后,沿着结肠系膜剖开肉眼下观察肿瘤是否生成,以评价模型建立是否成功。

图1 结肠炎相关性结肠癌大鼠模型构建流程图
1.4 分组方法
为了观察隔药灸和隔姜灸对大鼠CAC的干预作用,将18只CAC大鼠采用分层随机法分为CAC组、隔药灸组和隔姜灸组,每组6只。CAC组和正常组均不进行任何干预,做与隔药灸组和隔姜灸组相同的固定;隔药灸组和隔姜灸组于造模结束后次日开始相应干预,共干预30 d。
1.5 治疗方法
取天枢(双)、气海穴,穴位定位参考《实验针灸学》[12]。于造模结束当日用实验动物专用除毛器将各治疗组大鼠腹部天枢及气海穴附近鼠毛剃除,第 2天起予以灸法干预。每日固定时间操作,室温控制在(25±1)℃,相对湿度为(55±10)%RH,风速≤1 m/s,操作前大鼠适应环境20 min,尽可能避免不必要的干扰。
1.5.1 隔药灸治疗
将附子(四川)、肉桂(广西)、木香(云南)等药研末与黄酒调和,采用特制模具按压成直径 0.8 cm、厚0.4 cm的药饼,在药饼上放置艾炷(重量约90 mg)对相应穴位进行隔药灸治疗。每日1次,每次每穴灸2壮,每周6次,共灸30次。
1.5.2 隔姜灸治疗
选用新鲜生姜,沿生姜纤维纵向切取直径0.8 cm、厚0.4 cm的姜片,在姜片上放置艾炷(重量约90 mg)对相应穴位进行隔姜灸治疗。每日1次,每次每穴灸2壮,每周6次,共灸30次。
1.6 动物标本取材
2%戊巴比妥钠(40~50 mg/kg)腹腔注射麻醉大鼠,待麻醉成功后,将大鼠固定于解剖板上,自耻骨联合处-盲肠取下约5 cm的结肠,沿肠系膜纵行剖开结肠,结肠予生理盐水冲洗后,观察结肠大体情况,肉眼观察并记录瘤体数量,剪下一段长约1 cm含瘤体的结肠,固定于 4%多聚甲醛中,剩下的结肠剪碎混合后平均分成 2份,置液氮1 h后,于﹣80℃冰箱保存备用。
1.7 观察指标
1.7.1 大鼠一般情况观察、DAI和成瘤率观察
每日观察各组大鼠一般情况,包括体质量、毛色、活动度、大便性状等。比较各组大鼠体质量、疾病活动指数(disease activity index,DAI)[13]和结肠成瘤率。DAI=(体质量下降分数+粪便性状分数+隐血分数)/3。
1.7.2 大鼠结肠组织病理学观察
将含瘤体的结肠组织脱水、包埋,4 μm厚度连续切片,展片烤片。取瘤体部位切片观察。采用苏木精伊红(hematoxylin-eosin,HE)染色法染色。具体步骤如下,切片脱蜡至水,二甲苯Ⅰ、Ⅱ各15 min,100%、90%、80%、70%梯度乙醇各5 min,双蒸水漂洗5 min×2次,苏木精染色液2 min,流水冲洗10 min,1%盐酸乙醇分化约 5 s,流水冲洗 5 min,伊红染色液 2 min,70%、80%、90%、100%梯度乙醇脱水各 8 s,二甲苯Ⅰ、Ⅱ透明各15 min,中性树脂封片,光学显微镜下观察。
1.7.3 采用Western Blot法检测P2X7R蛋白表达
取大鼠结肠组织剪碎后研磨,经RIPA裂解、离心取上清等流程后,取部分上清蛋白用 BCA蛋白浓度测定试剂盒测定蛋白浓度。后进行电泳、转膜后加入5%BSA室温封闭2 h,并加入封闭液稀释的兔抗大鼠一抗P2X7R(1:1000),4℃孵育过夜。TBST洗膜5 min×3次,后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔二抗(1:2000)室温孵育2 h,暗室中用X胶片感光、显影、定影。采用P27XR与内参GAPDH两者灰度值的比值作为统计依据。
1.7.4 采用RT-qPCR法检测C-myc、GSK3β、Wnt1和β-catenin的mRNA表达
大鼠结肠组织经研磨后采用 Trizol裂解方法提取总 RNA,按顺序加入试剂与反应物进行逆转录反应后,进行聚合酶链反应。扩增引物序列见表1。反应条件为95℃ 2 min,1个循环;94℃ 10 s,60℃ 10 s,72℃40 s,40个循环。采用2﹣△△Ct法对所得数据进行分析,得到所有基因的Ct值后,根据公式△Ct值=目的基因Ct值-内参基因Ct值,计算出每一个基因的△Ct值,然后用各组样本的△Ct值减去模型组样本的△Ct值,对所有数值取相反数,得到﹣△△Ct值,最后对﹣△△Ct值进行2的幂运算,即2-△△Ct值。

表1 引物碱基序列
1.8 统计学方法
采用SPSS22.0统计软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态分布且方差齐的计量资料用均数±标准差表示,采用单因素方差分析(One-way ANOVA),若有统计学差异,则进一步采用LSD法进行组间两两比较;不符合正态分布或方差不齐的数据,用非参数检验,若有统计学差异,则进一步采用Dunnett’s T3法进行组间两两比较。检验水准α=0.05,以P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠一般情况观察
干预结束后,正常组大鼠活动正常,反应敏捷,皮毛柔顺有光泽,大便正常;CAC组大鼠精神萎靡,皮毛蓬乱,松散易脱落,肛门处有鲜血,大便表面覆有鲜血;隔药灸组、隔姜灸组大鼠皮毛欠光泽,活动略迟缓,便血量较CAC组有所减少,精神状态有所改善。
2.2 各组大鼠体质量、DAl、结肠成瘤率比较
从图2A、2B可见,与正常组相比,CAC组大鼠体质量显著降低,DAI显著增高(P<0.05);与CAC组相比,隔药灸组和隔姜灸组大鼠体质量均显著增加,DAI显著降低(P<0.05)。图 2C为大鼠结肠大体形态显示,可见CAC组、隔药灸组和隔姜灸组大鼠结肠瘤体形成。CAC组大鼠成瘤率83.3%,隔姜灸组为20.0%,隔药灸组为 33.3%,CAC组大鼠成瘤率与隔姜灸组比较,差异有统计学意义(P<0.05),提示隔药灸和隔姜灸均能显著改善CAC大鼠体质量降低、便血等一般情况,且隔姜灸对瘤体生长有一定的抑制作用。
2.3 大鼠结肠瘤体组织形态学观察
由图3可见,正常组大鼠结肠黏膜结构清晰,结肠上皮组织完整,腺体排列整齐,黏膜固有层可见毛细血管和少量散在的淋巴细胞,无明显的炎性细胞浸润,未见充血、水肿等;CAC组大鼠结肠上皮细胞排列较乱、大小不一、形态多样、极性消失,细胞核大而浓染,核质比例增大,核分裂增多,可见腺管共壁背靠背和筛样结构,高级别腺癌形成,腺腔内多见脱落坏死的瘤细胞、浸润的炎性细胞及呈团状的嗜酸性物质(红色箭头标示);隔药灸组大鼠结肠上皮细胞增生,排列不齐,炎性细胞浸润和黏膜充血水肿程度较 CAC组减轻,可见异性增生。隔姜灸组大鼠结肠上皮细胞增生,核浓染,淋巴细胞浸润,固有腺体萎缩,异型增生与CAC组相比程度较低。

图2 大鼠体质量、DAl和结肠成瘤率比较

图3 大鼠结肠组织HE染色(×200)
2.4 大鼠结肠组织P2X7R蛋白表达
由图4可见,与正常组相比,P2X7R在CAC组大鼠结肠组织中的表达下调,差异有统计学意义(P<0.05);与CAC组相比,P2X7R在隔药灸组和隔姜灸组大鼠结肠中的表达均上调,差异均有统计学意义(P=0.006,P=0.003),提示隔药灸和隔姜灸能显著上调 CAC大鼠结肠异常表达的P2X7R蛋白。
2.5 大鼠结肠组织mRNA表达
由图5可见,与正常组相比,C-myc、β-catenin、GSK-3β、Wnt1 mRNA在CAC组大鼠结肠组织中的表达上调,差异均有统计学意义(P<0.05);与CAC组相比,C-myc mRNA在隔药灸组和隔姜灸组大鼠结肠组织中的表达下调,差异有统计学意义(P<0.05),β-catenin、GSK-3β、Wnt1 mRNA在隔姜灸组大鼠结肠组织中表达显著下调,差异有统计学意义(P<0.05)。

图4 大鼠结肠组织P2X7R蛋白表达
结果提示隔药灸和隔姜灸对 CAC大鼠Wnt/β-catenin通路发挥了负性调控作用,隔姜灸对异常高表达的β-catenin、GSK-3β、Wnt1 mRNA下调趋势优于隔药灸。
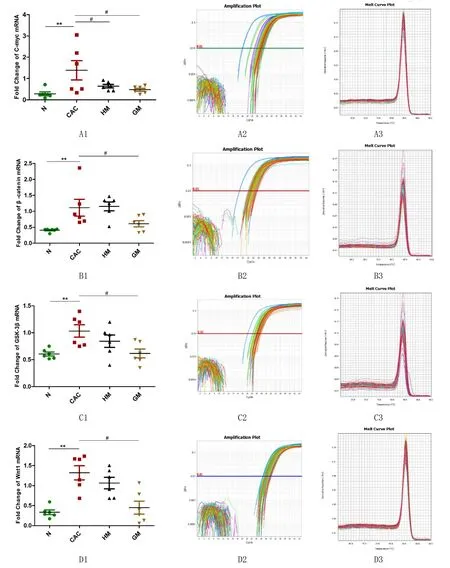
图5 大鼠结肠组织C-myc、β-catenin、GSK-3β、Wnt1 mRNA表达
3 讨论
嘌呤受体P2X7R广泛参与炎症反应,在DSS诱导的结肠炎小鼠结肠组织表达增加,在结肠炎相关癌变的肿瘤中也有表达[4]。P2X7R是肿瘤传送ATP信号的中央控制节点,以其为核心的 P2X7/PIDK/AKT轴和 P2X7/AMPK/PRAS40/mTOR信号轴调控肿瘤的生长与自噬,调节肿瘤细胞存活与死亡之间的平衡[14]。研究表明,P2X7R在小鼠CAC进展过程中具有一定的抑制作用。使用P2X7R拮抗剂可减缓CAC小鼠的体质量增长,促进肠道肿瘤的形成,降低小鼠生存率;而P2X7R激动剂则表现出对CAC小鼠肠道肿瘤形成的抑制作用[15]。本研究结果显示,P2X7R在CAC组大鼠结肠组织中的表达显著低于正常组,经隔药灸和隔姜灸干预后,CAC大鼠结肠组织中 P2X7R的表达上调,提示隔药灸和隔姜灸可能通过激活CAC大鼠结肠中P2X7R的表达,起到抑制结肠肿瘤生长的作用。
CAC是涉及多基因、多信号通路的复杂过程。Wnt/β-catenin信号通路在结肠上皮再生和肿瘤发展中至关重要。Wnt通路调控β-catenin磷酸化、β-catenin核内异常转录介导 CAC发生[6]。有研究表明,P2X7R还能通过抑制 GSK3β进而抑制 Wnt/β-catenin通路的信号转导[5]。在结肠炎症介导的癌症 CAC中,C-myc、Wnt、β-catenin均属促癌基因,抑制异常激活的Wnt/GSK3β/β-catenin通路的信号转导,可延缓 CAC肿瘤进展[7-9]。生理条件下,β-catenin的活性受到严格的控制,在病理状态下可因肿瘤抑制基因APC的灭活导致对β-catenin的控制解除,继而活化NF-κB信号,对结直肠癌的形成具有重要作用[16]。本研究结果表明,隔姜灸在 CAC大鼠的 Wnt/β-catenin通路中发挥了重要的调控作用,主要表现在抑制 Wnt家族中Wnt1和β-catenin的异常高表达,这可能是隔姜灸干预CAC的效应机制之一。β-catenin的氨基末端含有数个 GSK-3β磷酸位点,羟基末端有活化相应靶基因转录的功能,中间区域含有 APC蛋白、T细胞因子(TCF)结合位点,当 APC-Axin-GSK3β降解复合体形成受阻,导致β-catenin无法磷酸化使其泛素化降解,在胞浆内聚积,并进入细胞核内与 TCF/LEF转录因子结合,作用于下游C-myc等基因的启动子上,导致相关基因的表达异常,促进结直肠肿瘤的发生[17]。值得注意的是,GSK-3β是一种功能复杂的多功能激酶,在肿瘤的进程中有双向调节的作用[18]。作为促瘤因子或是抑瘤因子取决于肿瘤的类型、发展阶段、遗传背景[19]。本研究结果中,GSK-3β mRNA在CAC组大鼠结肠组织表达显著高于正常组,经隔姜灸干预后表达显著降低,提示隔姜灸可能通过抑制GSK-3β的表达,起到延缓CAC大鼠结肠肿瘤生长进程的作用。
本次研究设置了两种干预方法,即隔药灸和隔姜灸。两种灸法均是临床治疗IBD等肠腑病症的常用灸法[20-22]。本研究结果显示,两种灸法在效应和机制部分均有共通之处,也有所差异。相同点为隔药灸和隔姜灸对CAC大鼠体质量、DAI均有显著的改善作用,均能上调CAC大鼠结肠组织P2X7R蛋白表达,下调C-myc mRNA水平;不同点为隔姜灸干预后大鼠结肠成瘤率显著降低,隔姜灸组大鼠结肠组织β-catenin、GSK-3β、Wnt1 mRNA表达水平均显著下调。提示隔姜灸可能是通过对 CAC大鼠的 P2X7R、Wnt/β catenin通路异常激活进行调节发挥作用。隔药灸和隔姜灸均为艾灸疗法,均有温热物理刺激,天枢和气海穴均能调节胃肠功能,艾灸天枢和气海可明显减轻溃疡性结肠炎的肠道炎症反应,故在结肠炎相关性结肠癌中也选择了天枢、气海。所以两种灸法均可一定程度上抑制肿瘤的生长,均能抑制促癌基因C-myc的表达,调节嘌呤受体P2X7R的表达。两种灸法均为隔物灸,所隔物质不同,可能导致其作用机制不尽相同。
综上所述,隔药灸、隔姜灸均能显著改善CAC大鼠一般情况,对炎症介导的结肠肿瘤生长具有一定的抑制作用。本研究采用AOM诱导,3%-2%-2% DSS多个浓度的刺激制备CAC模型,在CAC大鼠结肠组织中发现特征性癌变,在隔药灸和隔姜灸组均见到肿瘤和异型增生等组织形态学变化,但未见癌变,说明艾灸疗法能不同程度抑制炎症介导的肿瘤生长。在前期观察到艾灸能抑制P53和促癌基因C-myc表达的基础上,切入炎症和炎症相关性癌变中均有重要生物学功能的嘌呤受体P2X7R,发现艾灸能促进CAC大鼠结肠组织P2X7R蛋白表达以及抑制C-myc的异常表达。在隔姜灸组,还发现隔姜灸可能抑制了异常激活的 Wnt/GSKβ-β/catenin信号通路。由于本实验目前只检测了该通路中4个关键蛋白的mRNA表达,后续研究将进一步开展蛋白检测,拟阐释艾灸在 CAC大鼠 Wnt/GSKβ-β/catenin信号通路中的作用。本研究仅采用常规的现代分子生物学技术和方法研究,尚未从P2X7R深入探讨艾灸对CAC大鼠的作用机制。为了能更明确说明艾灸对炎症介导肿瘤的作用机制,今后研究的方向一方面要切入 DSS诱导的溃疡性结肠炎,明确P2X7R在炎症中的作用;另一方面,在 AOM-DSS诱导的结肠炎相关性癌变中,将采用P2X7R的激动剂和抑制剂,结合P2X7R基因敲除小鼠反向验证,从多个方面说明艾灸对炎症和炎症相关性肿瘤的效应机制。

