上海地区PIK3CA基因突变检测室间质量评价分析*
王雪亮,徐幸,魏萌,孔骏,肖艳群,周靖(上海市临床检验中心分子生物学室,上海200126)
磷脂酰肌醇-3-激酶催化亚单位α(phosphatidylinositol-4,5-Bisphosphate 3-Kinase,PIK3CA)是Ⅰ类磷脂酰肌醇-3-激酶p110α催化亚基的编码基因。作为PI3K-AKT-mTOR信号通路关键组成部分,PIK3CA基因突变会导致肿瘤患者对表皮生长因子受体等靶向药物耐药,从而使得治疗效果不佳[1-2]。因此,治疗前准确了解PIK3CA突变状态,对指导肿瘤患者用药并降低治疗风险具有重要意义。
当前临床上PIK3CA突变检测常用方法有扩增阻滞突变系统(amplification refractory mutation system,ARMS)、Sanger测序、高通量测序(next-generation sequencing,NGS)等。除了方法学众多外,还有较多的实验室自建方法,不同方法检测结果可能存在差异。先前研究表明,实验室间分子病理检测项目结果一致性较差[3-5],但目前尚未见PIK3CA突变检测能力评估的报道。因此,本研究拟开展PIK3CA基因突变检测的室间质量评价,以期发现实验室相关项目存在的问题,进一步改善和提高其检测质量。
1 材料与方法
1.1样本 室间质评样本购自菁良基因科技(深圳)公司,其通过基因编辑或者细胞筛选方法得到具有明确PIK3CA突变(H1047R、E545K、E542K)的细胞及野生型细胞,而后经福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded,FFPE)制备而成。FFPE样本经微滴式数字PCR检测,突变型样本的突变比例约为50%。每支样本管中放置1卷蜡片,组织厚度为15~20 μm,置于2~8 ℃保存。
1.2主要仪器与试剂 ABI 7500荧光定量PCR仪、NanoDrop One超微量紫外分光光度计(美国Thermo Fisher Scientific公司);Centrifuge 5424R高速离心机(德国Eppendorf公司)。人类PIK3CA基因突变检测试剂盒(荧光PCR法)、FFPE DNA核酸提取试剂(厦门艾德生物医药科技公司)。
1.3室间质评样本的分析
1.3.1样本DNA提取与检测 取不同PIK3CA基因型FFPE样本,使用FFPE DNA核酸提取试剂提取DNA,纯化的DNA用NanoDrop One超微量分光光度计测定其浓度。将测定的DNA浓度稀释至2.0 ng/μL,按照PIK3CA基因突变试剂盒及ABI 7500荧光定量PCR仪说明书操作进行检测,以验证不同PIK3CA样本是否与预期基因型相符。
1.3.2均匀性评价 参照CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》[6]中关于均匀性的评价要求,每批室间质评样本随机抽取10支,采用PIK3CA基因突变试剂盒检测,每支测定1次。
1.3.3稳定性评价 在参评实验室上报结果后3 d,随机抽取2~8 ℃保存的各基因型室间质评样本6支,采用PIK3CA基因突变试剂盒检测,每支测定1次,以评估其同步稳定性。
1.4室间质量评价的实施
1.4.1方案设计 2018年和2019年室间质评样本盘包括5支样本,其中突变型样本3~4支,野生型样本1~2支。为防止参评实验室串通数据,每套样本盘的样本进行随机编号。
1.4.2组织形式 本项目室间质评活动为自愿参加,上海市临床检验中心作为CNAS认可的能力验证提供者,样本盘经冷链运输至各参评实验室,不指定检测方法,要求其在规定时间内(自样本接收2周内)用实验室常规检测系统检测,结果通过网络系统上报。
1.4.3结果评价 依据回报结果,按以下原则进行判定:野生型样本不能检出突变型,突变型样本不能检出野生型或其他突变型。参评实验室室间质评成绩=符合的样本数/总样本数×100,100分为成绩优秀,80~99分为成绩合格,小于80分为不合格。同时,计算各样本的整体符合率、假阳性率和假阴性率。
2 结果
2.1室间质评样本验证 对不同基因型FFPE样本进行核酸抽提,经分光光度法测得H1047R、E545K、E542K和野生型基因组DNA平均含量分别为905.7 ng、977.2 ng、829.8 ng和784.3 ng,可满足不同突变检测方法对样本的需要量。ARMS检测结果证实不同FFPE样本均含有预期PIK3CA基因型,见图1。
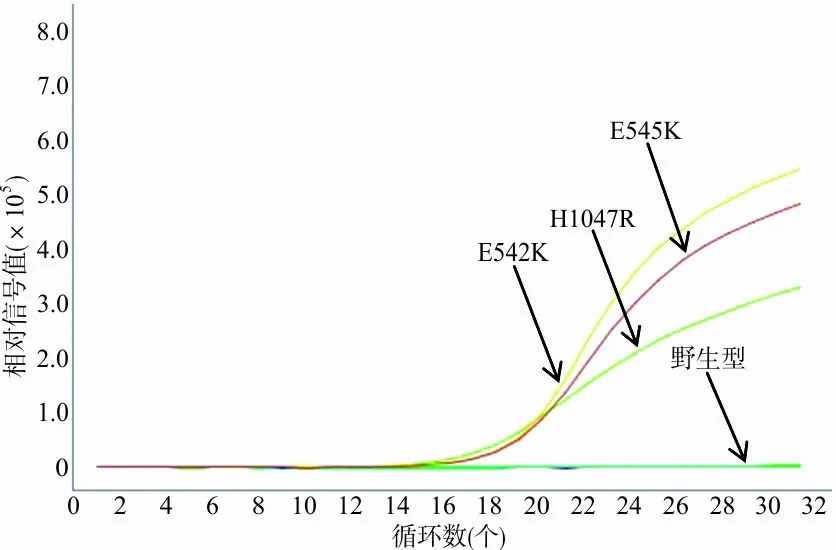
图1 PIK3CA室间质评样本荧光PCR扩增曲线
2.2均匀性评价 随机抽取的10支突变型FFPE样本的检测结果均为预期PIK3CA突变型,野生型FFPE样本经检测无特异性扩增曲线,按照试剂盒结果判定规则判为野生型,表明室间质评样本的均匀性良好。
2.3稳定性评价 参评实验室上报结果后3 d检测2~8 ℃保存的FFPE样本,结果显示均为预期PIK3CA基因型,表明该样本在冷藏过程中具有良好稳定性,可满足室间质评样本传递要求。
2.4参评实验室整体回报情况 2018年和2019年报名参加PIK3CA基因突变检测室间质评的实验室分别为30家和22家,规定时间内收到有效回报结果分别为28份和19份,有效回报率分别为93.3%和82.6%。2018年参评实验室中8家为医院病理科,20家为医学检验所;2019年参评实验室中6家为医院病理科,13家为医学检验所。
2次室间质评活动中,参评实验室中最常用方法为ARMS法(64.3%和73.7%),其次为NGS(21.4%和15.8%)、Sanger测序(10.7%和5.3%)和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF MS)法(3.6%和5.3%),见表1。
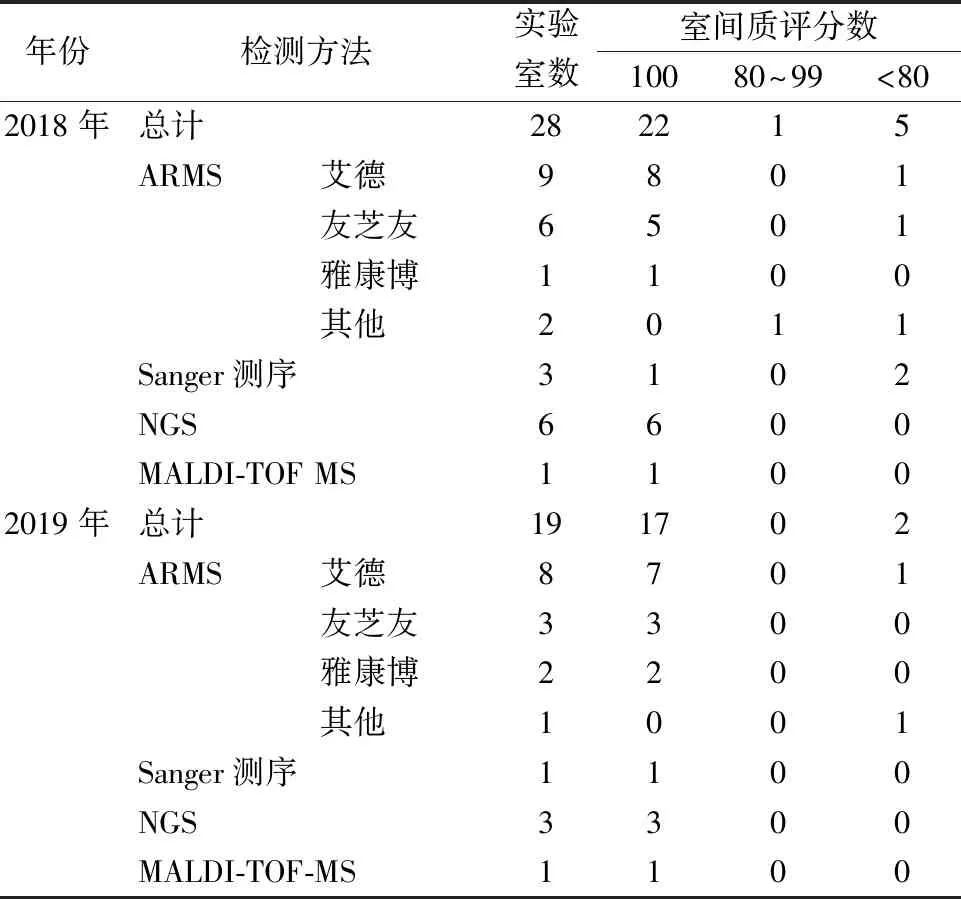
表1 参评实验室所用方法和检测能力
注:其他,指参评实验室自建ARMS方法。
2.5室间质评结果评价 按照结果评价原则,2018年22家实验室(78.6%)回报结果完全正确(100分),1家实验室(3.5%)成绩合格(80分),5家实验室(17.9%)成绩不合格(<80分);2019年17家实验室(89.5%)回报结果完全正确(100分),2家实验室(10.5%)成绩不合格(<80分),见表1。
2次室间质评活动中,2018年和2019年样本的整体符合率为86.4%和93.7%。除2019年野生型样本全部合格外,其余9支样本均出现检测不合格情况,其中1812(E545K)样本符合率最低为82.1%。不合格结果中,2018年有4家实验室出现12个假阳性结果,5家实验室出现7个假阴性结果,其中2家实验室各自检测的5个样本均不合格;2019年2个假阳性结果和4个假阴性结果均出自2家实验室,其余实验室回报结果全部正确,见表2。
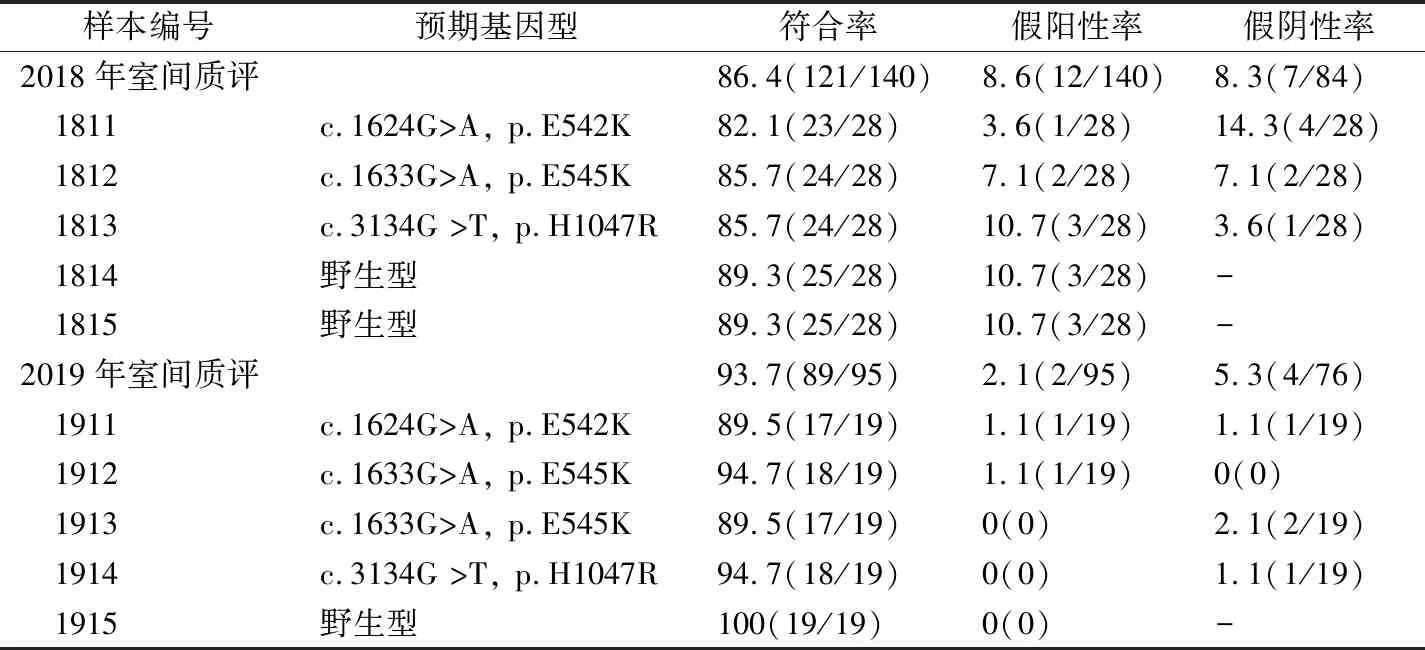
表2 PIK3CA基因突变检测样本盘组成和室间质评结果[%(n)]
3 讨论
近些年来,针对特定靶点的分子靶向药物越来越多地应用于临床,极大地改善了肿瘤患者预后并提高了其生存期。PIK3CA基因作为肿瘤靶向治疗的重要预测因子,准确地检测其突变状态对于筛选合适的肿瘤患者进行靶向药物治疗至关重要。为全面评估临床实验室相关项目检测质量,本中心组织实施了PIK3CA基因突变检测室间质量评价。
两次室间质评结果显示成绩优秀实验室分别为78.6%和89.5%,这表明参评实验室突变检测能力短期内得到较大提高,但仍有进步空间。与先前报道相一致[3-5],假阳性和假阴性结果为主要错误类型,这将对肿瘤患者后续用药造成极大不利影响。假阳性情况在2018年室间质评中表现更为明显,4家实验室共计回报12个假阳性结果,其中1家实验室出现5个错误突变的假阳性结果(均包含E545A突变)。推测其主要原因可能是人员操作(如交叉污染)或实验室污染(如气溶胶)所致。因此,实验室应进一步强化人员培训并严格采取分区操作的措施,且在检测过程中需加入阴性质控品,从而最大程度避免假阳性情况发生。2018年室间质评后参评实验室通过针对性整改,2019年室间质评假阳性结果大幅降低(仅2个)也进一步证明了上述结论。两次室间质评的假阴性率分别为8.3%和5.3%,变化幅度不大。但63.6%(7/11)的假阴性结果是由实验室自建方法(Sanger测序和ARMS法)回报,这可能和实验室未对其进行充分的性能确认相关[7]。其他假阴性结果可能为人员操作不当导致,如DNA抽提得率低、错加或漏加样本等。但需指出的是,两次室间质评中实验室间错误情况重复性低,不同检测方法和突变检测的错误情况无直接相关性。
不同样本类型可用于分子病理项目的室间质评活动中,包括患者组织样本、质粒DNA、细胞系等[8]。其中细胞系制备的FFPE样本具有易于大批量制备、稳定性好、可充分模拟临床样本进行检测全程监控等优点。此外,还可将突变型和野生型细胞系进行不同比例混合,从而制备含有不同突变比例的FFPE样本[9]。因此,本研究选用细胞系制备的突变比例约为50%的FFPE样本,包含临床最为常见的E542K、E545K和H1047R 3种热点突变[10]。其均匀性和稳定性良好,可替代临床组织样本用于PIK3CA基因突变检测能力的评估。考虑当前临床样本多为小活检或细胞学样本,今后室间质评中还需适当降低每张切片的肿瘤细胞数量,以更好满足临床小样本的突变检测需求。
综上所述,本研究结果表明大部分实验室PIK3CA突变检测能力良好,但部分实验室检测能力尚需提高。室间质量评价可改进并提高临床实验室检测质量,从而为临床合理靶向用药提供更为有效地指导和帮助。此外,本次室间质评主要针对分析中过程,今后我们也将重点对PIK3CA突变的分析前(如肿瘤细胞比例)和分析后(如报告阐述)过程进行评估,以便更加全面地评价临床实验室的检测能力。

