基于信号增强的电化学发光适配体传感器检测三磷酸腺苷
姚 武崔 朋胡晓倩
(1.黄山学院化学化工学院,安徽黄山 245041; 2.黄山学院生命与环境科学学院,安徽黄山 245041)
1 引 言
电化学发光(Electrochemiluminescence,ECL)是基于电极反应产物之间或电极反应产物与体系中组分之间进行化学反应,使得发光信号分子产生激发态,然后发光信号分子从激发态跃迁回基态而产生的一种光辐射,是通过电化学反应直接或间接引发的化学发光现象[1-2]。由于ECL分析技术是电化学分析和化学发光分析技术结合的产物,兼具二者的特点和优势,因此得到了国内外众多学者的广泛关注,相关研究和应用得到了长足的发展,特别是在检测传感器研究方面得到了比较广泛的应用。
适配体(Aptamer)是通过体外筛选、指数富集的系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)获得,可以折叠成特定三维结构,通过空间构型互补以及静电、氢键等作用与靶分子特异性结合的一段单链寡核苷酸序列(DNA或RNA)[3-5]。适配体与靶分子之间的分子识别功能与抗体抗原相似,但适配体作用的靶分子范围更广,且具有核酸自身稳定性强、变性复性快速可逆、易功能化修饰与标记等诸多优点,已在生命、医学、化学、环境等众多领域得到应用。
近年来,人们把适配体的分子识别功能和电化学发光的信号指示功能结合起来,构建出一系列功能各异、性能优越的电化学发光适配体型(ECL-aptamer)传感器。该类传感器已被广泛研究应用于 miRNA[6]、蛋白[7-10]、酶[11-13]、毒素[14-16]、肿瘤细胞[17-20]、肿瘤坏死因子[21]、金属离子[9,22]等的分析检测。但该类型传感器应用于三磷酸腺苷(ATP)的含量检测少有报道[23-24]。ATP适配体寡核酸链可以显著增强溶液中[Ru(bpy)2dppz]2+分子的ECL信号。当ATP分子与适配体作用后,[Ru(bpy)2dppz]2+分子的ECL信号明显减弱。Xu研究组[23]借助该现象建立了ATP含量的检测方法,检测限为100 nmol/L,检测线性范围为0.2~1.0 μmol/L。Ju小组[24]利用 ATP适配体互补DNA和G四链体DNA核酸酶双标记纳米金颗粒。当ATP的量越多,能够通过与适配体杂交连接到电极表面的纳米金颗粒数量就越少,DNA核酸酶催化还原溶液中作为量子点ECL共反应物的溶解O2也越少,则电极表面量子点的ECL信号越强。据此建立的电化学发光适配体型传感器用于ATP含量检测,检测限为7.6 nmol/L,检测线性范围为8~2 000 nmol/L。
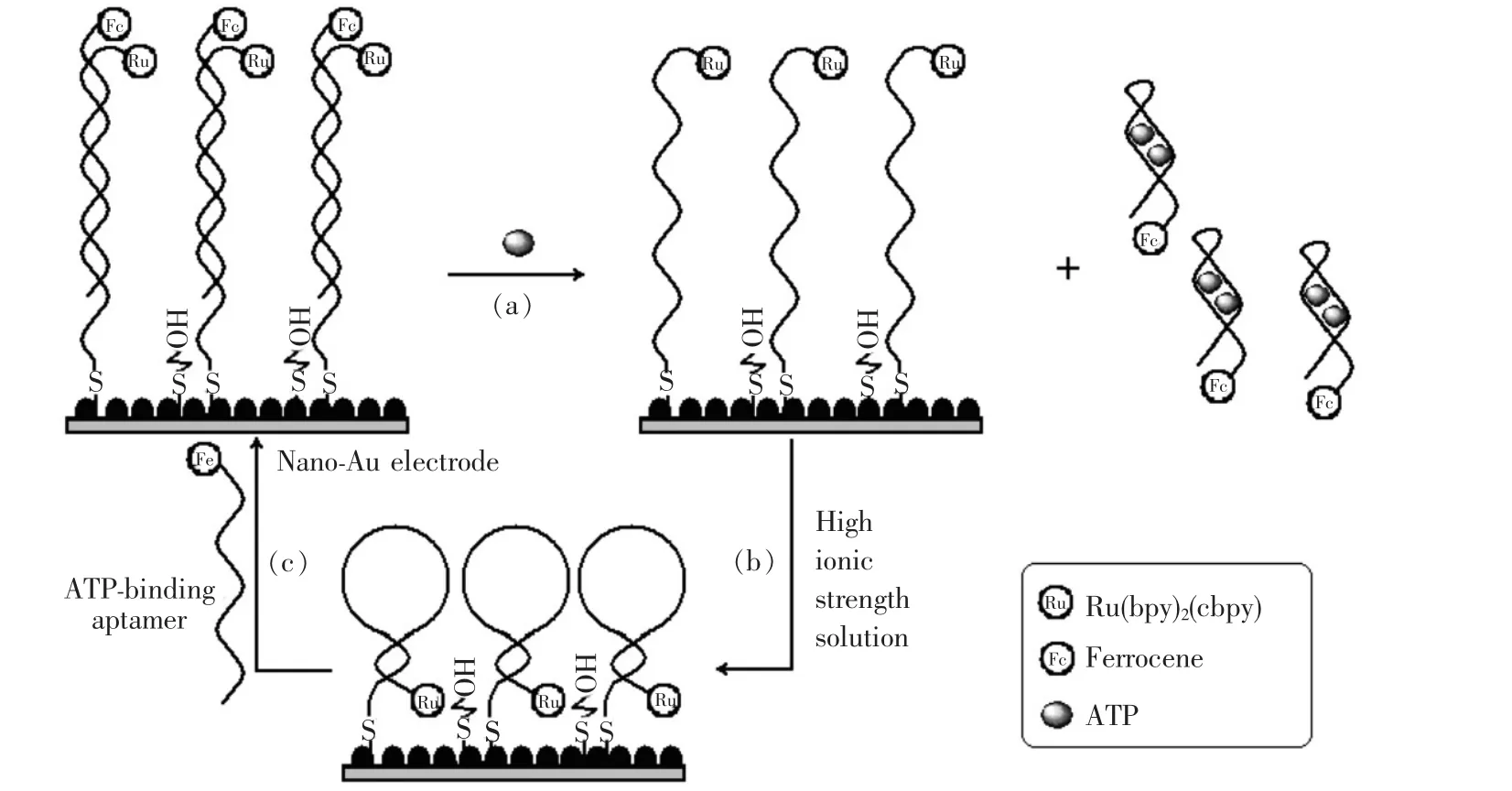
本文在前期工作[25]的基础上,借助纳米金电极增加探针DNA(pDNA)组装量和二茂铁分子猝灭联吡啶钌ECL信号,建立了一种灵敏度更高、检测范围更宽的电化学发光适配体型ATP检测传感器。两端含6个互补碱基的单链pDNA,先通过3′分子端修饰的氨基标记上电化学发光信号联吡啶钌,再利用5′端修饰的巯基自组装到纳米金电极表面。电极表面的pDNA与通过5′端修饰的氨基标记二茂铁分子的ATP适配体杂交形成刚性线形的双链DNA,从而构建出电化学发光适配体型ATP检测传感器。在ATP分子与适配体作用之前,传感器表面的pDNA与互补ATP适配体呈刚性线形的双螺旋结构,使得pDNA 3′端的联吡啶钌分子远离纳米金电极表面,导致ECL信号较弱。同时,又由于适配体5′端标记的二茂铁分子对联吡啶钌分子的电化学发光具有猝灭作用,使得此时的ECL信号更弱。当ATP与适配体作用形成适配体-ATP复合物离开电极表面,而后电极表面的pDNA在高离子强度溶液中形成发夹型的茎环构象,使得ECL信号分子联吡啶钌与金电极表面靠近,产生显著增强的ECL信号,如示意图(用于ATP检测的电化学发光适配体传感器原理图)(a)、(b)所示。ECL信号的增强幅度与ATP浓度的对数值具有良好的线性关系,从而可以对ATP的含量进行高灵敏度的检测,并获得更宽的检测范围。如示意图(c)所示,形成颈环结构的pDNA可以重新与ATP适配体杂交形成刚性线形的双链DNA结构,使得该传感器具有再生性能。
2 实 验
2.1 试剂和仪器
三磷酸腺苷(ATP)、三磷酸胞苷(CTP)、ATP适配体以及与适配体互补的探针DNA(pDNA)均购于上海生工生物工程技术和服务有限公司。5′端氨基修饰的ATP核酸适配体碱基序列为5′-NH2-(CH2)6-GCA CCT GGG GGA GTA TTG CGG AGG AAG GT-3′,其互补的 pDNA 序列为 5′-HS-(CH2)6-GCA CCT TCC TCC GCA ATA CTC CCC CAG GTG C-(CH2)6-NH2-3′。pDNA序列的两端为6个互补的碱基,以利于形成茎环结构的分子构象,5′端是巯基修饰,用于pDNA在纳米金电极上通过 Au—S键进行自组装。 二-(2,2′-联吡啶)-4′-甲基-4-羧基联吡啶合钌(Ⅱ)琥珀酰胺酯-二-六氟磷酸盐(Ru(bpy)2(cbpy)NHS)购于Fluka化学试剂公司,三-(2-羧基乙基)膦盐酸盐(TCEP)、N,N′-二环己基碳二亚胺(DCC)和 2-巯基乙醇(ME)购于Alfa Aesar中国(天津)有限公司,三丙基胺(TPA)购于ACROS化学试剂公司,N-羟基琥珀酰亚胺(NHS)购自百灵威化学试剂公司,二茂铁甲酸(Fc-COOH)购于江苏威特化工厂。所有其他试剂均为分析纯,未纯化使用。
CHI660c型电化学工作站(上海晨华仪器公司)用于控制电极反应,BPCL-2-KIC型超微弱发光分析仪(中科院北京生物物理研究所)用于电化学发光信号采集,日立U-3010型紫外分光光度计(Hitachi,Japan)用于测定紫外-可见光谱。
2.2 探针pDNA-Ru和aptamer-Fc的合成
按照文献[26]方法合成联吡啶钌标记的探针DNA(pDNA-Ru)和二茂铁标记的适配体(aptamer-Fc),合成产物用紫外-可见光谱表征。
2.3 ECL-aptamer传感器的构建
金电极用α-Al2O3粉抛光成镜面后,再分别在高纯水、无水乙醇、高纯水中超声清洗,然后在0.50 mmol/L的H2SO4溶液中进行循环伏安扫描,扫描电位为-0.2~1.7 V,扫速为0.1 V/s,直到出现典型且稳定的金电极扫描特征曲线。取出金电极,用高纯水清洗干净,并用高纯氮气吹干。该电极再在3.0 mmol/L HAuCl4(0.10 mol/L KNO3)溶液中,在-0.2 V电位下进行恒电位电解60 s,得纳米金电极。取出电极用高纯水冲洗干净后,重新在0.50 mol/L的H2SO4溶液中以相同电位范围和扫速进行循环伏安扫描,直到出现典型且稳定的金电极扫描特征曲线,取出后用高纯水清洗干净,并用高纯氮气吹干待用。
将处理干净并吹干的纳米金电极迅速插入500 μL 1.0 μmol/L 的 pDNA-Ru 溶液中,在室温下浸泡12 h,pDNA-Ru通过金硫键自组装上纳米金电极表面,用10.0 mmol/L的PBS(pH=7.4)淋洗电极表面,洗去没有键合的探针pDNA-Ru。该电极再在2.0 mmol/L ME(10.0 mmol/L PBS,1.0 mol/L NaCl,pH =7.4)溶液中浸泡钝化1 h,除去非特异性键合的pDNA-Ru和封闭没有键合上探针DNA的纳米金电极表面位点。该修饰电极再浸入500 μL 0.50 μmol/L 的aptamer-Fc 溶液(10.0 mmol/L PBS,0.10 mol/L NaCl,5.0 mmol/L MgCl2,pH =7.4)中,于 37 ℃孵化 1 h,探针 pDNA-Ru与aptamer-Fc杂交生成刚性线形的双螺旋DNA(ds-DNA-Ru-Fc)。所得电极用10.0 mmol/L PBS(pH=7.4)溶液淋洗后作为ECL-aptamer传感器待用,并用循环伏安曲线和电化学阻抗谱对其进行表征。
2.4 电化学发光信号检测
ECL-aptamer传感器在500 μL不同浓度的ATP 溶液(10.0 mmol/L PBS,0.10 mol/L NaCl,pH=7.4)中37℃孵化40 min后,经10.0 mmol/L PBS(pH=7.4)缓冲溶液清洗,室温浸泡在1.0 mol/L NaCl(10.0 mmol/L PBS,5.0 mmol/L MgCl2,pH=7.4)溶液30 min。电极取出后用0.10 mol/L的PBS缓冲溶液淋洗电极表面,再在2.0 mL 0.10 mol/L TPA(0.10 mol/L PBS,pH =7.4)溶液中,于0~0.75 V电位范围、100 mV/s扫速下进行循环伏安扫描,同时记录电化学发光信号。
3 结果与讨论
3.1 pDNA-Ru和aptamer-Fc的表征
合成的探针pDNA-Ru用紫外-可见光谱进行表征,如图1所示。图1中曲线a、b、c分别为探针pDNA、Ru(bpy)2(cbpy)NHS和pDNA-Ru的紫外-可见吸收光谱。插图是pDNA-Ru在400~500 nm范围吸收光谱曲线的放大,其中448 nm的吸收峰与Ru(bpy)2(cbpy)NHS的452 nm吸收峰对应,是联吡啶钌金属离子到配体电子转移的特征吸收带,说明联吡啶钌已经被标记到探针pDNA链上。
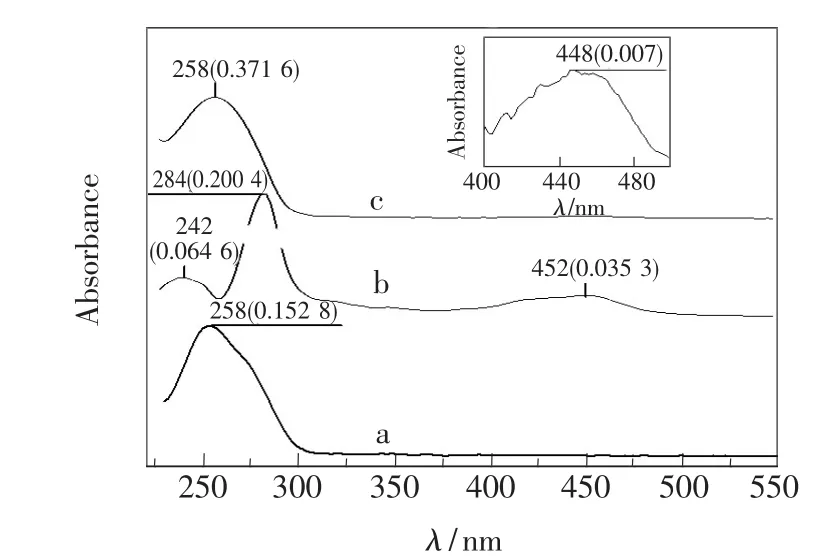
图1 pDNA(a)、Ru(bpy)2(cbpy)NHS(b)和 pDNA-Ru(c)的紫外-可见吸收光谱。插图:pDNA-Ru在400~500 nm范围吸收光谱曲线的放大。注:“258(0.371 6)”含义为吸收峰波长258 nm,相对于基线的吸光度值0.371 6。Fig.1 UV-Vis absorption spectra of pDNA(a),Ru(bpy)2-(cbpy)NHS(b)and pDNA-R(c).Inset:amplification of the absorption spectrum curve of pDNA-Ru in the range of 400-500 nm.Note: “258(0.371 6)”means that the absorption peak wavelength is 258 nm,and the absorbance is 0.371 6.
合成的aptamer-Fc同样用紫外-可见光谱进行表征,结果如图2所示。图2中曲线a、b、c分别为aptamer、Fc-NHS和 aptamer-Fc的紫外-可见吸收光谱。插图是aptamer-Fc在400~500 nm范围吸收光谱曲线的放大,其中450 nm的吸收峰与二茂铁琥珀酰胺酯的450 nm吸收峰对应,说明二茂铁分子已经被标记到适配体分子上。
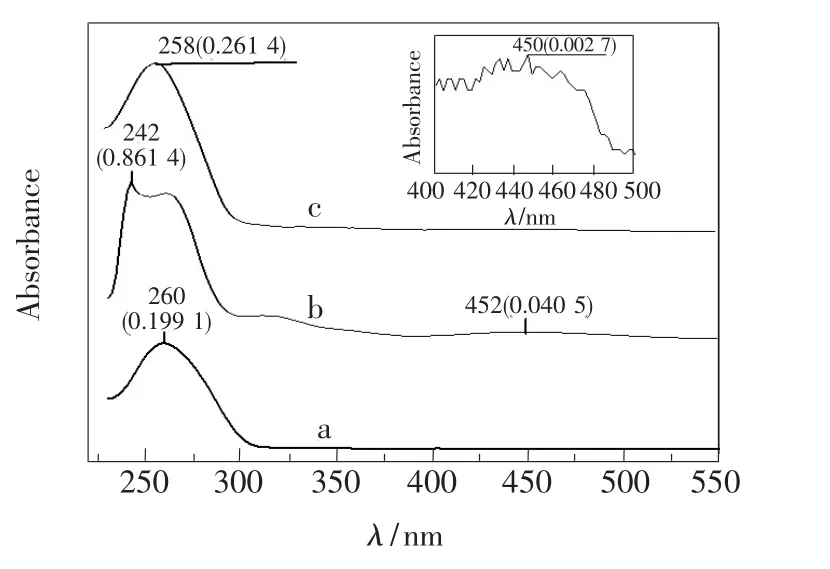
图2 aptamer(a)、Fc-NHS(b)和 aptamer-Fc(c)的紫外-可见吸收光谱。插图:aptamer-Fc在400~500 nm范围吸收光谱曲线的放大。注:“258(0.261 4)”含义为吸收峰波长258 nm,相对于基线的吸光度值0.261 4。Fig.2 UV-Vis absorption spectra of aptamer(a), Fc-NHS(b)and aptamer-Fc(c).Inset:amplification of the absorption spectrum curve of aptamer-Fc in the range of 400-500 nm.Note: “258(0.261 4)”means that the absorption peak wavelength is 258 nm,and the absorbance is 0.261 4.
3.2 ECL-aptamer传感器的表征
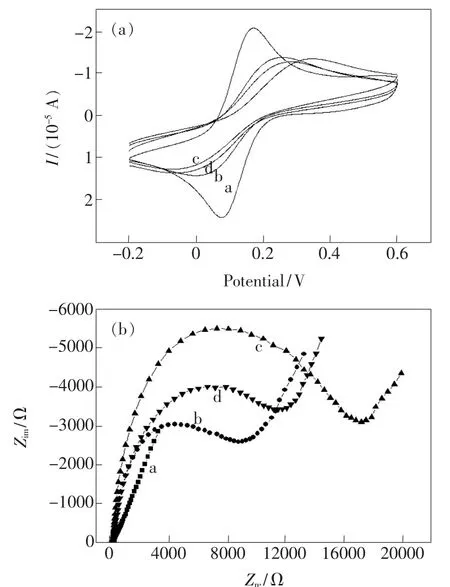
图3 不同阶段的纳米金电极在溶液中的循环伏安图(a)和电化学阻抗图(b)。a:裸纳米金电极,b:pDNA-Ru修饰的纳米金电极,c:ds-DNARu-Fc修饰的纳米金电极,d:ds-DNA-Ru-Fc与ATP作用后的纳米金电极。Fig.3 CV(a)and EIS(b)of the modified electrode at different stages in solution.a:bare nano-Au electrode, b: pDNA-Ru modified nano-Au electrode, c: ds-DNA-Ru-Fc modified nano-Au electrode,d:ds-DNA-Ru-Fc modified nano-Au electrode after incubation in an ATP solution.
图3 (b)是纳米金电极在不同阶段的电化学阻抗曲线。纳米金电极组装探针pDNA-Ru并在ME溶液中钝化后,电荷转移电阻增加(图3(b),a和b)。当电极表面的pDNA-Ru和aptamer-Fc杂交后,电荷转移电阻进一步增大(图3(b),c)。当电极在ATP溶液中孵化后,电荷转移电阻减小(图3(b),d)。电荷转移电阻的变化规律和循环伏安曲线的结果一致,进一步证明了pDNA-Ru在纳米金电极表面的组装、pDNA-Ru和aptamer-Fc的杂交、适配体从电极表面的解离等过程。
3.3 ECL-aptamer传感器的电化学发光行为
图4是ECL-aptamer传感器与ATP分子作用前后ECL信号的变化过程。曲线a表明裸纳米金电极没有ECL信号产生,组装了pDNA-Ru并在ME溶液中钝化后,pDNA-Ru形成发夹型的茎环结构,使得联吡啶钌分子靠近电极表面,产生很强的ECL信号(图4,b)。该修饰电极在0.50 μmol/L aptamer-Fc溶液中37℃孵化1 h,pDNARu和aptamer-Fc杂交形成刚性线形的双螺旋DNA链(ds-DNA-Ru-Fc),由于 pDNA 3′端标记的联吡啶钌分子远离纳米金电极表面,且适配体5′端标记的二茂铁分子靠近联吡啶钌分子,对联吡啶钌的ECL信号具有猝灭作用,导致ECL信号显著降低(图4,c)。当ECL-aptamer传感器浸泡在100.0 nmol/L ATP溶液中,由于ATP分子与适配体分子存在更强的相互作用,生成适配体-ATP复合物,aptamer-Fc从电极表面脱落,消除了二茂铁分子对联吡啶钌ECL信号的猝灭作用,导致ECL信号增强(图4,d)。此时的ECL-aptamer传感器再在高离子强度溶液(1.0 mol/L NaCl,10.0 mmol/L PBS,5.0 mmol/L MgCl2,pH = 7.4)中作用30 min,单链 pDNA-Ru再次形成茎环结构,ECL信号基本恢复至与aptamer-Fc杂交之前的强度水平(图 4,e)。
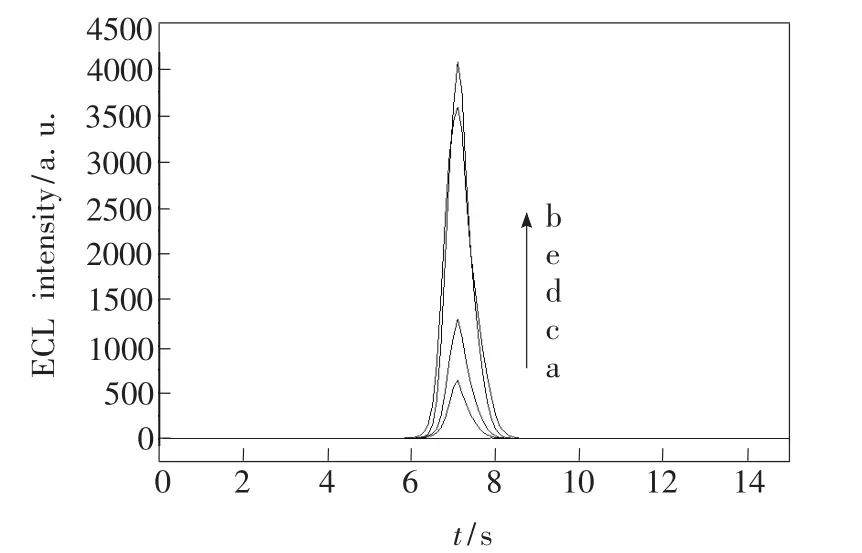
图4 ECL-aptamer传感器在不同阶段的ECL发光曲线。a:裸纳米金电极,b:pDNA-Ru修饰的纳米金电极,c:ds-DNA-Ru-Fc 修饰的纳米金电极,d:ds-DNA-Ru-Fc与ATP作用后的纳米金电极,e:在1.0 mol/L氯化钠溶液中孵化后的纳米金电极。Fig.4 ECL profiles of the ECL-aptamer biosensor at different stages.a: bare nano-Au electrode, b: pDNA-Ru modified electrode, c: ds-DNA-Ru-Fc modified electrode; d: ds-DNA-Ru-Fc modified electrode after incubation in an ATP solution, e: resulting electrode incubated in 1.0 mol/L NaCl solution.
3.4 实验条件优化
实验研究了探针pDNA-Ru自组装时间对ECL信号的影响,结果如图5所示。随着自组装时间的延长,ECL信号逐渐增强。当自组装时间为12 h时达到最大,而组装时间过长,反而使ECL信号明显减弱。故实验选用12 h作为自组装时间。
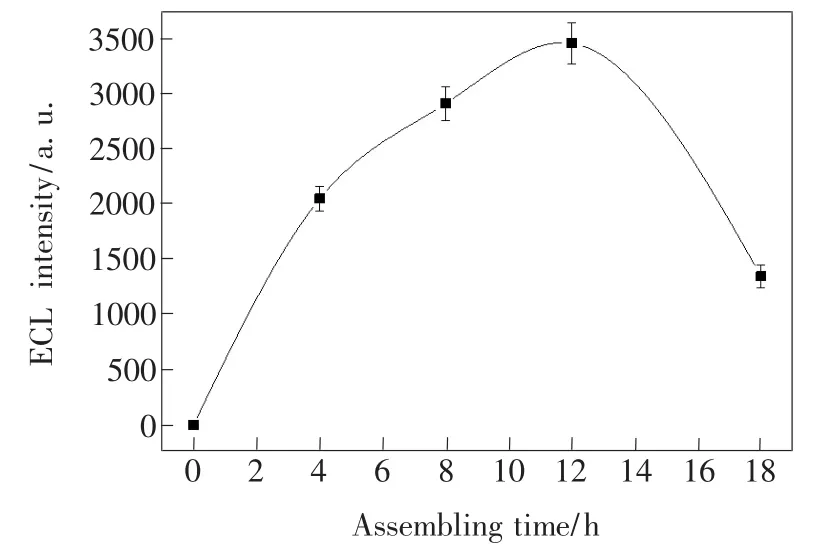
图5 pDNA-Ru自组装时间对ECL强度的影响Fig.5 Dependence of the ECL intensity on the self-assembly time of pDNA-Ru
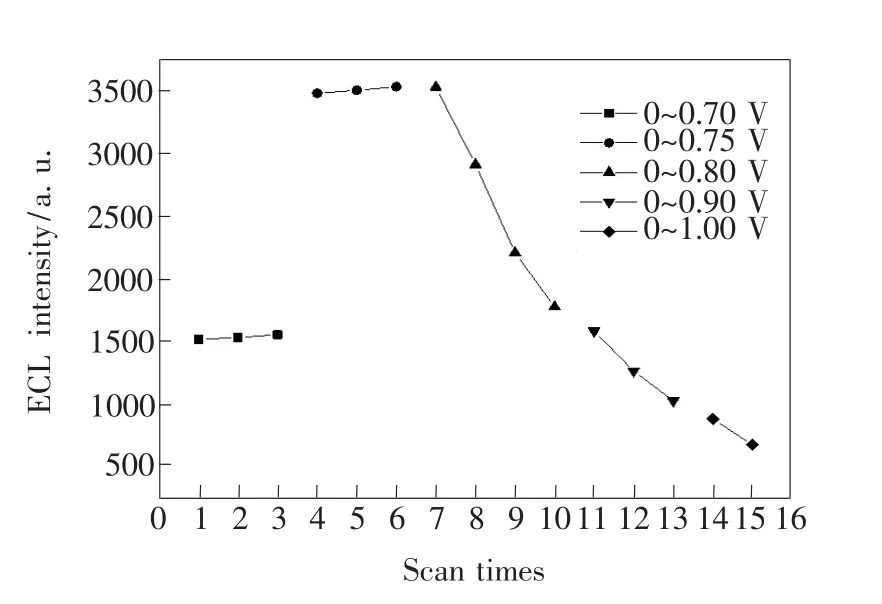
图6 电解电位范围对ECL强度和重复性的影响Fig.6 Dependence of the ECL intensity and reproducibility on the applied potential
实验考察了不同电解电位范围对ECL信号强度和重复性的影响,结果如图6所示。电位范围在0~0.75 V时,产生的信号较强,连续测定3次,信号强度稳定。故实验选用0~0.75 V的循环伏安电解电位范围。
实验也考察了ECL-aptamer传感器与ATP的相互作用时间对传感器电化学发光信号的影响,结果如图7所示。随着相互作用时间从10 min增加到30 min,发光信号逐渐增大。作用时间达到40 min后,发光信号基本保持稳定。故实验选用40 min作为相互作用时间。
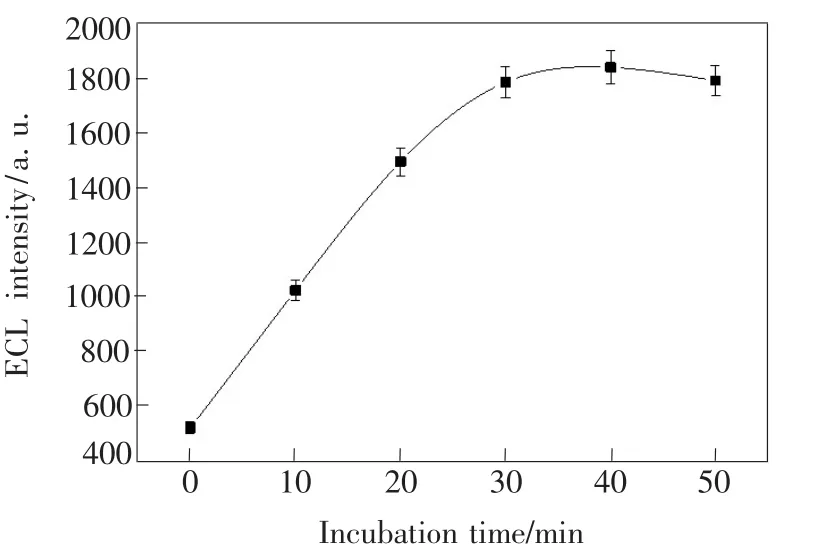
图7 ECL-aptamer传感器与ATP的作用时间对传感器电化学发光信号的影响Fig.7 Dependence of the ECL decreased intensity of the ECL-aptamer sensor on the interaction time with ATP
3.5 ATP的电化学发光检测
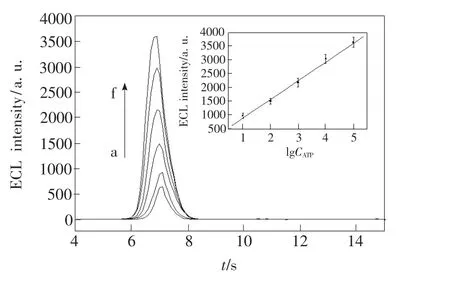
图8 ECL-aptamer传感器在不同浓度ATP溶液孵化后的ECL曲线。 ATP 溶液浓度为:a ~ f:0,0.01,0.10,1.0,10.0,100.0 nmol/L。 插图:ECL 信号强度与ATP浓度对数值之间的线性曲线。Fig.8 ECL profiles for the ECL-aptamer biosensors after incubated in ATP solutions with different concentrations.Inset:the calibration curve of the dependence of ECL intensity on the logarithm of different concentrations of ATP.The concentrations of ATP were(from a to f)0,0.01,0.10,1.0,10.0,100.0 nmol/L.
在优化实验条件下,与不同浓度的ATP相互作用后,ECL-aptamer传感器会产生不同强度的电化学发光信号。如图8所示,电化学发光信号强度随ATP浓度的增大而增加,且与ATP浓度的对数值在10.0 pmol/L~100.0 nmol/L范围内呈现良好的线性关系,线性回归方程为IECL=201+672.8 lgC(C单位为pmol/L),相关系数为0.995 9,检测限达到5.0 pmol/L。在最佳实验条件下,可以检测到500 μL溶液中5.0 fmol的ATP。
实验结果表明,与相关文献结果比较,该ECL-aptamer传感器具有更高的灵敏度和更宽的线性范围,如表1所示。
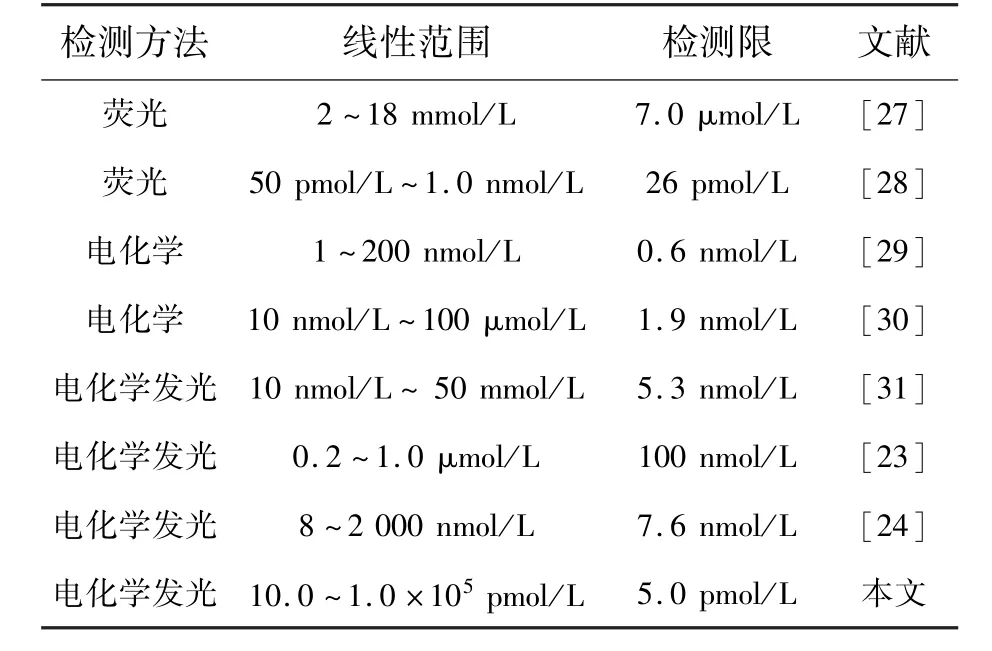
表1 不同检测方法的线性范围和检测限Tab.1 Linear ranges and detection limits of different detection methods
3.6 ECL-aptamer传感器的选择性和再生性
为考察该ECL-aptamer传感器对ATP的选择性响应,进行了传感器对CTP(ATP的类似物)的响应实验。同样条件下,该传感器分别在空白溶液、0.10 nmol/L ATP、0.10 nmol/L CTP 和 0.10 nmol/L混合溶液(ATP/CTP)中的孵化,并测量ECL信号。从图9结果中可以看出,只有ATP组分使得ECL-aptamer传感器产生了明显的电化学发光信号增强,说明该传感器对ATP具有良好的选择性。
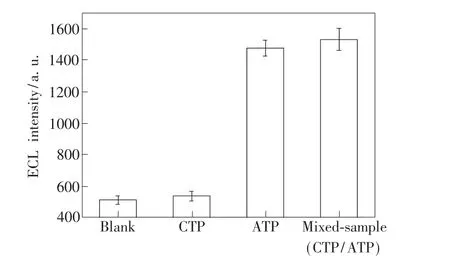
图9 ECL-aptamer传感器分别在空白溶液、CTP溶液、ATP溶液和混合溶液(CTP/ATP)中孵化后的ECL信号强度比较。Fig.9 Comparison of the ECL intensity of the ECL-aptamer biosensor when incubated with blank,CTP,ATP and mixed-sample(CTP/ATP).
实验也考察了传感器再生使用的性能。传感器用于检测100.0 nmol/L ATP溶液后,用10.0 mmol/L的PBS(pH=7.4)淋洗电极表面,再浸入500 μL 0.50 μmol/L 的 aptamer-Fc 溶液(10.0 mmol/L PBS, 0.10 mol/L NaCl, 5.0 mmol/L MgCl2,pH=7.4)中,于37℃孵化1 h。 所得电极又重新用于100.0 nmol/L ATP溶液的检测,ECL信号可以恢复到原来的90%。区别于其他类型的传感器,该传感器的再生不需要高温过程。实验结果表明,该传感器具有较好的再生性能。
4 结 论
本文基于ATP适配体与ATP分子作用后可以显著增强传感器ECL信号的性能,利用与ATP适配体完全互补且标记联吡啶钌的DNA作为传感探针,适配体作为识别元件,构建了一种电化学发光适配体型传感器。该传感器用于ATP含量的检测,检测限为5.0 pmol/L,检测线性范围为10.0~1.0×105pmol/L,与已报道结果相比具有更低的检测限和更宽的检测范围。该传感器构建方法为其他基于适配体的电化学发光传感器构建提供了参考。

