桂枝茯苓胶囊及其主要成分对原发性痛经模型大鼠肠道菌群的影响
段昆 高霞 耿婷 曹亮 肖伟 王振中
中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2020)11-1320-07
DOI 10.6039/j.issn.1001-0408.2020.11.07
摘 要 目的:探讨桂枝茯苓胶囊及其主要成分(芍药苷、丹皮酚、苦杏仁苷)对原发性痛经模型大鼠肠道菌群的影响。方法:将雌性SD大鼠随机分为正常组、模型组、胶囊组(桂枝茯苓胶囊内容物,1 000 mg/kg)、芍药苷组(15.0 mg/kg)、丹皮酚组(10.3 mg/kg)和苦杏仁苷组(12.1 mg/kg),每组6只。除正常组外,其余各组大鼠均于背部皮下注射苯甲酸雌二醇和腹腔注射缩宫素建立原发性痛经模型。于皮下注射苯甲酸雌二醇的第4天起,正常组大鼠灌胃等体积生理盐水,模型组大鼠灌胃等体积0.5%羧甲基纤维素钠溶液,各给药组大鼠灌胃相应药物,每天1次,连续7 d。在检测各组大鼠扭体次数和子宫组织中一氧化氮(NO)、丙二醛(MDA)含量的基础上,采用气相色谱法检测其结肠内容物中乙酸、丙酸、丁酸等短链脂肪酸(SCFAs)的含量;以多样性指数为指标,采用细菌基因组重复序列-聚合酶链式反应(Rep-PCR)和肠杆菌基因组间重复序列-聚合酶链式反应(Eric-PCR)技术评价大鼠粪便中肠道菌群的多样性。结果:与正常组比较,模型组大鼠扭体次数显著增多,子宫组织中NO、MDA含量均显著升高,结肠内容物中乙酸、丙酸、丁酸及总SCFAs含量均显著降低(P<0.05或P<0.01);肠道菌群DNA电泳条带数量明显减少,大部分条带亮度明显减弱,且给药1 h时其多样性指数(Rep-PCR和Eric-PCR法,下同)均显著降低(P<0.05或P<0.01)。与模型组比较,胶囊组、芍药苷组、丹皮酚组大鼠的扭体次数均显著减少,胶囊组、丹皮酚组大鼠子宫组织中NO含量以及胶囊组、芍药苷组、丹皮酚组MDA含量均显著降低(P<0.05或P<0.01);胶囊组大鼠结肠内容物中丙酸及总SCFAs含量,芍药苷组乙酸、丙酸、丁酸及总SCFAs含量以及丹皮酚组丙酸、丁酸及总SCFAs含量均显著升高,而芍药苷组异戊酸含量显著降低(P<0.05或P<0.01);各给药组大鼠肠道菌群DNA电泳条带及亮度均有不同程度的改变,且给药1 h时胶囊组和芍药苷组大鼠肠道菌群的多样性指数均显著升高,而丹皮酚组和苦杏仁苷组大鼠肠道菌群的上述多样性指数均显著降低(P<0.05或P<0.01)。结论:桂枝茯苓胶囊可显著减少原发性痛经模型大鼠的扭体次数,降低其子宫组织中NO、MDA的含量;同时,该药还可调节大鼠结肠内容物中SCFAs含量和肠道菌群多样性。上述作用可能与该药中的芍药苷和丹皮酚等成分有关。
关键词 桂枝茯苓胶囊;有效成分;原发性痛经;短链脂肪酸;肠道菌群多样性;大鼠
ABSTRACT OBJECTIVE: To investigate the effects of Guizhi fuling capsules and its principal components (paeoniflorin, paeonol and amygdalin) on the intestinal flora of primary dysmenorrhea model rats. METHODS: Female SD rats were randomly divided into normal group, model group, capsule group (Guizhi fuling capsule, 1 000 mg/kg), paeoniflorin group (15.0 mg/kg), paeonol group (10.3 mg/kg) and amygdalin group (12.1 mg/kg), with 6 rats in each group. Except for normal group, other groups were given estradiol benzoate subcutaneously on the back of rats and oxytocin intraperitoneally to induce primary dysmenorrhea model. From the 4th day after subcutaneous injection of estradiol benzoate, normal group was given constant volume of normal saline intragastrically; model group was given constant volume of 0.5%CMC-Na solution intragastrically; administration groups were given relevant medicine intragastrically, once a day, for consecutive 7 days. The writhing times and the contents of NO and MDA in uterus tissue of rats were determined, and then the contents of short-chain fatty acids (SCFAs) such as acetic acid, propionic acid, butyric acid in colonic contents were detected by GC method. Using diversity index as index, Rep-PCR and Eric-PCR were used to evaluate the diversity of intestinal flora in feces of rats. RESULTS: Compared with normal group, the writhing times of rats were increased significantly in model group; the contents of NO and MDA in uterus were increased significantly, while the contents of acetic acid, propionic acid and butyric acid in colonic contents and total content of SCFAs were decreased significantly (P<0.05 or P<0.01); the number of DNA electrophoresis bands of intestinal flora was significantly reduced, the brightness of most bands was significantly reduced, and the diversity indexes (by Rep-PCR and Eric-PCR method, hereinafter) 1 h after administration were significantly reduced (P<0.05 or P<0.01). Compared with model group, writhing times of rats were decreased significantly in capsule group, paeoniflorin group and paeonol group; the contents of NO in uterus of rats in capsule group and paeoniflorin group as well as the contents of MDA in capsule group, paeoniflorin group and paeonol group were decreased significantly (P<0.05 or P<0.01); the propionic acid content and total content of SCFAs in colon of rats in capsule group, the contents of acetic acid, propionic acid and butyric acid, total content of SCFAs in paeoniflorin group as well as the contents of propionic acid and butyric acid, total content of SCFAs in paeonol group were increased significantly; the content of isovaleric acid was decreased significantly in paeoniflorin group (P<0.05 or P<0.01); DNA electrophoresis bands and its brightness of intestinal flora changed to different extents in administration groups, and the diversity indexes of intestinal flora 1 h after administration were increased significantly in capsule group and paeoniflorin group, while those indexes were decreased significantly in paeonol group and amygdalin group (P<0.05 or P<0.01). CONCLUSIONS: Guizhi fuling capsules can significantly reduce writhing times and the contents of NO and MDA in uterus of primary dysmenorrhea model rats. At the same time, the capsules also can regulate SCFAs content in colonic contents and intestinal flora diversity of rats. The above effects may be related to paeoniflorin and paeonol in the capsules.
KEYWORDS Guizhi fuling capsules; Effective component; Primary dysmenorrhea; Short-chain fatty acids; Intestinal flora diversity; Rat
桂枝茯苓胶囊是参照东汉张仲景《金匮要略》中的经典名方桂枝茯苓丸经剂型改良而得,由桂枝、茯苓、桃仁、牡丹皮、芍药等5味中药组成,具有活血化瘀、消癥散结等功效,临床主要用于妇人瘀血经络所致癥块、经闭、原发性痛经、产后恶露不尽等症[1]。研究表明,原发性痛经与雌激素分泌密切相关,而雌激素紊乱可引起部分肠道菌群的显著改变[2-3]。肠道菌群种类繁多,是维持人体正常消化功能的微生物,具有抵御感染和降低自身免疫疾病发生风险的能力,其多样性直接反映了机体的健康状态[4]。短链脂肪酸(SCFAs)是由碳水化合物和蛋白质在厌氧环境下经肠道菌群发酵所生成的产物,主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸等,具有维持机体肠道微生态平衡的作用,是肠道菌群代谢的重要信息分子,影响着体内雌激素、生长激素等激素的合成和分泌[5-7]。
桂枝茯苓胶囊作为治疗原发性痛经的有效药物,其主要成分芍药苷、丹皮酚、苦杏仁苷等具有抗氧化作用,对痛经、卵巢囊肿等症的治疗均具有较好的效果[8];同时,芍药苷可显著促进嗜酸乳杆菌和粪肠球菌的增殖[9],丹皮酚、苦杏仁苷分别对两歧双歧杆菌、脆弱拟杆菌、丁酸梭菌以及金黄色葡萄球菌、大肠杆菌具有抑制作用[10-11]。由此可见,桂枝茯苓胶囊及其主要成分对大鼠病理状态下肠道菌群的调节具有重要意义。目前,关于桂枝茯苓胶囊的研究主要集中于其各成分的含量测定以及药理活性、子宫评价指标以及子宫形态变化等方面[12],而关于该药对肠道菌群的影响尚未见报道。基于此,本研究通过注射苯甲酸雌二醇和缩宫素建立大鼠原发性痛经模型[13-14],在给予桂枝茯苓胶囊及其主要成分(芍药苷、丹皮酚、苦杏仁苷)的基础上,通过药效学指标来评价该药及其成分的治疗作用;同时,运用气相色谱(GC)技术进一步考察大鼠结肠内容物中SCFAs的含量,借助细菌基因组重复序列-聚合酶链式反应(Rep-PCR)和肠杆菌基因组间重复序列-聚合酶链式反应(Eric-PCR)两种技术来分析大鼠肠道菌群多样性的变化,以期阐明桂枝茯苓胶囊及主要成分对原发性痛经模型大鼠肠道菌群的影响,为该药治疗原发性痛经的物质基础和作用机制的深入研究提供参考。
1 材料
1.1 仪器
Quant Studio 3型荧光定量PCR仪[赛默飞世尔科技(中国)有限公司];PowerPac HC型电泳系统、Universal HOOD Ⅱ型多功能凝胶成像仪[伯乐生命医学产品(上海)有限公司];DNM-9602G型酶标仪(北京普朗生物科技有限公司);Centrifuge 5424型高速离心机(德国Eppendorf公司);7890B型GC仪[安捷伦科技(中国)有限公司];HH-4型数显恒温水浴锅(常州国华电器有限公司);XS205DU型电子分析天平[梅特勒-托利多仪器(上海)有限公司];CT62A型高压蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂);Milli-Q PACIFICT Ⅱ7型纯水仪[密理博(上海)贸易有限公司)]。
1.2 药品与试剂
桂枝茯苓胶囊(江苏康缘药业股份有限公司,批号:171006,规格:0.31 g/粒);芍药苷对照品(批号:X12A8C33627,纯度:≥98%)、丹皮酚对照品(批号:Z08J6L1,纯度:98≥%)均购自上海源叶生物科技有限公司;苦杏仁苷对照品(东京TCI公司,批号:H3BBD- GE,纯度:≥97%);乙酸对照品(批号:J181172,纯度:≥99.9%)、丙酸对照品(批号:SHBD0049V,纯度:≥99.5%)、丁酸对照品(批号:SHBG8089V,纯度:≥99%)、戊酸对照品(批号:G1818016,纯度:≥99.5%)、异戊酸对照品(批号:C1702044,纯度:≥99.5%)、2-乙基丁酸对照品(内标,批号:STBH4972,纯度:≥99%)均购自默克生命科学上海有限公司;异丁酸对照品(国药集团上海化学试剂有限公司,批号:20180104,纯度:≥99%);苯甲酸雌二醇注射液(湖北武当动物药业有限责任公司,批号:170721,规格:1 mL ∶ 1 mg);缩宫素注射液(宁波市三生药业有限公司,批号:S171110,规格:2 mL ∶ 10单位);一氧化氮(NO)测定试剂盒(批号:20180503)、丙二醛(MDA)测定试剂盒(批号:20180502)均购自南京建成生物工程研究所;QIAamp? DNA Stool Mini Kit试剂盒(德国Qiagen公司,批号:160050377);2×Taq PCR Mix试剂[天根生化科技(北京)有限公司,批号:KT201801];DL2000 DNA Marker(批号:A2501C)、DL5000 DNA Marker(批号:AHF1916)均购自宝生物工程(大连)有限公司;Rep-PCR引物[上游(Rep1r):5′-IIIICGICGICATCIGGC-3′,下游(Rep2i):5′-ICGICTTATCIGGCCTAC-3′]、Eric-PCR引物[上游(Eric1f):5′-ATGTAAGCTCCTGGGGATTCAC-3′,下游(Eric2r):5′-AAGTAAGTGACTGGGGTGAGCG-3′]均由南京金斯瑞生物科技有限公司設计、合成;乌来糖(上海沪试实验室器材股份有限公司);琼脂糖、溴化乙锭(美国Sigma公司);5×氨基丁三醇-硼酸(TBE,上海生工生物工程技术有限公司);氯化钠注射液(批号:SD18082803,规格:250 mL ∶ 2.25 g,作生理盐水用);乙醚、硫酸、无水乙醇等其余试剂均为分析纯,水为超纯水。
1.3 动物
SPF级健康SD大鼠36只,雌性,体质量(200±20)g,由浙江省医学科学院提供,生产许可证号:SCXK(浙)2014-0001。所有大鼠均在SPF级动物房中分笼适应性饲养1周,室温(24±2)℃,每12 h昼夜交替。
2 方法
2.1 溶液配制、造模与样品收集
2.1.1 给药溶液的配制 称取芍药苷、丹皮酚、苦杏仁苷对照品以及桂枝茯苓胶囊内容物各适量,用0.5%羧甲基纤维素钠(CMC-Na)溶液配制成芍药苷、丹皮酚、苦杏仁苷以及胶囊内容物质量浓度分别为3.0、2.0、2.4、200 g/L的混悬液,临用新配。
2.1.2 分组、造模与给药 取大鼠36只,随机分为正常组、模型组、胶囊组(桂枝茯苓胶囊内容物,1 000 mg/kg)、芍药苷组(15.0 mg/kg)、丹皮酚组(10.3 mg/kg)、苦杏仁苷组(12.1 mg/kg),每组6只。胶囊组剂量设置参考本课题组前期研究,各成分组剂量设置参考现有文献的定量分析结果[15-16]。通过注射苯甲酸雌二醇和缩宫素复制大鼠痛经模型:除正常组大鼠于背部皮下注射等体积生理盐水外,其余各组大鼠均于背部皮下注射苯甲酸雌二醇注射液,每天1次,连续10天(其中第1、10天每只注射0.2 mL,其余各天每只注射0.1 mL);于皮下注射苯甲酸雌二醇的第4天起,各给药组大鼠均灌胃相应药物,模型组大鼠灌胃0.5%CMC-Na混悬液,正常组大鼠灌胃生理盐水,灌胃量均为5 mL/kg,每天1次,连续7天;于第10天末次给药1 h后,模型组和各给药组大鼠单次腹腔注射缩宫素注射液1.0 mL,若大鼠出现扭体反应则表明模型成功[17]。
2.1.3 样品收集 分别于腹腔注射缩宫素后1、48 h时收集大鼠粪便,并于48 h时用20%乌来糖溶液麻醉大鼠,处死,摘除子宫,并收集结肠内容物,于-80 ℃保存,备用。
2.2 药效指标评价
于摘除子宫前,观察并记录注射缩宫素后30 min内大鼠的扭体次数,并计算扭体反应抑制率:扭体反应抑制率=(模型组大鼠平均扭体次数-给药组大鼠平均扭体次数)/模型组大鼠平均扭体次数×100%。空白组大鼠未见扭体反应,记为“0”。
取“2.1.3”项下子宫样本适量,于冰浴条件下采用玻璃匀浆器进行匀浆处理。取匀浆液适量,分别采用硫代巴比妥酸法、硝酸还原酶法以酶标仪检测各组大鼠子宫组织中NO、MDA的含量,严格按照试剂盒说明书操作。
2.3 结肠内容物中SCFAs含量测定
2.3.1 GC条件 色谱柱:Agilent DB-FATWAX毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度80 ℃,以7 ℃/min升至190 ℃(保持2 min);载气:高纯氮气(纯度:≥99.999%);流速:1 mL/min;进样口温度:240 ℃;火焰离子化检测器(FID)温度:240 ℃;进样量:2 μL;分流比:5 ∶ 1。
2.3.2 样品处理 称取“2.1.3”项下结肠内容物适量,加水0.4 mL和50%硫酸溶液0.1 mL,涡旋5 min,以12 000 r/min离心10 min。吸取上清液0.4 mL,加入乙醚0.5 mL,涡旋5 min,以12 000 r/min离心10 min,取上层有机层396 μL,加入质量浓度为1.25 g/L的内标溶液(以乙醚为溶剂配制,临用现配)4 μL,混匀,取适量进行GC分析。
2.3.3 方法学考察 分别取乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸对照品适量,用乙醚配制成质量浓度均为1 g/L的混合对照品贮备液。取上述混合对照品贮备液用乙醚逐级稀释后,进行标准曲线、定量下限、精密度、重复性、稳定性、回收率等方法学考察,所有溶液均临用现配[18]。
2.3.4 SCFAs的含量测定 取“2.1.3”项下结肠内容物适量,按“2.3.2”项下方法处理后,再按“2.3.1”项下GC条件进样分析,记录峰面积。根据标准曲线计算样品中SCFAs的质量浓度,并计算其含量(X,mg/g):X=c×v×D/m[式中,c为样品中SCFAs的质量浓度(mg/L),v为样品预处理时的定容体积(L),m为结肠内容物的取样质量(g),D为样品稀释倍数]。
2.4 肠道菌群多样性分析
2.4.1 肠道菌群DNA提取 取“2.1.3”项下各组大鼠粪便适量,使用QIAamp? DNA Stool Mini Kit试剂盒提取其细菌DNA,严格按试剂盒说明书操作。
2.4.2 Rep-PCR和Eric-PCR扩增 扩增反应体系(25 μL,两种方法相同):DNA模板3.0 μL、上/下游引物各0.5 μL、2×Taq PCR Mix 12.5 μL、ddH2O 8.5 μL。Rep-PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,39 ℃退火30 s,36 ℃再退火30 s,72 ℃延伸3 min,共35个循环;72 ℃再延伸9 min。Eric-PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,49 ℃退火30 s,46 ℃再退火30 s,72 ℃延伸3 min,共35个循环;72 ℃再延伸9 min。扩增反应产物行2%琼脂糖凝胶电泳(电压:90 V,时间:1 h),以1%溴化乙錠试液显色后,使用多功能凝胶成像仪成像并拍照,以DL2000 DNA Marker(2 000 bp)、DL5000 DNA Marker(5 000 bp)为参照,获取DNA条带信息。利用Image Lab 6.0软件将电泳图谱转变为波峰图,其中每个波峰代表1个条带,假设1个条带代表1个细菌类群,条带波峰峰面积则代表该类群的种群数量。采用多样性指数(H′,即Shannon-Wiener指数)描述大鼠肠道菌群的多样性:H′=-∑(pi lnpi)(式中,pi=ni/N,ni为大鼠的第i条带的峰面积,N为此大鼠所有条带的峰面积总和),H′值越高则表明菌群多样性越丰富[19-20]。
2.5 统计学方法
采用SPSS 24.0软件对数据进行统计分析。数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
3 结果
3.1 药效学评价指标
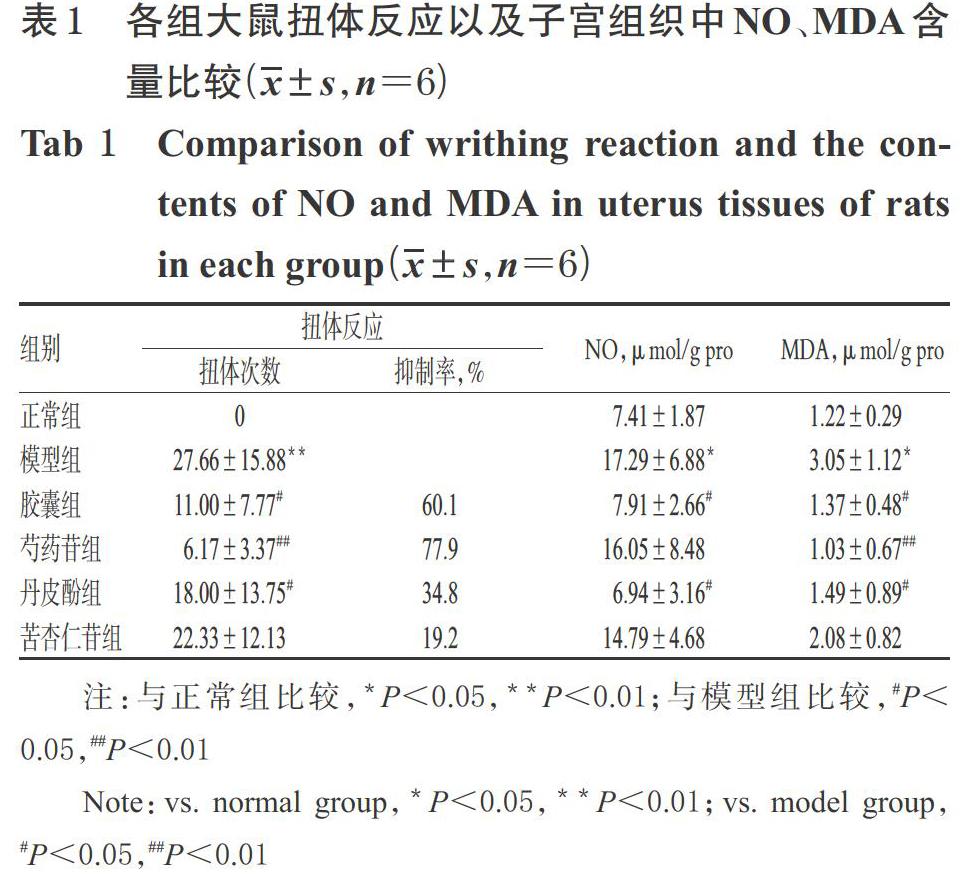
腹腔注射缩宫素后,与正常组比较,模型组大鼠均出现了明显的扭体反应,且扭体次数显著增加(P<0.01);与模型组比较,胶囊组、芍药苷组、丹皮酚组大鼠的扭体次数均显著减少(P<0.05或P<0.01),抑制率分别为60.1%、77.9%、34.8%。与正常组比较,模型组大鼠子宫组织中NO、MDA含量均显著升高(P<0.05);与模型组比较,胶囊组、丹皮酚组大鼠子宫组织中NO含量以及胶囊组、芍药苷组、丹皮酚组MDA含量均显著降低(P<0.05或P<0.01),详见表1。
3.2 结肠内容物中SCFAs含量变化
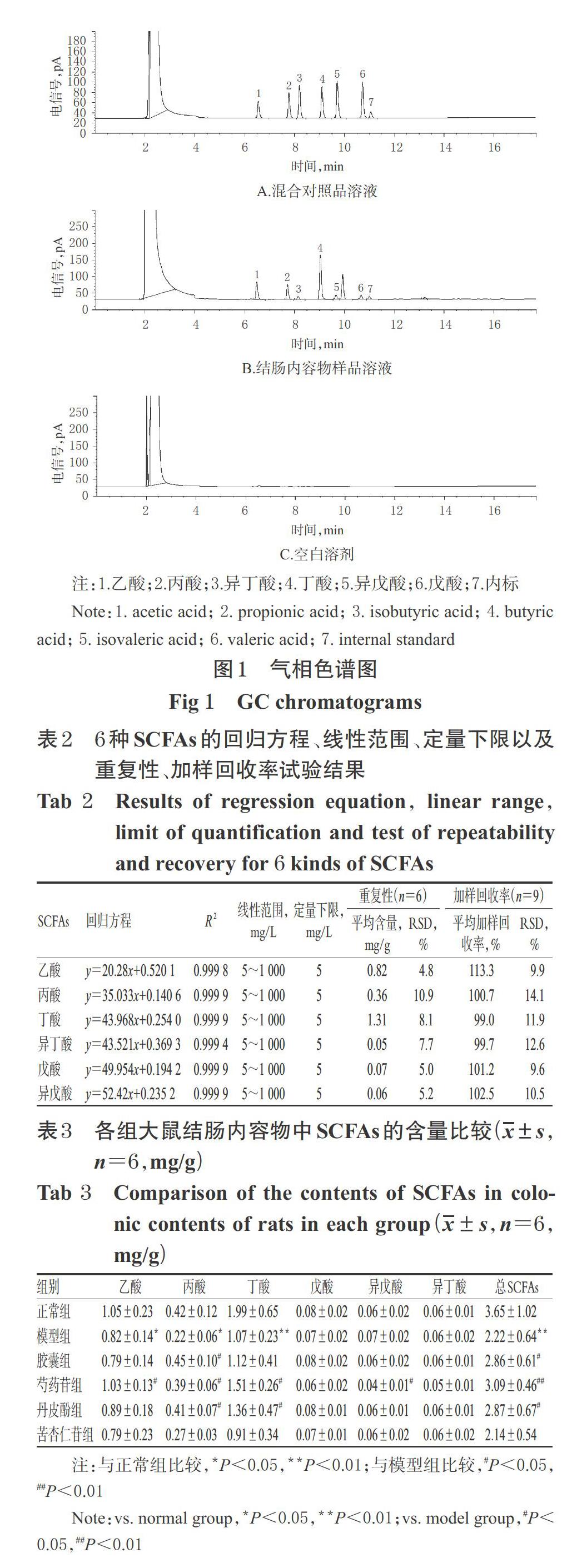
3.2.1 GC方法学考察结果 (1)专属性:混合对照品溶液(经乙醚稀释,质量浓度均为50 mg/L)、结肠内容物样品溶液、空白溶剂(乙醚)的GC图见图1。其中,图1A、图1B在同一保留时间有相同的色谱峰,且分离度良好;空白溶剂(图1C)对定量分析无干扰,提示本法专属性好。(2)线性关系:6种SCFAs检测质量浓度的线性范围均为5~1 000 mg/L(R2均大于0.999),定量下限均为5 mg/L。(3)精密度、重复性、稳定性及回收率试验:精密度、重复性试验的RSD分别为0.5%~2.5%、4.8%~10.9%(n=6);结肠内容物样品溶液室温放置8 h内稳定(RSD为5.1%~11.2%,n=5);6种SCFAs成分的平均加样回收率为99.0%~113.3%(RSD为9.6%~14.1%,n=9)。精密度、稳定性试验数据略,其余详见表2。
3.2.2 结肠内容物中SCFAs含量 与正常组比较,模型组大鼠结肠内容物中乙酸、丙酸、丁酸及总SCFAs的含量均显著降低(P<0.05或P<0.01)。与模型组比较,胶囊组大鼠结肠内容物中丙酸及总SCFAs含量,芍药苷组乙酸、丙酸、丁酸及总SCFAs含量以及丹皮酚组丙酸、丁酸及总SCFAs含量均显著升高,而芍药苷组异戊酸含量显著降低(P<0.05或P<0.01),详见表3。
3.3 肠道菌群多样性变化
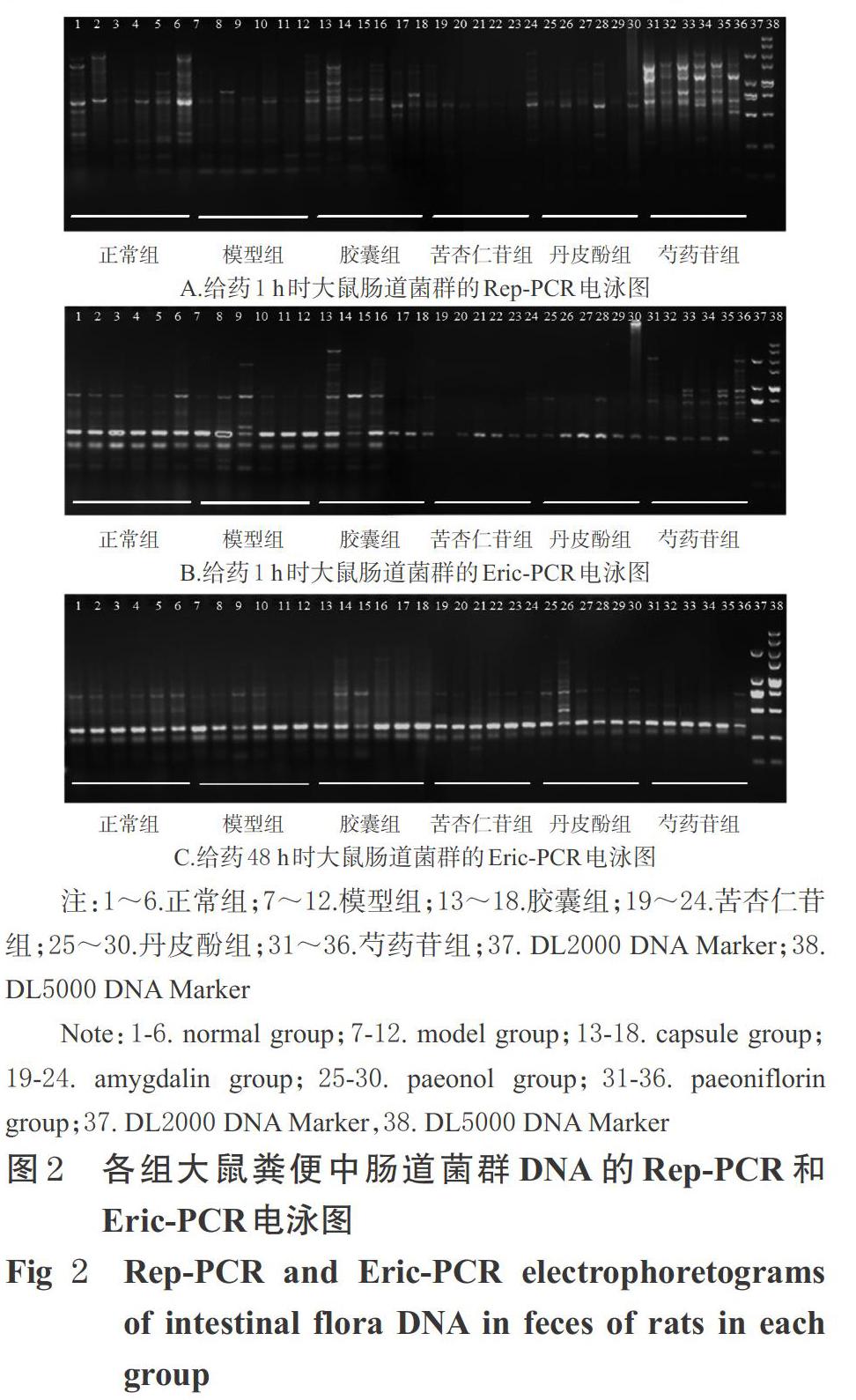
3.3.1 肠道菌群DNA电泳图 各组大鼠粪便中肠道菌群DNA的Rep-PCR和Eric-PCR电泳图见图2。由图2A、图2B可见,与正常组比较,模型组大鼠肠道菌群DNA的电泳图中条带数量明显减少,且大部分条带的亮度明显减弱、小部分条带亮度有所增强。与模型组比较,胶囊组和芍药苷组大鼠肠道菌群DNA的电泳图中条带数量增多,亮度明显增强;丹皮酚组大鼠的电泳图中部分条带的亮度明显增强,也有部分条带的亮度有所减弱;苦杏仁苷组大鼠的电泳图中条带数量明显减少,其亮度明显减弱。此外,上述现象在Eric-PCR电泳图中更为明显,故本研究采用Eric-PCR法对末次给药48 h后的大鼠粪便进行分析,发现随着给药时间的延长,模型组、苦杏仁苷组和丹皮酚组的条带数和条带亮度均有明显增多/增强的趋势,胶囊组和芍药苷组的条带数和条带亮度则明显减少/减弱,各组间差异减小,详见图2C。
3.3.2 肠道菌群的多样性指数 给药1 h时,与正常组比较,模型组大鼠肠道菌群的多样性指数均显著下降(P<0.05或P<0.01);与模型组比较,胶囊组和芍药苷组大鼠肠道菌群的多样性指数均显著升高,而丹皮酚组和苦杏仁苷组大鼠肠道菌群的多样性指数均显著降低(P<0.05或P<0.01)。给药48 h时,各组大鼠肠道菌群的多样性指数组间比较,差异均无统计学意义(P>0.05),详见表4。
4 讨论
痛经是最常见的妇科疾病,桂枝茯苓胶囊在治疗原发性痛经方面具有较好的疗效[1]。据文献报道,芍药苷、丹皮酚、苦杏仁苷均具有良好的镇痛、抗菌作用,其中芍药苷是芍药的主要有效成分,具有缓解痉挛性疼痛的作用[21],丹皮酚、苦杏仁苷是治疗痛经中药复方中的常见成分,具有缓解痛经的作用[22]。在痛经的发生过程中,机体脂质过氧化反应加剧,其中内皮舒张因子NO和脂质过氧化产物MDA发挥着重要的作用[23]。NO可作用于子宫平滑肌,影响子宫收缩,其生成量增多可引发疼痛[24]。痛经发作时,子宫平滑肌阵发性收缩可导致肌间血管受压而引发子宫肌层及内膜的暂时性缺血,子宫组织细胞由于缺血而生成较多的氧自由基,造成MDA含量增加[25]。本课题组前期药效学研究结果表明,0.27~1.08 mg/g的桂枝茯苓胶囊对大鼠子宫组织前列腺素F2α、前列腺素E2、超氧化物歧化酶以及NO、MDA等指标均有明显的改善作用[12]。基于此,本研究设置胶囊组给药剂量为1 000 mg/kg(以该胶囊内容物计算),同时结合芍药苷、丹皮酚和苦杏仁苷在制剂中的含量(3种成分的含量范围分别为14.80~18.5、7.13~10.8、8.72~14.4 mg/g)设置各单体成分的给药剂量[15-16]。本研究通过皮下注射苯甲酸雌二醇和腹腔注射缩宫素建立了大鼠原发性痛经模型,并通过药效学实验证明了桂枝茯苓胶囊能显著减少模型大鼠的扭体次数,降低大鼠子宫组织中NO、MDA的含量,而芍药苷和丹皮酚也表现出了类似的作用。这提示桂枝茯苓胶囊对原发性痛经具有较好的治疗作用,芍药苷和丹皮酚可能是发挥治疗作用的有效成分之一。
SCFAs是肠道菌群和机体之间的关键链接因子之一,能够调节动物体内孕酮、雌二醇的合成与分泌[6-7,26]。肠道内含量最为丰富的SCFAs是乙酸、丙酸和丁酸,其主要来源于肠道内碳水化合物的分解代谢;同时,肠道内氨基酸的代谢也会产生SCFAs,如异丁酸、异戊酸等[27]。本研究发现,原发性痛经模型大鼠结肠内容物中乙酸、丙酸、丁酸及总SCFAs的含量均显著降低,以丁酸含量变化最为明顯。有研究揭示了产生丁酸的肠道细菌主要属于厚壁菌门中瘤胃菌科、毛螺旋菌科和梭菌科等,上述菌种均可降低肠道通透性、减少肠道炎症,促进宿主免疫系统和代谢系统完善,其丰度与粪便中丁酸的含量显著相关[28]。在给予相应药物后,胶囊组大鼠结肠内容物中丙酸及总SCFAs含量,芍药苷组大鼠乙酸、丙酸、丁酸及总SCFAs含量以及丹皮酚组大鼠丙酸、丁酸及总SCFAs含量均较模型组显著升高,而芍药苷组大鼠异戊酸含量较模型组显著降低。这提示桂枝茯苓胶囊可提高模型大鼠结肠内容物中丁酸、乙酸、丙酸等SCFAs的含量,且发挥这种作用的可能是芍药苷和丹皮酚,与上述药效学实验结果基本一致;但有关芍药苷组大鼠体内异戊酸含量的降低尚有待后续研究进一步探讨。
Rep-PCR和Eric-PCR技术可用于鉴别属、种、菌株的差异,其中Rep-PCR可扩增细菌基因组中的重复序列,针对的是菌株的相同片段;Eric-PCR可扩增肠杆菌基因组间的重复序列,针对的是肠杆菌间的相同片段;两种方法均具有检测快速、操作简单等优点,已广泛应用于微生物研究中[29]。为全面反映模型大鼠肠道菌群的变化情况,本研究同时采用了Rep-PCR和Eric-PCR两种方法。结果显示,造模后,模型组大鼠肠道菌群的DNA电泳图中可见条带数量明显减少,亮度发生变化,多样性指数较正常组显著降低。这提示大鼠肠道的微生态平衡被打乱,菌群多样性发生改变。给予药物1 h后,与模型组比较,胶囊组和芍药苷组大鼠肠道菌群DNA的电泳图中条带数量增多,其亮度明显增强;丹皮酚组大鼠的电泳图中部分条带的亮度明显增强,但也有部分条带的亮度有所减弱;苦杏仁苷组大鼠的电泳图中条带数量明显减少,其亮度明显减弱。多样性指数检测结果显示,给药1 h时,胶囊组和芍药苷组大鼠的多样性指数均较模型组显著升高,而丹皮酚组和苦杏仁组大鼠的多样性指数均显著降低。这提示桂枝茯苓胶囊能在用药早期可对模型大鼠肠道菌群的多样性进行调节,且芍药苷可能是发挥该作用的主要成分。给药48 h时,各组大鼠的多样性指数无显著差异,推测可能是在48 h时,大鼠的扭体反应早已消失,SCFAs的失调亦逐步恢复,这可能与大鼠机体的自我恢复能力有关,但具体机制有待后续研究予以验证。
综上所述,桂枝茯苓胶囊可显著减少原发性痛经模型大鼠的扭体次数,降低其子宫组织中NO、MDA的含量;同时,该药还可调节大鼠结肠内容物中SCFAs的含量和肠道菌群多样性。这提示调节SCFAs和菌群多样性可能是桂枝茯苓胶囊治疗原发性痛经的机制之一,上述作用可能与该药中的芍药苷和丹皮酚等成分有关。本课题组后续还将通过16S rDNA高通量测序等技术对主要调节的肠道菌群种属进行进一步鉴定,并分析其变化情况,深入探讨该药的作用机制。
参考文献
[ 1 ] 仲云熙,金孝亮,谷世寅,等.基于抗炎活性的桂枝茯苓胶囊抗痛经作用机制研究[J].中国临床药理学与治疗学,2016,21(10):1095-1102.
[ 2 ] MENON R,WATSON SE,THOMAS LN,et al. Diet complexity and estrogen receptor β status affect the composition of the murine intestinal microbiota[J]. Appl Environ Microbiol,2013,79(18):5763-5773.
[ 3 ] BHARADWAJ S,KULKARNI G,SHEN B. Menstrual cycle,sex hormones in female inflammatory bowel disease patients with and without surgery[J]. J Dige Dis,2015,16(5):245-255.
[ 4 ] 姜东京,张丽,曹雨诞,等.肠道菌群在中药研究中的应用[J].中国中药杂志,2016,41(17):3218-3225.
[ 5 ] 吴水芸,强叶涛,程璐,等.气相色谱-质谱联用法检测粪便中短链脂肪酸[J].临床检验杂志,2015,33(4):246- 248.
[ 6 ] 李梦娇.短链脂肪酸对猪卵巢颗粒细胞性激素合成cAMP-PKA信号通路的影响[D].南京:南京农业大学,2015.
[ 7 ] 张莹莹,王聪,刘强,等.纤维分解酶与异丁酸对犊牛小肠消化酶活力和肝生长轴基因表达的影响[J].畜牧兽医学报,2016,47(9):1879-1887.
[ 8 ] 仲云熙,孙建国,王广基.桂枝茯苓胶囊药理作用与临床应用研究进展[J].中草药,2016,47(17):3115-3120.
[ 9 ] 叶清清,王雅茹,方伟彬,等. 8味中药对肠道特征菌的调节作用研究[J].广东药学院学报,2016,32(3):291-294.
[10] 郑彦懿,温如燕,罗霞,等.大黄牡丹汤对肠道菌群的体外作用[J].广州中医药大学学报,2016,33(3):357-361.
[11] 李瑞玲.欧李仁苦杏仁苷的提取及生物活性研究[D].呼和浩特:内蒙古大学,2019.
[12] 苏真真,李娜,曹亮,等.桂枝茯苓胶囊主要药理作用及临床应用研究进展[J].中国中药杂志,2015,40(6):989- 992.
[13] 朱英,熊飞升,朱青青,等.隔药灸神阙穴对原发性痛经模型大鼠血液代谢组学的影响[J].中医杂志,2018,59(13):1144-1149.
[14] 何瑶,王丽娟,刘婷婷,等.基于代谢组学技术分析四物汤治疗原发性痛经证的作用机制[J].中国实验方剂学杂志,2017,23(12):82-89.
[15] 张艳海,张大伟,孟兆青,等.在线二维液相色谱法快速测定桂枝茯苓胶囊中芍药苷、丹皮酚、苦杏仁苷和肉桂酸的含量[J].中國中药杂志,2013,38(23):4088-4093.
[16] 张倩,陈美玲,孙艳丽,等. HPLC法同时测定桂枝茯苓片中苦杏仁苷、丹皮酚、芍药苷的含量[J].世界最新医学信息文摘,2017,17(75):113-114.
[17] 张巧娜.振腹推拿对原发性痛经模型大鼠子宫PGE2、PGF2α及其受体表达的影响[D].北京:北京中医药大学,2018.
[18] 黄文武,彭颖,王梦月,等.四君子汤及其单味药水煎液对脾虚大鼠肠道菌群的调节作用[J].中国实验方剂学杂志,2019,25(11):8-15.
[19] KEYLOCK C. Simpson diversity and the Shannon-Wiener index as special cases of a generalized entropy[J]. Oikos,2010,109(1):203-207.
[20] 刘欢,陈磊,孙海峰,等. Eric-PCR指纹图谱分析逍遥散对抑郁模型大鼠肠道菌群的影响[J].山西医科大学学报,2015,46(2):160-165.
[21] 吴丽,王丽丽,费文婷,等.芍药苷和芍药内酯苷对小鼠疼痛模型的镇痛作用及对β-EP、PGE2的影响[J].中華中医药杂志,2018,33(3):915-918.
[22] 刘立,段金廒,刘培,等.桃红四物汤在正常和痛经模型大鼠体内的药代动力学特征[J].湖北中医药大学学报,2017,19(6):37-42.
[23] 马跃,杨燕云,张振秋,等.芍药甘草汤不同极性部位对痛经模型大鼠MDA、SOD、GSH-PX、ROS、NO、PGE2、PGF2α影响[J].辽宁中医药大学学报,2017,19(3):32-34.
[24] 黄语悠,房亚兰,刘克建,等.一氧化氮及其衍生物在缺血性脑血管病中的作用[J].首都医科大学学报,2017,38(1):67-71.
[25] 周启微,郭美仙,杨佳晶,等.西归对缩宫素所致小鼠原发性痛经的机制研究[J].大理学院学报,2017,2(4):24-27.
[26] 高爱琴.异戊酸对断奶前后犊牛生长性能、生长轴激素受体mRNA表达和血清指标的影响[D].晋中:山西农业大学,2015.
[27] 杨东明,赵鑫婧,赵德明,等.短链脂肪酸在宿主能量代谢方面的调节作用[J].中国微生态学杂志,2019,31(9):1100-1104.
[28] MART?N R,CHAIN F,MIQUEL S,et al. The commensal bacterium Faecalibacterium prausnitzii is protective in DNBS-induced chronic moderate and severe colitis models[J]. Inflamm Bowel Dis,2014,20(3):417-430.
[29] 朱晓慧,张成岗,刘海峰.急性应激后大鼠胃肠道病理变化及其菌群Eric-PCR图谱分析[J].生物技术进展,2016,6(3):200-205、230.
(收稿日期:2019-09-11 修回日期:2020-03-06)
(编辑:张元媛)

