人参皂苷Rg1对局灶性脑缺血再灌注损伤模型大鼠的预防作用及机制研究
武文文 吴诗卉 刘春红 包翠芬 闵连秋


中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2020)11-1287-07
DOI 10.6039/j.issn.1001-0408.2020.11.02
摘 要 目的:研究人参皂苷Rg1对局灶性脑缺血再灌注损伤(CIRI)模型大鼠的预防作用及机制。方法:将78只SD大鼠随机分为假手术组、模型组、丁苯酞对照组(阳性对照,10 mL/kg)和人参皂苷Rg1低、中、高剂量组(10、20、40 mg/kg),每组13只。各给药组大鼠腹腔注射相应药物,假手术组和模型组大鼠腹腔注射等体积生理盐水,每天1次,连续7 d。给药结束后,除假手术组外,其余各组大鼠均采用右侧大脑中动脉栓塞法复制局灶性CIRI模型。造模完成后,参照改良神经功能缺损评分标准对大鼠进行神经功能缺损评分,采用2,3,5-氯化三苯基四氮唑(TTC)染色法测定大鼠脑梗死体积百分比,采用干湿重法测定大鼠脑含水量,采用酶联免疫吸附法检测大鼠血清中白细胞介素1β(IL-1β)、IL-6含量,分别采用免疫组织化学法和Western blotting法测定大鼠脑组织中磷酸化p38丝裂原活化蛋白激酶(p-p38 MAPK)、磷酸化核因子-κB p65(p-NF-κB p65)蛋白表达情况。结果:与假手术组比较,模型组大鼠神经功能缺失评分、脑梗死体积百分比、脑含水量和血清中IL-1β、IL-6含量以及脑组织中p-p38 MAPK、p-NF-κB p65阳性蛋白表达细胞数和蛋白表达水平均显著升高(P<0.05或P<0.01);与模型组比较,各给药组大鼠上述指标水平均显著降低(P<0.05或P<0.01),且人参皂苷Rg1的作用具有一定的剂量依赖性趋势;人参皂苷Rg1中、高剂量组与丁苯酞对照组比较,上述指标差异均无统计学意义(P>0.05)。结论:人参皂苷Rg1对局灶性CIRI模型大鼠具有一定的预防作用。其机制可能与下调p-p38 MAPK、p-NF-κB p65蛋白表达,抑制炎症因子IL-1β、IL-6的释放有关。
关键词 人参皂苷Rg1;磷酸化p38丝裂原活化蛋白激酶;磷酸化核因子-κB p65;脑缺血再灌注损伤;炎症;大鼠
ABSTRACT OBJECTIVE:To study preventive effect and mechanism of ginsenoside Rg1 on focal cerebral ischemia-reperfusion injury (CIRI) model rats. METHODS:Totally 78 SD rats were randomly divided into sham operation group, model group, butylphthalide control group (positive control, 10 mL/kg), ginsenoside Rg1 low-dose, medium-dose and high-dose groups (10, 20, 40 mg/kg), with 13 rats in each group. Administration groups were give relevant medicine intraperitoneally, sham operation group and model group were given constant volume of normal saline intraperitoneally, once a day, for consecutive 7 d. After medication, except for the sham operation group, focal CIRI model was induced by middle cerebral artery occlusion (MCAO) method in other groups. After modeling, neurological deficit scoring was performed according to the modified neurological difict scoring standard; TTC staining was used to detected the percentage of cerebral infarction of rats; the cerebral water content was measured by dry/wet weight method; serum contents of IL-1β and IL-6 were detected by ELISA; the protein expressions of p-p38 MAPK and p-NF-κB p65 in cerebral tissue were determined by immunohistochemistry and Western blotting assay. RESULTS: Compared with sham operation, neurological deficits score, percentage of cerebral infarction and cerebral water content, serum contents of IL-1β and IL-6, positive expression numbers of cells and protein expressions of p-p38 MAPK and p-NF-κB p65 in cerebral tissue were increased significantly in model group (P<0.05 or P<0.01). Compared with model group, above index levels of administration groups were all decreased significantly (P<0.05 or P<0.01), and the effect of ginsenoside Rg1 had a dose-dependent trend; there was no significant difference of all above indexes between ginsenoside Rg1 middle-dose,high-dose groups and butylphthalide control group (P>0.05). CONCLUSIONS: Ginsenoside Rg1 has a certain preventive effect on focal CIRI model rats, the mechanism of which may be associated with down-regulating the protein expression of p-p38 MAPK and p-NF-κB p65, inhibiting the release of inflammatory factors such as IL-1β and IL-6.
KEYWORDS Ginsenoside Rg1; p-p38 MAPK; p-NF-κB p65; Cerebral ischemia-reperfusion injury; Inflammation; Rats
缺血性脑卒中具有高复发率、高致残率和高致死率的特点,严重危害人类健康。目前,对于该病的治疗原则主要为溶解血栓、恢复血液供应,但血液再通时经常会导致脑缺血再灌注损伤(Cerebral ischemia reperfusion injury,CIRI)[1]。减轻再灌注损伤已成为缺血性脑血管疾病治疗的重要环节。研究显示,炎症是CIRI的主要原因之一[2-3]。从抑制炎症反应方面探讨药物是否对CIRI有防治作用已成为目前研究的热点。人参皂苷Rg1为传统中药人参的主要活性成分之一,以往研究证实,人参皂苷Rg1能够改善缺血再灌注损伤症状,发挥神经保护作用,其作用机制可能与抗细胞凋亡、抗氧化作用有关[4-5]。目前,也有文献证实,人参皂苷Rg1可通过抑制炎症反应发挥对中脑黑质多马胺能神经元的保护作用[6-7]。但是关于人参皂苷Rg1对CIRI中的炎症反应是否有抑制作用,目前还不甚清楚。p38丝裂原活化蛋白激酶(p38 MAPK)/核因子-κB(NF-κB)是目前较为经典的炎症通路,可以调控多种炎症因子的表达,从而调节炎症反应[8]。鉴于此,本研究拟通过研究人参皂苷Rg1对局灶性CIRI模型大鼠炎症反应的影响,并通过p38 MAPK/NF-κB通路探索其作用机制,为治疗缺血性脑卒中疾病的新药开发提供实验基础。
1 材料
1.1 仪器
DNM-9602G型酶标分析仪(广州沪瑞明仪器公司);PowerPac 3000型电泳仪、Trans-BlotSDcell型半干转印仪(美国Bio-Rad公司);Vibra Cell Vcx105型超声波细胞粉碎机(美国Sonics公司);CM1900型冰冻切片机(德国Leica公司);YZ20P6型手术显微镜(苏州六六视觉科技股份有限公司);Primo Start型荧光显微镜(德国Zeiss公司);Matrx VIP 3000型动物麻醉机(美国Midmark公司)。
1.2 药品与试剂
人参皂苷Rg1对照品(吉林大学有机化学教研室,批号:201810,纯度:>95%);丁苯酞注射液(石药集团恩必普制药有限公司,批号:618180813,规格:每100 mL中含丁苯酞25 mg、氯化钠0.9 g);兔抗磷酸化p38 MAPK(p-p38 MAPK)多克隆抗体、兔抗磷酸化NF-κB p65(p-NF-κB p65)多克隆抗体、兔抗磷酸甘油醛脱氢酶(GAPDH)多克隆抗体(英国Abcam公司);异硫氰酸荧光素(FITC)标记的免疫球蛋白G(IgG)二抗(北京中杉金桥生物技术有限公司);白细胞介素1β(IL-1β)、IL-6酶联免疫吸附(ELISA)检测试剂盒(美国R&D公司,批号:均为201901);二喹啉甲酸(BCA)蛋白浓度测定试剂盒(北京鼎国昌盛生物技术有限责任公司,批号:93H001100);增强化学发光显影剂(ECL,上海碧云天生物技术有限公司);2,3,5-氯化三苯基四氮唑(TTC)染色剂(美国Sigma公司);4′,6-二脒基-2-苯基吲哚(DAPI)染色剂(美国Genview公司);其余试剂均为分析纯,水为超纯水。
1.3 动物
健康清洁级SD大鼠78只,雄性,体质量(280±50) g,由锦州医科大学实验动物中心提供,实验动物使用许可证号:SYXK(辽)2017-0003。饲养环境温度为20~25 ℃、相对湿度为50%~60%,饮用水为无菌纯净水。本研究已通过锦州医科大学实验动物伦理委员会审核(批件编号:2018014) 。实验过程中对动物的处置符合科学技术部颁发的《关于善待实验动物的指导性意见》的要求。
2 方法
2.1 分组、给药与造模
将78只SD大鼠采用抽签法随机分为假手术组、模型组、丁苯酞对照组(阳性对照,10 mL/kg)[9]和人参皂苷Rg1低、中、高剂量组(10、20、40 mg/kg)[10-11],每组13只。各给药组大鼠腹腔注射相应药物,假手术组和模型组大鼠腹腔注射等体积生理盐水,每天1次,连续7 d。给药结束后,除假手术组外,其余各组大鼠均采用右侧大脑中动脉栓塞法(MCAO)[12]复制局灶性CIRI模型:异氟烷气体麻醉大鼠后,沿颈旁正中切口,分离颈部动脉,分别找到颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),用动脉夹夹闭ICA;在ECA剪一切口,插入线栓,沿着ICA走向在ICA内缓慢推进直至感觉有少许阻力为止(从ECA与ICA分叉处起始插入约22 mm,此时已插至大脑前动脉端,阻断了大脑中动脉血流);栓塞2 h后拔出线栓,再灌注24 h。假手术组大鼠不插入线栓,其他操作步骤相同。
2.2 大鼠神经功能缺损评分
造模结束并待大鼠苏醒后,每组随机取5只大鼠,参照改良神经功能缺损评分标准[13]对其进行评分,评分越高则表明神经功能缺损越严重。
2.3 大鼠脑梗死情况检测
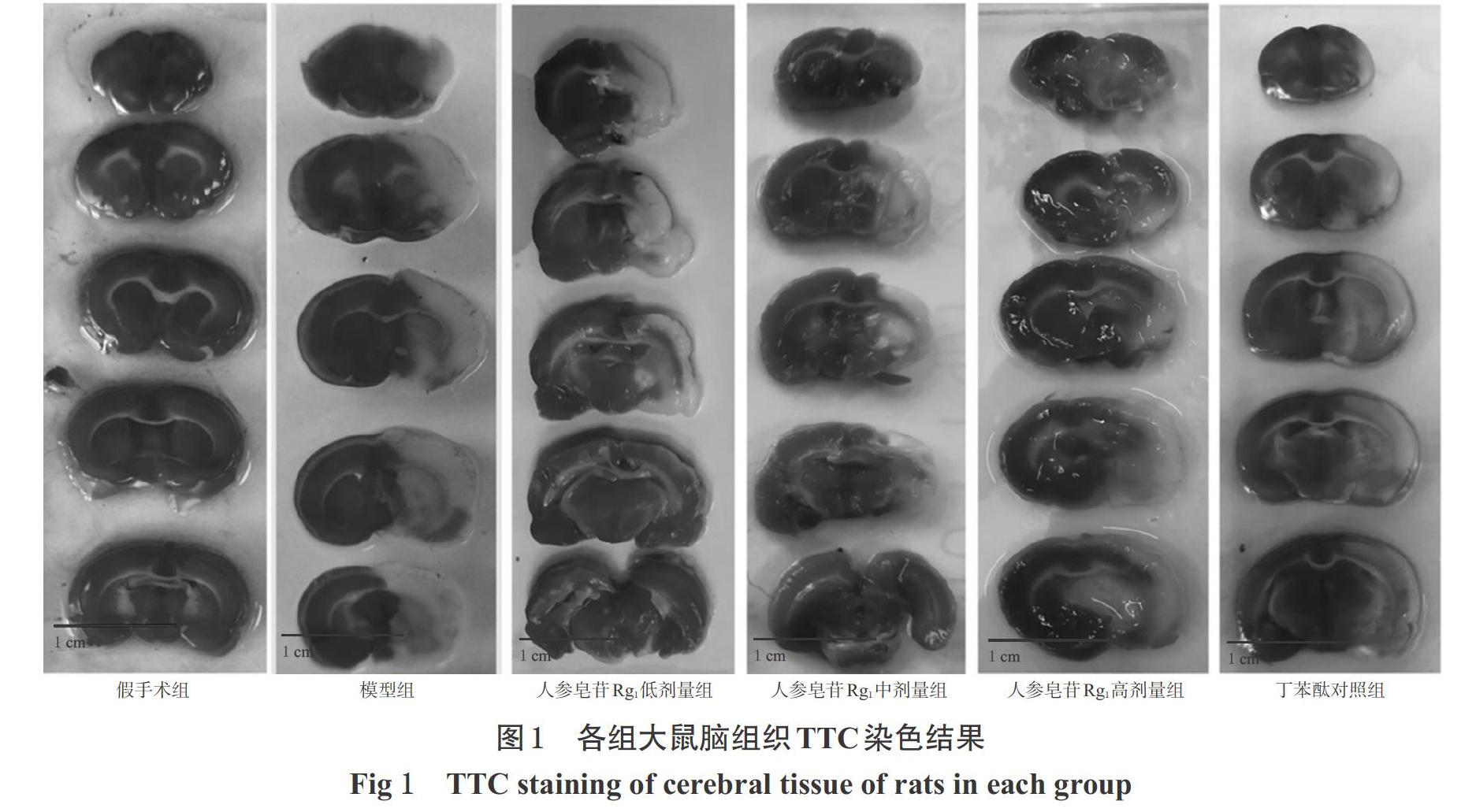
采用TTC染色法检测。每组随机取4只大鼠,断头取脑组织,置于冰上脑模内,沿冠状切面以脑腹侧视交叉为中点切第1片,连续切5片,每片厚约2 mm。将切片置于1%TTC染色液中,在37 ℃染色20 min左右,以10%福尔马林固定后拍照,并采用Image J 1.36b软件计算大鼠脑梗死体积占对侧半球体积的百分比(即脑梗死体积百分比)。
2.4 大鼠腦含水量检测
采用脑组织干湿重法[14]检测。每组随机取3只大鼠,断头取脑后称定湿质量,之后将脑组织在烘箱中(105 ℃)干燥72 h,再次称定质量。计算脑含水量[脑含水量(%)=(湿质量-干质量)/湿质量×100%],以此反映脑水肿情况。
2.5 大鼠血清中IL-1β、IL-6含量检测
采用ELISA法检测。每组随机取3只大鼠,10%水合氯醛麻醉后,将其于仰卧位行心脏取血(取血后放回用于后续实验),血样以1 500 r/min离心20~30 min,取上清液,于-20 ℃保存,备测。按照ELISA试剂盒说明书方法操作,检测血清中IL-1β、IL-6含量。
2.6 大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白表达情况检测
2.6.1 采用免疫组织化学法检测 每组随机取3只大鼠,10%水合氯醛麻醉后,通过心脏经4%多聚甲醛-戊二醛混合液灌流固定,断头取脑组织,以蔗糖沉糖后行10 μm冰冻切片。切片采用牛血清白蛋白封闭1 h,滴加p-p38 MAPK(稀释比例为1 ∶ 100)、p-NF-κB p65(稀释比例为1 ∶ 200)一抗工作液,于4 ℃孵育过夜;次日取出,恢复至室温后,以磷酸盐缓冲液(PBS)漂洗3次,每次5 min;滴加二抗工作液(稀释比例为1 ∶ 200),于37 ℃下孵育30 min,PBS漂洗3次,每次5 min;加入DAPI染色剂复染细胞核,在 37 ℃下孵育5 min后,PBS漂洗3次,每次5 min。以荧光淬灭剂封片,在荧光显微镜下观察并拍照(目标蛋白的阳性表达呈黄绿色荧光;细胞核呈蓝色荧光,用以定位细胞位置)。每只大鼠选取5张切片,在高倍镜(×400)下计数阳性表达细胞数,取平均值。
2.6.2 采用Western blotting法检测 每组取剩余3只大鼠,10%水合氯醛麻醉,通过心脏经生理盐水灌流后断头取脑,于脑模上冠状切取部分脑组织,加入RIPA裂解液,超声粉碎,在4 ℃下以12 000 r/min离心25 min,取上清液,采用BCA法测定蛋白含量后,制成含蛋白2.5 ?g/mL的组织提取液。取20 ?L组织提取液行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,然后在300 mA、25 ℃条件下转移80 min至聚偏氟乙烯(PVDF)膜上;将膜置于含1%牛血清白蛋白封闭液中,摇床上振摇1.5 h进行封闭;然后分别加入p-p38 MAPK(稀释比例为1 ∶ 1 000)、p-NF-κB p65(稀释比例为1 ∶ 2 000)和GAPDH(稀释比例为1 ∶ 5 000)抗体,于4 ℃孵育过夜;以TBST清洗3次,加入相应的二抗(稀释比例均为1 ∶ 2 000),室温下振摇1.5 h;再次用TBST清洗3次后,以ECL进行发光显色,采用Image J 1.36b软件测定条带吸光度。以GAPDH为内参,根据目的蛋白条带与内参蛋白条带吸光度的比值表示目的蛋白的表达水平。
2.7 统计学方法
采用SPSS 22.0统计软件进行数据分析。结果以x±s表示,多组间比较采用单因素方差分析,当方差齐性时组间两两比较采用LSD检验,当方差不齐时组间两两比较采用Tamhanes T2检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 大鼠神经功能缺损评分结果
与假手术组比较,模型组和各给药组大鼠神经功能缺损评分均显著升高(P<0.01)。与模型组比较,各给药组大鼠神经功能缺损评分均显著降低(P<0.05或P<0.01)。与人参皂苷Rg1低剂量组比较,人参皂苷Rg1高剂量组大鼠神经功能缺损评分显著降低(P<0.05)。与丁苯酞对照组比较,人参皂苷Rg1各剂量组大鼠神经功能缺损评分差异均无统计学意义(P>0.05)。各组大鼠神经功能缺损评分结果见表1。
3.2 大鼠脑梗死体积百分比测定结果
除假手术组大鼠脑组织呈均匀红色、无梗死灶外,其余各组大鼠均有深浅不同的白色梗死灶,其中以模型组最为明显。与假手术组比较,模型组和各给药组大鼠的脑梗死体积百分比均有不同程度的升高,且除人参皂苷Rg1高剂量组外的其余各组大鼠差异均有统计学意义(P<0.01)。与模型组比较,各给药组大鼠脑梗死体积百分比均显著降低(P<0.05或P<0.01);与人参皂苷Rg1低剂量组比较,人参皂苷Rg1高剂量组大鼠脑梗死体积百分比显著降低(P<0.01)。与丁苯酞对照组比较,人参皂苷Rg1各剂量组大鼠脑梗死体积百分比差异均无统计学意义(P>0.05)。各组大鼠脑组织TTC染色结果见图1,脑梗死体积百分比测定结果见表1。
3.3 大鼠脑含水量测定结果
与假手术组比较,模型组和各给药组大鼠脑含水量均显著升高(P<0.05或P<0.01)。与模型组比较,各给药组大鼠脑含水量均显著降低(P<0.05或P<0.01);人参皂苷Rg1不同剂量组间比较以及人参皂苷Rg1各剂量组与丁苯酞对照组比较,大鼠脑含水量差异均无统计学意义(P>0.05)。各组大鼠脑含水量测定结果见表1。
3.4 血清中IL-1β、IL-6含量测定结果
与假手术组比较,除人参皂苷Rg1中、高剂量组大鼠血清中IL-6含量外,其余各组的IL-1β、IL-6含量均显著升高(P<0.05或P<0.01)。与模型组比较,各给药组大鼠血清中IL-1β、IL-6含量均显著降低(P<0.05或P<0.01)。人参皂苷Rg1不同剂量组间比较以及人参皂苷Rg1各剂量组与丁苯酞对照组比较,大鼠血清中IL-1β含量差异均无统计学意义(P>0.05),但人参皂苷Rg1中、高剂量组和丁苯酞对照组大鼠血清中IL-6含量显著低于人参皂苷Rg1低剂量组(P<0.05)。各组大鼠血清中IL-1β、IL-6含量测定结果见表2。
3.5 大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白表达情况测定结果
3.5.1 免疫组织化学法测定结果 与假手术组比较,模型组和各给药组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白阳性表达细胞数均显著增加(P<0.05或P<0.01)。与模型组比较,各给药组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白阳性表达细胞数均显著减少(P<0.05或P<0.01)。与人参皂苷Rg1低剂量组比较,人参皂苷Rg1中、高剂量组和丁苯酞对照组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白阳性表达细胞数均显著减少(P<0.05或P<0.01),且人參皂苷Rg1中、高剂量组和丁苯酞对照组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白阳性表达细胞数组间差异无统计学意义(P>0.05)。各组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白表达的免疫荧光染色显微图见图2(图中,“Merge”表示染色的叠加图),阳性表达细胞计数结果见表3。
3.5.2 Western blotting法测定结果 与假手术组比较,模型组和人参皂苷Rg1低剂量组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白表达水平以及人参皂苷Rg1中剂量组和丁苯酞对照组大鼠脑组织中p-p38 MAPK蛋白表达水平均显著升高(P<0.05或P<0.01)。与模型组比较,各给药组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白表达水平均显著降低(P<0.05或P<0.01)。人参皂苷Rg1不同剂量组间比较以及人参皂苷Rg1各剂量组与丁苯酞对照组比较,大鼠脑组织中p-p38 MAPK蛋白表达水平差异均无统计学意义(P>0.05),但人参皂苷Rg1中、高剂量组和丁苯酞对照组大鼠脑组织中p-NF-κB p65蛋白表达水平均显著低于人参皂苷Rg1低剂量组(P<0.05)。各组大鼠脑组织中p-p38 MAPK、p-NF-κB p65蛋白表达电泳图见图3,蛋白表达水平测定结果见表4。
4 讨论
CIRI是由于血流再通所引起的级联反应导致的对脑组织的二次损伤,其常常导致机体出现神经功能缺损、脑梗死和脑水肿等症状,严重者可引起偏瘫、失语甚至死亡[15]。本研究结果显示,CIRI后大鼠均出现了不同程度的神经功能缺损、脑组织梗死和脑水肿症状,但是在给予不同剂量人参皂苷Rg1处理后,CIRI大鼠的神经功能缺损症状和脑水肿程度均显著减轻、脑梗死体积显著缩小,且其作用与丁苯酞(丁苯酞为临床常用药,对急性脑缺血性脑卒中患者的神经功能缺损有明显改善作用[16],故本文以其为阳性对照)相近,这提示人参皂苷Rg1能够减轻缺血再灌注所造成的脑组织损伤,具有一定的神经保护作用。
炎症反应在CIRI中扮演着重要角色,许多炎性细胞和炎性介质均参与了炎症反应[17-18]。抑制炎症反应、减轻脑组织损伤,是脑卒中治疗的重要手段之一[19-20]。IL由多种细胞产生,在炎症反应、体液免疫方面发挥着重要作用[21]。狄政莉等[22]发现,IL-1β和IL-6参与了脑缺血再灌注后炎症损伤的病理过程。本研究结果显示,CIRI后大鼠血清中IL-1β、IL-6含量显著升高,而给予不同剂量人参皂苷Rg1处理可以显著降低CIRI大鼠血清中 IL-1β、IL-6含量,且人参皂苷Rg1中、高剂量组和丁苯酞组间两者含量差异均无统计学意义(P>0.05)。NF-κB广泛存在于真核细胞内,能与大量炎症反应基因的启动子结合,是一种重要的转录激活因子,其调控基因可以编码细胞因子、免疫调节分子等,通过上述作用参与炎症反应等生物学进程[23-24]。在脑缺血时,NF-κB被炎性因子、细胞因子、钙超载等因素刺激而磷酸化,诱导细胞因子、黏附分子、炎性酶类的表达,形成炎症反应的恶性循环,导致脑组织水肿和神经细胞的损伤[25-27]。而作为MAPK家族成员之一的p38 MAPK,在炎症反应及其调控中发挥了重要作用[28]:p38 MAPK受到刺激后被磷酸化,激活为特异性底物p-p38 MAPK,参与炎症反应的调控。p-p38 MAPK作为NF-κB的上游信号分子,可促使NF-κB的磷酸化,活化后的NF-κB分解为p50和p65,之后进行核转位进入细胞核,调节炎症基因的转录[29]。本研究结果显示,CIRI后大鼠脑组织中p-p38 MAPK、p-NF-κB p65阳性表达细胞数显著增加,其相应蛋白表达水平也显著升高;而经人参皂苷Rg1处理后,大鼠脑组织中只有少量的阳性表达细胞,蛋白表达水平也显著降低。
综上所述,本研究证实了人参皂苷Rg1可通过下调p-p38 MAPK、p-NF-κB p65蛋白的表达,减轻脑梗死症状,从而发挥脑保护作用。然而,本研究还存有许多不足之处,如只选用单一时间点进行考察、未进行时-效关系分析等。在后续实验中,笔者将进一步对此进行完善。
参考文献
[ 1 ] CHOI JH,PILE-SPELLMAN J. Reperfusion changes after stroke and practical approaches for neuroprotection[J]. Neuroimaging Clin N Am,2018,28(4):663-682.
[ 2 ] HUANG J,KANG B,QU Y,et al. Protective effect of ex- osome on organs after ischemia-reperfusion injury[J]. Zhong Guo Xiu Fu Chong Jian Wai Ke Za Zhi,2017,31(6):751-754.
[ 3 ] RANA AK,SINGH D. Targeting glycogen synthase kinase-3 for oxidative stress and neuroinflammation:opportunities,challenges and future directions for cerebral stroke management[J]. Neuropharmacology,2018,139(1):124-136.
[ 4 ] 葉劲涛,李锋涛,宋焕瑾,等.人参皂苷Rg1通过改善氧化应激、线粒体损伤及炎症反应对大鼠脊髓缺血再灌注损伤的保护作用研究[J].中国康复医学杂志,2019,34(9):1021-1027.
[ 5 ] 李亮,邓文祥,何军锋,等.人参皂苷Rg1对局灶性脑缺血再灌注大鼠的神经保护作用[J].神经损伤与功能重建,2016,11(2):95-98.
[ 6 ] 冯梅.人参皂苷Rg1对Ag诱导的星形胶质细胞核因子κB活化及炎症反应的影响[D].广州:广州中医药大学,2005.
[ 7 ] GAO Y,CHU S,ZHANG Z,et al. Hepataprotective effects of ginsenoside Rg1:a review[J]. J Ethnopharmacol,2017.DOI:10.1016/j.jep.2017.04.012.
[ 8 ] 张泽群.欧前胡素通过P38MAPK/NF-κB途径对哮喘小鼠气道炎症的影响[D].延吉:延边大学,2018.
[ 9 ] 闫瑞云.醒脑静联合丁苯肽对脑缺血再灌注损伤的脑保护及细胞凋亡的影响[D].青岛:青岛大学,2017.
[10] WANG L,ZHAO H,ZHAI ZZ,et al. Protective effect and mechanism of ginsenoside Rg1 in cerebral ischaemia-reperfusion injury in mice[J]. Biomed Pharmacother,2018.DOI:10.1016/j.biopha.2018.01.136.
[11] ZHENG T,JIANG H,JIN R,et al. Ginsenoside Rg1 attenuates protein aggregation and inflammatory response following cerebral ischemia and reperfusion injury[J]. Eur J Pharmacol,2019.DOI:10.1016/j.ejphar.2019.02.018.
[12] LONGA EZ,WEINSTEIN PR,CARLSON S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[13] CHEN J,SANBERG PR,LI Y,et al. Intravenous administration of humanumbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke,2001,32(11):2682-2688.
[14] SHERCHAN P,HUANG L,WANG Y,et al. Recombinant Slit2 attenuates neuroinflammation after surgical brain injury by inhibiting peripheral immune cell infiltration via Robo1-srGAP1 pathway in a rat model[J]. Neurobio Dis,2015,85(12):164-173.
[15] 吕静,姜慧萍,王腾飞,等.脑缺血再灌注损伤主要发病机制的研究进展[J].滨州医学院学报,2015,38(4):291- 293.
[16] 江慧,战丽萍,张丽娟,等.丁苯酞注射液治疗急性脑梗死的疗效观察[J].中国实用神经疾病杂志,2015,18(8):74-75.
[17] KAWABORI M,YENARI MA. Inflammatory response in cerebral ischemia[J]. Curr Med Chem,2015,22(10):1258-1277.
[18] SHUKLA V,SHAKYA AK,PEREZ-PINZON MA,et al.erebral ischemic damage in diabetes:an inflammatory perspective[J]. Neuroinflammation,2017,14(1):20-22.
[19] WULLAERT A,BONNET MC,PASPARAKIS M. NF-κB in the regulation of epithelial homeostasis and inflammation[J]. Cell Res,2011,21(1):146-158.
[20] 岳屹立,张力,王亚周,等.程序性细胞坏死及其炎症反应在脑缺血损伤中的研究进展[J].神经解剖学杂志,2019,35(1):75-78.
[21] 王艳,朴莲荀,朴虎男,等.缺血性脑卒中患者血浆白细胞介素水平检测的临床意义研究进展[J].延边大学医学学报,2018,41(1):63-67.
[22] 狄政莉,万琪,来华安,等. IL-1β和IL-6在脑缺血再灌注微血管内皮细胞炎症反应中的作用[J].西安医科大学学报,2001,22(5):432-434.
[23] 余智,于民,邵晓莉,等. [Gly14]-Humanin抑制脑缺血再灌注损伤炎症反应及细胞凋亡与NF-κB p65的相关性分析[J].中华全科医学,2018,16(2):214-217、256.
[24] 赵杨,孙波,杜书章.芦荟素抑制p65的磷酸化对大鼠脑缺血再灌注诱导的组织损伤和炎症的调节作用[J].中国免疫学杂志,2019,35(17):2084-2088、2093.
[25] 陈灵,张相林,柳芳,等.白藜芦醇对缺氧缺血性脑损伤模型新生大鼠认知功能及SIRT1/NF-κB信号通路的影响[J].中国药房,2019,30(9):1182-1186.
[26] 郭佳,宋思奇,王克宇.熱射病小鼠大脑皮层组织中炎症细胞因子水平及P38 MAPK/NF-κB P65信号通路变化[J].吉林大学学报(医学版),2019,45(3):566-571.
[27] 马竞,何文龙,高重阳,等.木瓜苷通过抑制NF-κB p65/TNF-α通路活性减轻小鼠脑缺血再灌注诱导的组织损伤[J].浙江大学学报(医学版),2019,48(3):289-295.
[28] GAO F,CHEN D,HU Q,et al. Rotenone directly induces BV2 cell activation via the p38 MAPK pathway[J]. PLoS One,2013. DOI:10.1371/journal.pone.0072046.
[29] KARUNAKARAN S,RAVINDRANATH V. Activation of p38 MAPK in the substantia nigra leads to nuclear translocation of NF-kappaB in MPTP-treated mice:implication in Parkinsons disease[J]. J Neurochem,2009,109(6):1791-1799.
(收稿日期:2019-12-27 修回日期:2020-04-14)
(编辑:林 静)

