染色体微阵列检测技术在NT增厚胎儿中的应用*
杨培峰,单婉婉,张琳琳,于海洋,聂付芳,赵岚岚(郑州大学第三附属医院.产科,.检验科, 郑州450052)
在妊娠早期进行颈项透明层(nuchal translucency,NT)的筛查,可以尽早发现染色体及结构异常的NT增厚胎儿[1]。染色体微阵列(chromosomal microarray,CMA)检测技术相比于常规核型分析具有更多的优势,如其可以检测<1×105bp的基因组拷贝数变异(copy number variations,CNVs),发现某些用染色体核型分析无法检测出的微缺失或微重复,故而被公认为是临床上首选的产前胎儿结构异常检测方法[2]。本研究回顾性分析我院2018年NT增厚胎儿的CMA检测结果,并探讨NT增厚胎儿在合并有其他超声异常时染色体异常发生的风险及其临床应用价值,以期为临床咨询提供实验依据。
1 对象与方法
1.1研究对象 回顾性分析2018年1月至12月就诊于郑州大学第三附属医院且经孕11~13+6周超声筛查诊断为胎儿NT增厚的孕妇305例,孕妇年龄(29.9±5.0)岁,孕周11~24周,其中单胎300例,双胎中1胎NT增厚5例。纳入标准:(1)NT≥2.5 mm;(2)伴或不伴有其他超声结构的异常;(3)进行介入性产前诊断CMA检测。胎儿NT范围为2.5~12.8 mm,其中262例为单纯NT增厚,43例伴有其他异常(包括34例淋巴水囊瘤,3例单脐动脉,3例脉络丛囊肿,3例鼻骨缺失)。本研究经郑州大学第三附属医院医学伦理学委员会批准,孕妇及其家属均知情同意。
1.2主要仪器与试剂 Voluson E8 三维彩色多普勒超声诊断仪及腹部三维超声容积探头(4~8 MHz)购自美国GE公司;Nanodrop分光光度计(美国Themo Fisher Scientific公司)。高分辨率全基因组CytoScan HD芯片(美国Affymetric公司);Gentra Puregene Cell Kit_DNA提取试剂盒(美国Qiagen公司)。
1.3超声检查 超声检查由超声科医师采用Voluson E8三维彩色多普勒超声诊断仪及腹部三维超声容积探头(4~8 MHz)检测,检查孕周为孕11~13+6周,严格按照国际妇产科超声协会(International Society of Ultrasound in Obstetrics and Gynecology,ISUOG)发布的妊娠早期胎儿超声检查指南[3]中的NT值质控标准进行结果判读,以NT≥2.5 mm诊断为NT增厚。
1.4介入性产前诊断 305例孕妇中,有177例孕妇于11~13+6孕周接受经腹绒毛穿刺取材术,抽取绒毛组织4~8 mg;另外128例孕妇于18~24孕周接受羊膜腔穿刺术,采集羊水20~30 mL。所有穿刺均在超声引导下由具有产前诊断资质的医师操作。
1.5实验室检查
1.5.1实验分组 根据NT厚度的不同分为2.5~2.9 mm、3.0~3.4 mm、3.5~3.9 mm、4.0~4.9 mm、≥5 mm 5组,采用常规的染色体核型分析及CMA检测技术分别比较不同组间胎儿染色体数目异常及拷贝数异常发生情况。根据是否合并其他超声异常(如淋巴水囊瘤、单脐动脉、脉络丛囊肿、鼻骨缺失等),分为合并超声异常组(43例)和单纯组(262例),进一步比较两组染色体异常发生情况。
1.5.2DNA提取 按照Gentra Puregene Cell Kit_DNA提取试剂盒说明书提取羊水、绒毛或脐带组织基因组DNA。采用Nanodrop分光光度计检测DNA质量及浓度,取吸光度(A260/280 nm)为1.8~2.0的样本,置-20 ℃保存。
1.5.3CMA检测及结果判读 采用短串联重复序列(STR)位点比对法进行母血污染鉴定[3],确认无母血污染后进行CMA检测。按照高分辨率全基因组CytoScan 750芯片说明书对孕妇的绒毛或羊水标本进行检测。结果参照国际在线公开数据库(包括DGV数据库、Decipher数据库、OMIM数据库等)比对后,CNV判读为3种类型:致病性、良性以及临床意义不明的CNV(variants of unknown significance, VOUS)。CNVs致病性判读参照美国医学遗传学与基因组学学会(ACMG)判读指南[4]进行。
1.6统计学分析 采用SPSS 17.0统计软件进行分析,计数资料用频数及百分率表示,两组二分类资料及多组二分类变量资料的统计分析采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1常规的染色体核型分析及CMA 检测结果 CMA及常规的染色体核型分析均检出59例(59/305,19.3%)染色体异常,分别为21三体31例、18三体11例、Turner综合征(45,XO)8例、13三体2例、22三体1例、其他性染色体异常6例(47,XXY,3例;47,XXX,2例;47,XYY,1例)。此外,与常规的染色体核型分析相比,CMA多检出5例致病性CNVs,同时还检测出12例VOUS变异。5例致病性CNVs的结果见表1。其中1例染色体微重复经染色体核型分析证实为染色体不平衡易位所致,另有1例为DMD基因变异经父母验证证实为母亲来源。
2.2不同NT值的胎儿染色体异常结果的比较 随着NT厚度增加,2.5~2.9 mm组、3.0~3.4 mm组、3.5~3.9 mm组、4.0~4.9 mm组、≥5.0 mm组胎儿染色体异常发生率依次增加,差异有统计学意义。见表2。
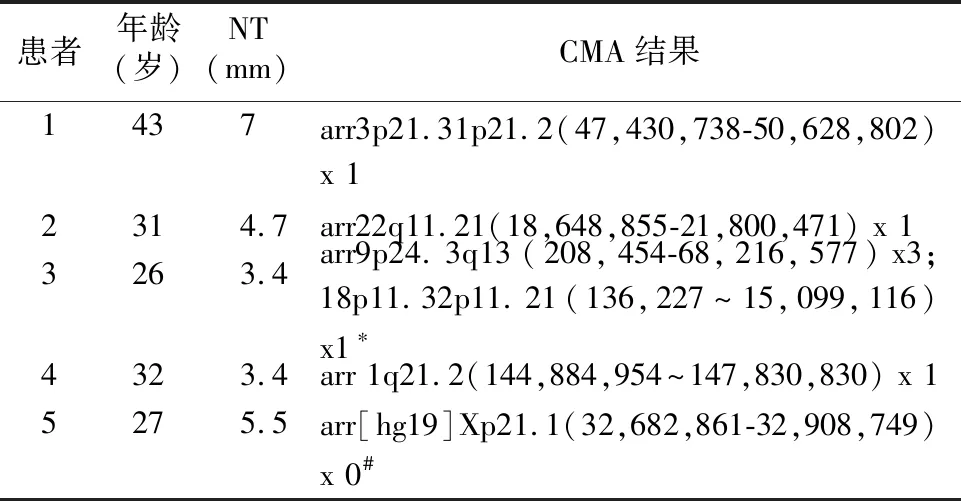
表1 NT增厚孕妇CMA检测致病性微缺失、微重复结果
注:*,46XX18der(18)t(9:18)(q13:p11.21); #,男性胎儿,DMD;母亲为DMD基因3~9号外显子杂合缺失突变携带者。

表2 NT厚度与胎儿染色体异常发生的关系
2.3NT增厚合并超声异常孕妇胎儿染色体异常发生情况的比较 305例孕妇中单纯NT增厚胎儿染色体异常发生率为16.4%(43/262),合并有其他异常(伴随有淋巴水囊瘤、单脐动脉、脉络丛囊肿、鼻骨缺失、脑室增宽等超声异常)的胎儿染色体异常发生率为44.2%(19/43),两组间差异有统计学意义(χ2=16.25,P<0.05)。
3 讨论
本研究对305例NT增厚的胎儿进行CMA检测,共发现64例染色体异常,包括21三体者(31例)、18三体者(11例)、13三体者(2例)、Turner综合征者(8例)、22三体(1例)和其他性染色体异常(6例);此外,还发现5例经常规染色体核型分析不能检出的致病性CNVs,与Christiansen等[5]研究结果较为一致。既往的研究结果表明,随着NT的增厚,胎儿染色体异常比例逐渐增加[6-7]。本研究中NT值为2.5~2.9 mm、3.0~3.4 mm、3.5~3.9 mm、4.0~4.9 mm、≥5.0 mm时,胎儿染色体异常率分别为5.6%、14.4%、22.4%、25.0%和42.3%,亦符合上述参考文献结果。目前,国外众多学者将NT增厚的标准定为≥3.5 mm,然而,在本研究中NT值为2.5~3.5 mm的胎儿染色体异常率为12.3%(14/114)。而Maya等[8]也建议,在NT值超过3.0 mm时就应进行CMA检查。因此,对于NT增厚进行产前诊断的临界值的判定标准仍需要更多的实验数据支持。
目前,CMA检测越来越多地被用于妊娠早期的产前诊断。本研究也发现,在妊娠早期NT增厚的胎儿中,采用CMA可以检出约2.0%(5/246)的常规染色体核型分析无法检测出的致病性CNVs,略低于Egloff等[9]报道的2.7%。Grande等[10]对17项研究进行荟萃(meta)分析后认为,采用CMA技术可以在染色体核型分析正常的胎儿中多检出4%(95%CI:2%~7%)的致病性CNVs,表明CMA能明显提高染色体异常的检出率。此外,本研究还检出3.9%(12/305)的VOUS,但由于数据库中具有完整临床资料的病例数有限,产生的VOUS可能会给临床医师的诊断带来新的挑战,因此,应做好检测前的咨询工作[11]。
临床上对于NT增厚的胎儿多考虑进行综合征的筛查。如Egloff等[9]对1 076例胎儿检测后发现36例CNVs,其中7例CNVs(5例微重复,2例微缺失)发生于22q11.21区域,此外还发现1例1q21.1微缺失;麦明琴等[6]及杜柳等[7]亦在对妊娠早期NT增厚胎儿研究时分别发现1例22q11.21区域的微缺失。而本研究也发现1例22q11微缺失的患儿以及1例1q21.2区域2.9 MB的微缺失(包含1q21.1微缺失综合征相关的区域)患儿,表明对NT增厚的胎儿进行综合征筛查至关重要。此外,本研究还发现1例DMD基因的半合子缺失,经染色体核型分析,患儿母亲为DMD基因的杂合缺失携带者。本研究中NT增厚的胎儿伴随的超声异常均为超声软指标的异常,但未发现合并严重的结构畸形,分析原因可能与NT筛查时孕妇的孕周较小,很多结构异常尚不能表现出来有关。

