枸杞子提取物对光诱导视网膜损伤的保护作用△
曹秀朋 陈霞 郭雅图 巩一博 王雪纯
年龄相关性黄斑变性(age-related macular degeneration,AMD)是发达国家60岁以上人群视力不可逆性损害的首要原因[1-2]。由于人口日趋老龄化,我国 AMD 患者日益增多,AMD已成为我国眼科防盲研究的重点课题之一。AMD是一种多因素疾病,会影响视网膜许多类型的细胞,包括脉络膜毛细血管内皮细胞、小胶质细胞、感光细胞和视网膜色素上皮(retinal pigment epithelium,RPE)细胞[3]。RPE细胞可吸收过多的光以防止视网膜受到光诱导损伤[4-5]。过量的强光会引起RPE细胞的氧化应激,从而触发活性氧(reactive oxygen species,ROS)的产生并产生氧化损伤。光诱导损伤模型早已用于测试抗氧化剂对视网膜的保护作用[6-7]。RPE细胞的氧化损伤已被认为在AMD的发生发展中起重要作用[8-11]。因此,视网膜的光诱导损伤模型可用于研究AMD等视网膜变性类疾病,为AMD的发病机制、治疗措施等的研究提供了良好基础。枸杞子属茄科,已被用作传统中草药数千年[12],药用植物枸杞主要活性成分为枸杞多糖[13],是水溶性蛋白质多糖,具有多种功能,包括抗氧化[14]、免疫调节[15]和抗炎[16]。本实验通过细胞和动物实验来评估枸杞子提取物对AMD的早期预防效果。
1 材料与方法
1.1 材料
1.1.1 实验对象人RPE(ARPE-19)细胞购自中国培养物保藏中心,培养于含体积分数10%胎牛血清、100 U·mL-1青霉素和100 g·L-1链霉素的DMEM/F12培养基中,置于含体积分数5% CO2、37 ℃恒温恒湿的培养箱内培养,待细胞且呈指数增长时用于后续实验。
SPF级健康5周龄雄性C57BL/6J小鼠40只,体质量(18±1)g,购自斯贝福(北京)生物技术有限公司,饲养于天津医科大学动物房,室内温度(22±2)℃、相对湿度40%~60%,12 h/12 h照明昼夜循环。
1.1.2 主要试剂及仪器DMEM/F12高糖培养基、胎牛血清(美国Hyclone公司);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)检测试剂盒、BCA蛋白浓度测定试剂盒、ROS检测试剂盒(南京建成生物工程研究所)。 LED灯(深圳爱图仕影像器材有限公司), Phoenix Micron IV(Phoenix研究实验室,美国),视网膜电图(electroretinogram,ERG)仪(德国罗兰公司)。
1.1.3 枸杞子提取物制备称枸杞干果,加入6倍体积的蒸馏水,煮沸2 h过滤,滤液浓缩后醇沉,干燥,制得枸杞子提取物粉末(每3.49 g枸杞子可制得枸杞子提取物1.00 g)后备用。称取枸杞子提取物0.20 g,倒入20 mL 的DMEM/F12培养基中,制成终浓度为10 g·L-1的枸杞子提取物母液,经 0.22 μm的滤膜过滤除菌后,放入冰箱4 ℃保存,使用时稀释10倍。
1.2 细胞实验
1.2.1 细胞光诱导损伤细胞模型的建立ARPE-19细胞经胰蛋白酶消化后,制成细胞悬液,并接种于培养板中,待细胞呈指数增长后,使用LED冷光灯直落式照射,光照强度为(2500±500)lux,光照时间为24 h,建立光诱导损伤细胞模型,具体方法参见文献[17]。
1.2.2 实验分组及处理ARPE-19细胞随机分为正常细胞对照组,光诱导细胞损伤组,细胞低、中、高剂量组(0.1 g·L-1、0.5 g·L-1、1.0 g·L-1枸杞子提取物+光诱导细胞损伤组),共5组。其中,光诱导细胞损伤组细胞建立光诱导损伤模型;细胞低、中、高剂量组根据前期预实验结果选择低、中、高3个枸杞子提取物的安全浓度,分别加入相应的细胞中,1 h后建立光诱导损伤模型。
1.2.3 检测方法细胞分组处理后,常规MTT法检测各组细胞活性,同时使用ROS检测试剂盒孵育各组细胞0.5 h,倒置荧光显微镜下观察, Image-pro plus 6.0软件(美国)分析各组荧光强度以评估各组细胞内ROS含量。
1.3 动物实验
1.3.1 实验动物分组40只小鼠随机分为5组,每组8只,分别为:动物对照组、光诱导动物损伤组,动物低、中、高剂量组(280 mg·kg-1、370 mg·kg-1、460 mg·kg-1枸杞子提取物+光诱导动物损伤组)。小鼠适应性喂养1周,6周龄后开始按体质量灌胃,其中,动物对照组和光诱导动物损伤组每天每只小鼠灌胃无菌生理盐水0.20 mL,动物低、中、高剂量组枸杞子提取物的量根据前期预实验结果选择,均连续灌胃8周。灌胃结束后,光诱导动物损伤组和动物低、中、高剂量组制备光损伤模型。本研究的所有实验程序均按照天津医科大学动物实验伦理委员会批准的方案进行。
1.3.2 光诱导损伤动物模型的制备参照文献[18]建立光诱导损伤动物模型,具体步骤:连续灌胃8周后,除动物对照组外,其余4组小鼠在第9周开始,将列阵式LED冷光灯放置在笼子上方和两侧进行强光照射,光强度为10 000 lux,每天照射4 h,连续照射7 d。照射期间正常进食与饮水。
1.3.3 ERG检测待光诱导损伤小鼠模型建立后,小鼠暗适应至少12 h,腹腔注射50 g·L-1水合氯醛(10 mL·kg-1体质量)进行全身麻醉。使用全视野ERG仪记录各组ERG,全程在暗室中进行。接地电极放置于小鼠尾部,参考电极放置于小鼠两耳之间的头部皮肤下,螺纹记录电极放置在角膜表面;托吡卡胺眼液滴眼进行双眼散瞳,角膜表面涂卡波姆凝胶保护角膜,行ERG检测。暗适应下记录的光强度为-2 cd·s·m-2和0 cd·s·m-2,明适应下记录的光强度为1 cd·s·m-2。利用ERG View 软件对各组小鼠a波和b波的振幅进行分析。
1.3.4 OCT检测所有小鼠均检测右眼。小鼠全身麻醉后,右眼滴入托吡卡胺眼液散瞳,卡波姆凝胶涂眼保护角膜。待右眼瞳孔完全散大后,用眼底成像系统Micron IV的OCT程序,在最大光照区域(大约在视盘上缘一个视盘直径处)进行视网膜扫描,记录各组小鼠视网膜外核层(outer nuclear layer,ONL)厚度。图像采用Micro IV提供的Insight软件处理。
1.3.5 荧光素眼底血管造影检测OCT检测完毕后,将Micron IV调至荧光素眼底血管造影(fundus fluorescein angiography,FFA)程序,在小鼠尾静脉按5 mL·kg-1体质量给予50 g·L-1荧光素钠。记录注入荧光素钠后3 min和10 min的视网膜图像,评估视网膜血管渗漏情况。
1.3.6 视网膜HE染色计数ONL细胞待所有小鼠体内荧光素钠排泄完后(FFA后2 d,期间正常饮食),腹腔注射足量100 g·L-1水合氯醛处死各组小鼠,立即摘除右眼眼球,用加有体积分数5%乙酸的福尔马林固定液固定24 h, PBS(pH=7.4)浸泡一夜,经乙醇和二甲苯梯度脱水后石蜡包埋。切片,厚度为4 μm,将切好的石蜡组织片粘贴在防脱玻璃片上,行HE染色,使用Brightfield照明观察和拍摄染色切片。以ONL每列细胞个数为单位计数,每间隔200 μm计数1次,每张切片计数3次,取平均值。
1.3.7 血清中相关抗氧化能力指标检测上述小鼠右眼球摘除后,立即收集眼眶静脉处流出的血液,4 ℃、3000 r·min-1离心10 min,将上清液置于-80 ℃冰箱保存备用。使用SOD、GSH-Px、MDA检测试剂盒检测各生化指标的变化,严格按照试剂盒说明书进行操作。
1.4 统计学处理采用SPSS 22.0软件进行统计学分析,数据以均数±标准差表示,通过单因素方差分析(one-way ANOVA)和Tukey post检验对数据进行统计分析,并使用Bonferroni对事后结果进行多重比较与分析。检验标准:α=0.05。
2 结果
2.1 细胞实验结果光照24 h后,光诱导细胞损伤组细胞活力降低为正常细胞对照组的61.88%(P<0.001);与光诱导细胞损伤组相比,细胞低、中、高剂量组细胞活力分别升高到78.65%、88.95%和93.84%(均为P<0.05);各剂量组间差异均有统计学意义(均为P<0.05)。ROS含量检测结果表明,设正常细胞对照组ARPE细胞ROS含量为100%,则光诱导细胞损伤组ROS含量为152.00%(P<0.001);与光诱导细胞损伤组相比,细胞低、中、高剂量组ROS含量均明显降低,分别为134.17%、125.16% 和117.76%(均为P<0.05);各剂量组间差异均有统计学意义(均为P<0.05)。见图1。
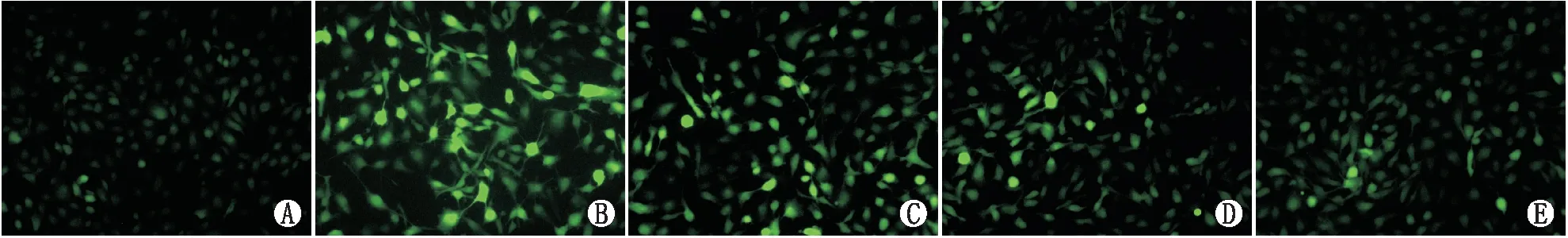
图1 各组ARPE-19细胞内ROS含量的变化 A:正常细胞对照组;B:光诱导细胞损伤组;C:细胞低剂量组;D: 细胞中剂量组;E: 细胞高剂量组。荧光强度反映细胞内ROS含量;×200
2.2 动物实验结果
2.2.1 枸杞子提取物对光诱导损伤小鼠血清抗氧化能力的影响与动物对照组相比,光诱导动物损伤组小鼠血清中MDA含量显著增加,SOD和GSH-Px活性均显著降低(均为P<0.05);与光诱导动物损伤组相比,动物低、中、高剂量组小鼠血清中MAD含量均显著降低,血清中GSH-Px和SOD活性均明显升高,并均呈剂量依赖性(均为P<0.05)。见表1。
表1 各组小鼠血清中MDA含量和SOD、GSH-Px活性
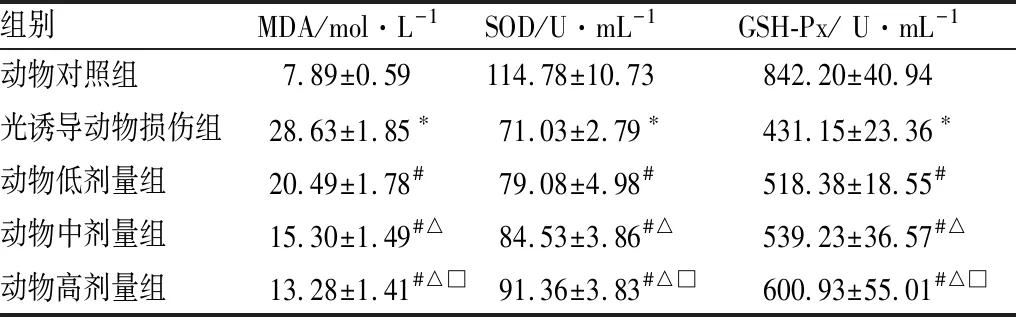
组别MDA/mol·L-1SOD/U·mL-1GSH-Px/ U·mL-1动物对照组7.89±0.59114.78±10.73842.20±40.94光诱导动物损伤组28.63±1.85∗71.03±2.79∗431.15±23.36∗动物低剂量组20.49±1.78#79.08±4.98#518.38±18.55#动物中剂量组15.30±1.49#△84.53±3.86#△539.23±36.57#△动物高剂量组13.28±1.41#△□91.36±3.83#△□600.93±55.01#△□
注:与动物对照组相比,*P<0.05;与光诱导动物损伤组相比,#P<0.05;与动物低剂量组相比,△P<0.05;与动物中剂量组相比,□P<0.05
2.2.2 枸杞子提取物改善光诱导损伤小鼠的视网膜功能ERG检测结果显示,与动物对照组相比,光诱导动物损伤组暗适应a波和b波振幅以及明适应b波振幅均显著降低(均为P<0.05)。与光诱导动物损伤组相比,动物低、中、高剂量组暗适应a波和b波振幅以及明适应b波振幅均明显升高(均为P<0.05)。见表2。
表2 各组小鼠ERG检测结果
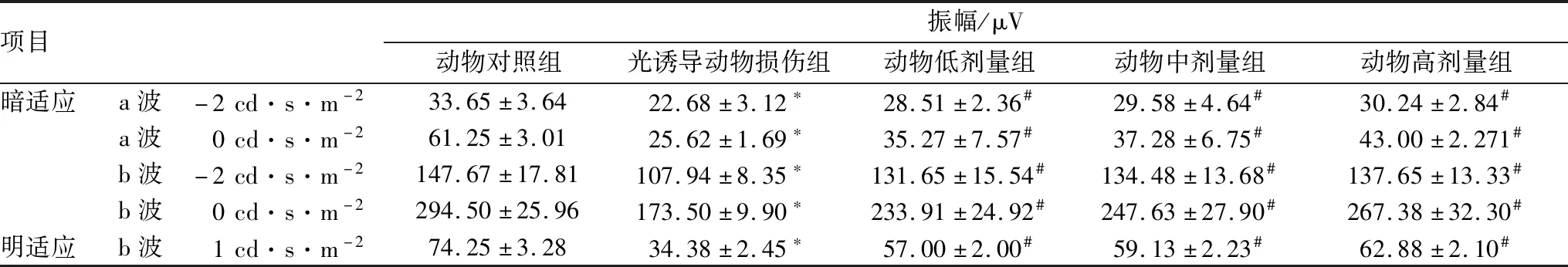
项目振幅/μV动物对照组光诱导动物损伤组动物低剂量组动物中剂量组动物高剂量组暗适应a波-2cd·s·m-233.65±3.6422.68±3.12∗28.51±2.36#29.58±4.64#30.24±2.84#a波0cd·s·m-261.25±3.0125.62±1.69∗35.27±7.57#37.28±6.75#43.00±2.271#b波-2cd·s·m-2147.67±17.81107.94±8.35∗131.65±15.54#134.48±13.68#137.65±13.33#b波0cd·s·m-2294.50±25.96173.50±9.90∗233.91±24.92#247.63±27.90#267.38±32.30#明适应b波1cd·s·m-274.25±3.2834.38±2.45∗57.00±2.00#59.13±2.23#62.88±2.10#
注:与正常动物对照组相比,*P<0.05;与光诱导动物损伤组相比,#P<0.05
2.2.3 枸杞子提取物减轻光诱导损伤导致的视网膜血管渗漏FFA检测结果显示,光诱导动物损伤组小鼠视网膜萎缩灶对应区血管有渗漏。 渗漏面积在FFA 3 min时开始逐渐增大,并在10 min时面积达到最大,部分血管扭曲,血管末端成珠样结构。与光诱导动物损伤组相比,动物低、中、高剂量组小鼠视网膜萎缩灶、血管渗漏和血管末端成珠样结构都得到不同程度改善,其中,动物低剂量组改善相对轻微,动物高剂量组改善相对较明显。见图2。
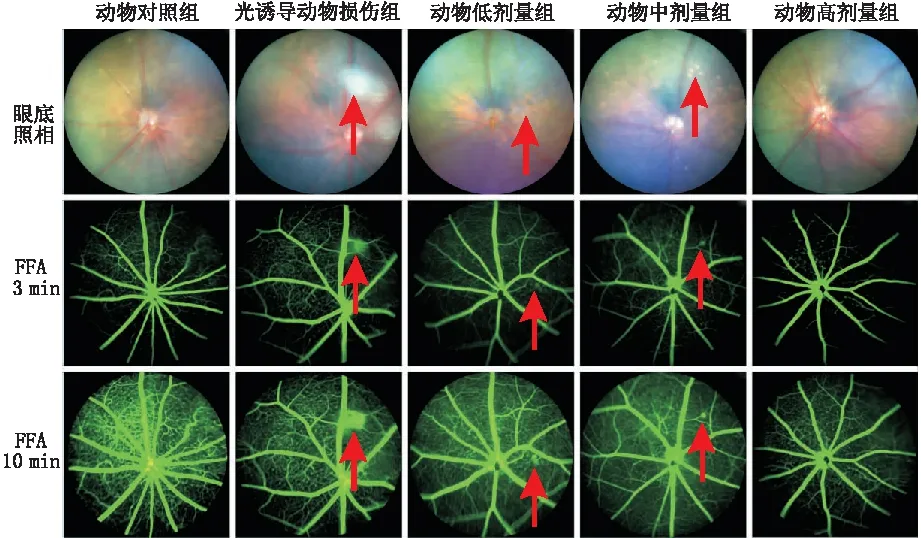
图2 各组眼底照相及对应FFA检测结果 红箭头示视网膜萎缩区
2.2.4 枸杞子提取物改善光诱导损伤小鼠的视网膜ONL厚度OCT检测结果显示,与动物对照组视网膜ONL厚度(61.23±3.59)μm相比,光诱导动物损伤组小鼠ONL厚度为(52.18±4.23)μm,变薄约14.78%(P=0.010);与光诱导动物损伤组相比,动物高剂量组ONL厚度得到明显改善,为(59.72±2.76)μm,改善 14.45%(P=0.007);而动物低、中剂量组对ONL厚度改善不明显,分别为(56.24±4.18)μm、(57.11±4.09)μm,分别改善9.12%(P=0.543)、10.79%(P=0.208)。见图3。
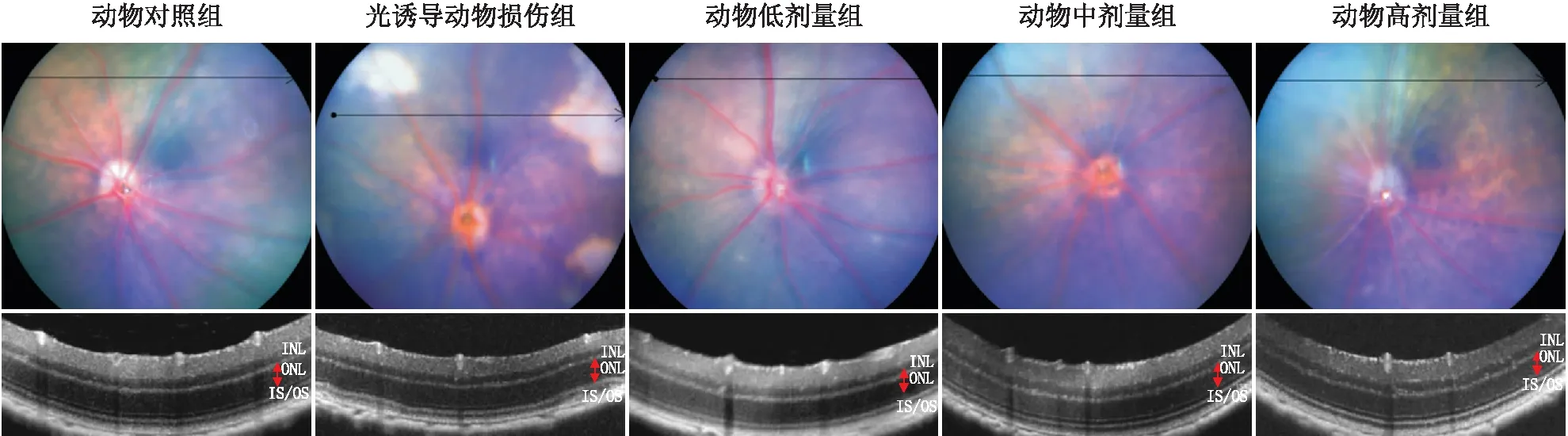
图3 各组小鼠眼底照相和对应OCT图像示视网膜ONL厚度变化 所有视网膜OCT图像均来自于视盘上方一个视盘直径处的视网膜扫描。INL:内核层;IS/OS:视锥视杆细胞层
2.2.5 枸杞子提取物改善光诱导损伤的视网膜ONL细胞数HE染色后计数ONL细胞数,结果显示,光诱导动物损伤组小鼠ONL每列细胞数为(17.63±1.30 )个,与正常动物对照组ONL每列细胞(22.13±1.13)个相比减少19.20%(P<0.001);动物低、中、高剂量组ONL细胞数每列分别为(19.13±0.99)个、(19.38±1.06)个、(20.00±1.51)个,与光诱导动物损伤组相比,分别改善11.86%、16.05%、16.78%(P=0.184、0.067、0.004)。见图4。
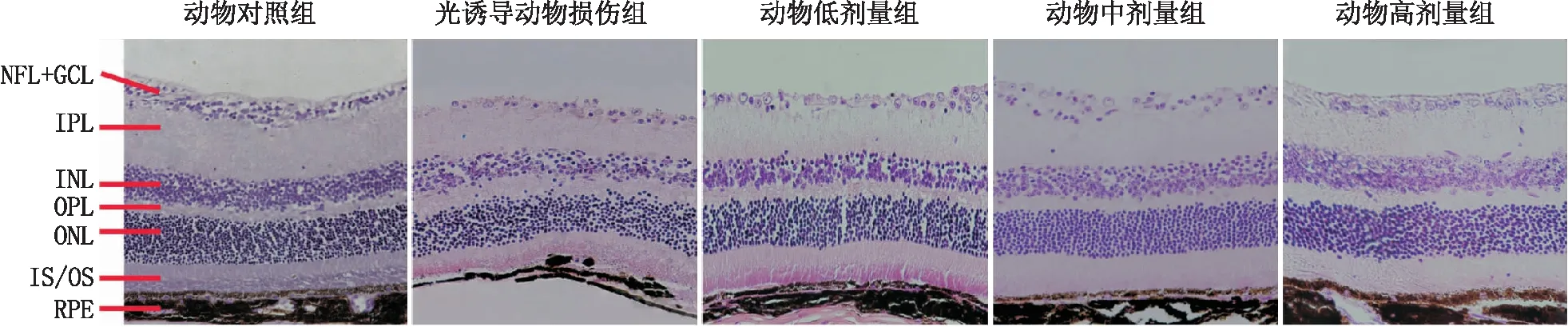
图4 各组小鼠HE染色示视网膜ONL细胞数变化 NFL:神经纤维层;GCL:神经节细胞层;IPL:内丛状层;INL:内核层;OPL:外丛状层;IS/OS:视锥视杆细胞层
3 讨论
枸杞是传统的抗衰老中药。枸杞子提取物中主要活性成分枸杞多糖具有多种调节细胞生理的生物活性,对视神经元具有保护作用[19]。然而,枸杞子提取物对光感受器神经元的保护人们知之甚少。因此,我们建立ARPE-19细胞光诱导损伤的体外模型,以及建立C57BL/6J小鼠光诱导损伤的在体模型,用以评价枸杞提取物对视网膜光诱导损伤的保护作用。
有研究表明,光诱导的氧化是细胞凋亡之前的早期事件[20],凋亡是光诱导的视网膜损伤模型中细胞死亡的主要途径[21]。本研究结果显示,在体外实验中,ARPE-19细胞在给予(2500±500)lux光照处理后,细胞活力下降为正常细胞对照组的61.88%,而在给予低、中、高剂量的枸杞子提取物处理后,细胞活力分别提高到78.65%、88.95%和93.84%,说明枸杞子提取物浓度为0.1~1.0 g·L-1时能显著降低光诱导ARPE-19细胞的损伤,且呈浓度依赖性。ROS可使细胞处于氧化应激状态,从而对细胞造成一系列损伤,诱发视网膜变性和感光细胞凋亡,或进一步导致视力丧失。本研究结果显示,低、中、高剂量枸杞子提取物使光诱导损伤的ARPE-19细胞内ROS 含量由152.00%分别减少到134.17%、125.16%和117.76%,呈剂量依赖性,即在安全剂量范围内,剂量越高,对光诱导损伤的ARPE-19细胞内ROS的清除就越明显,这与Silván等[22]的研究结果一致。说明枸杞子提取物可以通过抑制氧化应激来防止光诱导损伤的ARPE-19细胞内ROS含量的增加,从而保护ARPE-19细胞免受氧化损伤。
暗适应 ERG a 波、b波振幅以及明适应 ERG b波振幅反映了视网膜视细胞层的功能。本研究ERG检测结果显示,光诱导损伤使暗适应a波和b波振幅以及明适应b波振幅均显著降低,表明视网膜功能出现障碍且功能障碍源自视细胞层。给予枸杞子提取物干预后,暗适应a波和b波振幅以及明适应b波振幅都得到明显改善,表明枸杞子提取物对视细胞层有保护作用。从视网膜结构出发讨论,视网膜光感受细胞的细胞核主要集中在ONL。所以我们对小鼠视网膜ONL进行了细胞计数,观察是否ERG的异常出自光诱导对该层的损伤。结果显示,光诱导确实使ONL细胞数明显降低,这和Zhao等[23]的研究结果一致 。然而,和ERG结果相比,并不是动物低、中、高剂量组的枸杞子提取物干预都使视网膜ONL厚度和细胞数明显改善,只有动物高剂量组使光诱导损伤小鼠视网膜ONL厚度和细胞数均明显增加(P=0.007、0.004),ERG结果与ONL结果存在矛盾,与Ishihara等[24]的研究结果一致。对于该现象的解释可能为, ERG表现的是完整的视网膜功能, ONL的变化或许在功能上只是ERG的组成部分,除此之外,光诱导损伤还导致了视网膜其他层的异常[25]。但高剂量枸杞子提取物在视网膜形态学和组织学上都显著抑制了光诱导的损伤,因此,本研究结果表明,枸杞子提取物在一定程度上可有效保护视网膜免受光诱导的伤害。
从FFA检查结果可知,光诱导损伤会使小鼠视网膜血管情况变差,主要表现为视网膜局部萎缩灶形成和相应区域血管渗漏以及血管末端成珠样结构改变;低、中、高剂量枸杞子提取物对血管有一定的保护作用,但不能完全消除光诱导损伤对小鼠视网膜血管的损害,这除了可能与药物经口服入血后血中药物浓度相对较低外,可能还与血-眼屏障和血-视网膜屏障有关,眼局部药物浓度相对血中药物浓度显著降低。
对于抗氧化剂全身给予后是否作用于视网膜起到的保护作用,我们通过对血清抗氧化能力进行了评估。过强的光诱导能导致小鼠血清中MDA含量增加,SOD和GSH-Px活力降低,摄入低、中、高剂量枸杞子提取物后,小鼠血清中MDA含量显著下降、SOD和GSH-Px活力均显著升高。Ishihara等[24]研究抗氧化剂对视网膜的保护作用也显示,口服抗氧化剂A型原花青素可提高全身潜在的抗氧化能力,通过增加全身的抗氧化能力而抑制了来自ROS的脂质过氧化,因此减少了由光诱导引起的氧化应激并抑制了视网膜的光损伤。这和我们研究枸杞子提取物对视网膜抗氧化能力时,对血清抗氧化能力的评估结果基本一致。另外,我们对血清抗氧化指标评估时还发现,枸杞子提取物的抗氧化能力似乎具有剂量依赖性,但是在研究枸杞子提取物对视网膜光诱导损伤的保护作用时,虽然有明显的保护作用,但是并不存在剂量依赖性,这可能是由于血-眼屏障和血-视网膜屏障的作用导致。
综上所述,枸杞子提取物能有效抑制光诱导损伤所致ARPE-19细胞活力降低,减少细胞内ROS含量,提高C57BL/6J小鼠视网膜及血清的抗氧化能力, 从而保护视网膜免受光诱导损伤。而且,枸杞子提取物来源于植物,可以口服,无明显毒副作用,可能对AMD的发生和发展有一定的预防作用,但还需要更多的实验来加以证明。

