纳米二氧化钛光催化剂的制备与表征
乔一佳 孙 健 李 静 李 莹 王 安
河南建筑材料研究设计院有限责任公司(450002)
随着经济发展和科技进步,地球资源、能源日益紧张,大量排放的工农业污染物和生活废弃物使生态迅速恶化,环境危机逐步加剧[1]。光催化剂(photocatalyst)具有优良的反应活性和氧化还原能力,在高能光线照射下能将光能转变为化学能,实现污染物降解,CO2及重金属离子还原,物体表面自清洁,有力缓解当前环境污染,在废水处理、空气净化、医疗美容、轻工业等领域展现出广阔应用前景。
TiO2是一种常见无机矿物,有锐钛矿、金红石、板钛矿三种晶体结构,具有能带较宽、折光率和介电常数较高、导热系数低、物化性质稳定、清洁无毒、成本低廉、来源广泛等特点[2-4],是光催化领域最受关注、研究最深入的物质,被广泛应用于光解水制氢、氧化分解有机物、制备太阳能敏化电池、制备白色自清洁涂料及反射型隔热涂料等[5-6]。其作用原理为:纳米TiO2的核外电子层包含价电子带和空轨道传导带,当受紫外线照射时,比禁带宽度能量大的光线被吸收,使价带的电子激发至导带而出现空穴,形成容易移动且活性很强的电子空穴对。电子空穴对可通过氧化还原反应重新结合,以热量或荧光形式释放能量,也可以解离成能自由迁移到晶格表面或其他反应场所并立即被表面基团捕获的自由空穴和自由电子。TiO2中Ti-O键极性强,表面吸附的水因极化发生解离产生羟基,捕获自由空穴形成羟基自由基,而自由电子与吸收态氧气结合产生超氧自由基,从而氧化分解有机物或杀灭细菌病毒[7-8]。
由于TiO2禁带相对较宽(带隙能约3.2eV),主要吸收短波区域的紫外光(100~400 nm),对长波方向的可见光(400~760 nm)吸收很少,并且受激发产生的电子空穴对容易重新结合,光量子效率偏低,严重制约了实际应用效果。因此,提高TiO2的光量子效率和催化活性成为近年的研究重点。资料表明[9-10],纳米TiO2的表面羟基可提高其作为吸附剂及各种单体的性能。对TiO2进行表面改性,可以降低光生电子空穴对复合率,扩大波段吸收范围,提高其光催化效率。
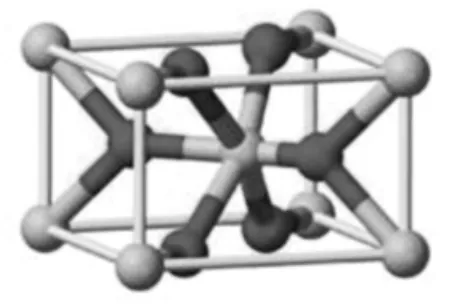
图1 (金红石相)二氧化钛晶体结构示意图
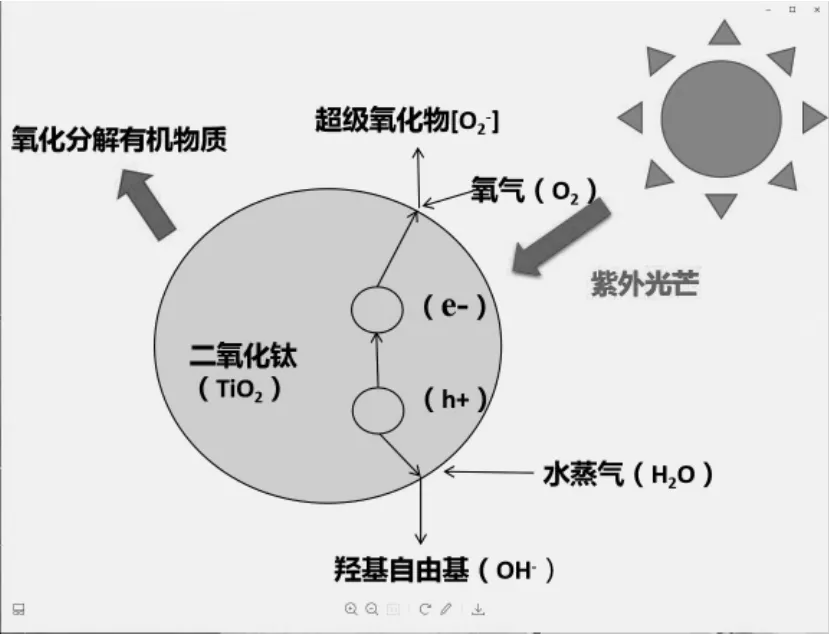
图2 二氧化钛光催化原理示意图
1 纳米二氧化钛的制备
纳米TiO2制备通常分为物理法和化学法。物理法又称机械粉碎法,对粉碎设备要求很高。化学法可分为气相法(CVD)、液相法和固相法。其中液相法最为常用,包括水热法、溶胶法、溶胶-凝胶法和沉积法。液相法指选择可溶于水或有机溶剂的金属盐类,令其以离子或分子状态混匀,再采用合适的沉淀剂或通过蒸发、结晶、升华、水解等步骤,使金属离子均匀沉淀或结晶析出,再经脱水或热解制得粉体。
水热合成法又称高压溶液法,指在密闭体系、较高温度和水自生压力下,使标准气压下难溶于水的物质得以溶解、分散和反应,生成该物质的水解产物,达到一定的过饱和度后,令其自行结晶和生长。通过改变钛源、原料配比、酸碱度、温度、压力、反应时长,可以得到多种组分、晶型、粒度、形貌的纳米TiO2样品。该法无需高温焙烧,低碳污染小,设备工艺简单,反应易控且副反应少,制备的TiO2结晶完整、粉末均匀、纯度较高,但缺点是钛源通常成本较高,如四氯化钛、异丙醇钛、硫酸氧钛等。
1.1 试剂与仪器
1.1.1 样品制备原材料
钛酸正丁酯(TBT,C16H36O4Ti)、氢氟酸(HF)、无水乙醇(CH3CH2OH)、去离子水等。其中试剂来自天津市北联精细化学品开发有限公司,均为分析纯(analytical reagent)。
1.1.2 样品制备所需仪器设备
水热高压反应釜(100 mL,不锈钢,济南恒化科技有限公司)、电热恒温鼓风干燥箱(DGG-9070B型,上海森信实验仪器有限公司)、高速冷冻离心机(GL-23M型,湖南湘仪实验室仪器开发有限公司)、溶剂过滤器(500 mL,上海力玻仪器)、全玻璃微孔滤膜过滤器、砂芯过滤装置。
1.2 试验步骤
向水热高压反应釜中加入钛源和无机酸类混合物,以去离子水或无水乙醇作为溶剂,高温高压下经过系列反应,合成多种型态的纳米TiO2粉体。具体步骤:量取5.0 mL钛酸正丁酯,缓慢加入约50 mL去离子水中,记为溶液A;将1.2 mL氢氟酸逐滴加入溶液A中,滴速控制在2~3滴/秒,记为溶液B;将溶液B置于磁力搅拌器上低速搅拌30 min,而后移入聚四氟乙烯内衬反应釜中,置于恒温干燥箱内,在180℃下保温24 h,以促成必要的水解、缩聚反应;将混合液离心、摒弃溶剂并过滤,得到固体微粒,用去离子水与无水乙醇反复洗涤3次,再经冷冻干燥和手工研磨,得到纳米TiO2光催化剂。
2 纳米二氧化钛的形貌表征
采用扫描电子显微镜和能谱仪(JSM-7500F型,日本电子株式会社,电压5~20 kV,放大倍数1万~20万倍),观测市售纳米TiO2及采用上文方法步骤制备TiO2样品的表面形貌,结果如图3和图4所示。
由图3可见,市售纳米TiO2固相结构完整,表面平整细腻,且具有明显光泽,但粉末团聚板结现象十分严重,导致微粒总比表面积减小,不利于作为催化剂参与反应。同时体系内部气孔少,分散性差,光催化反应时吸附的杂质不易清洗。TiO2的回收和重复利用困难,从而限制了其广泛使用。

图3 市售纳米二氧化钛的SEM形貌

图4 实验室制备二氧化钛样品的SEM形貌
由图4可见,采用以上方法步骤制备的纳米TiO2粉末疏松、颗粒分明,且粒径分布均匀,表面形成大量气孔通道,易于吸附待降解的污染物,并为光催化反应提供场所。在此基础上,后续亦便于对样品进行表面改性处理,如采用三乙醇胺(TEOA)、十二烷基硫酸钠(SDS)、聚乙烯吡咯烷酮(PVP)等常见表面活性剂,令其均匀沉降包覆在TiO2颗粒上,或将过渡金属的硝酸盐加入氨水中溶解,得到含有金属氨络合离子的溶液,经过水热反应、过滤洗涤干燥等操作,最终将金属粒子均匀负载于纳米TiO2表面。
3 结语
文章以钛酸正丁酯为原料,利用水热法制备出表观状态优于市售TiO2的粉末疏松、颗粒分明的纳米TiO2光催化剂。通过调整原料配比等,可控制TiO2微粒的形貌结构,尽可能增大催化剂的比表面积,提高反应物与活性位点接触的概率,从而提高有机污染物等的降解效率。此外,采用文中方法制备的纳米TiO2样品具有化学性质稳定、成本较低、易于改性等特点,应用前景可观、值得深入研究。

