剖宫产瘢痕妊娠的MRI表现及其临床价值
张 丽 汤春贵 骆俊杰
四川省雅安市人民医院放射科,四川雅安 625000
剖 宫 产 瘢 痕 妊 娠(cesarean scar pregnancy,CSP)是一种特殊类型的异位妊娠,是指孕囊着床于前次剖宫产子宫切口瘢痕处。作为剖宫产的远期并发症,容易发生子宫破裂、大出血等严重并发症,是妇产科、计划生育科极为风险的病症[1]。近年来,我国孕妇剖宫产率高达46.2%[2]。随着剖宫产率增加,其发生率逐年上升,早期影像学诊断有助于指导患者的治疗。本研究通过对2017 年5 月~2018年12 月医院收治的28 例临床怀疑CSP 患者的MRI 图像结合临床表现制定的治疗的结局进行回顾性分析,探讨MRI 检查在CSP 诊治中的作用。
1 资料与方法
1.1 一般资料
2017 年5 月~2018 年12 月在我院怀疑并收治的CSP,患者入选标准为至少有一次剖宫产史,经超声检查怀疑CSP,并进行了MRI 检查。患者平均年龄(31.9±5.6)岁,平均停经时间(56±10)d,血绒毛膜促性腺激素阳性。临床表现:28 例患者中18 例表现为阴道出血,5 例患者表现为腹痛,另5 例患者没有明显不适。
1.2 检查方法
采 用GE 3.0T-750W 超 导MR 扫 描 仪,16 通道体部相控阵表面线圈。患者取仰卧位,扫描范围包括整个盆腔。主要扫描序列:矢状位快速自选回波(FSE)T2WI 脂肪抑制序列:TR 4368ms,TE 101ms,FOV 28cm,层厚4mm,层间距1mm;横轴位FSE T1WI:TR 627ms,TE 9.2ms,FOV 42cm,层 厚5mm,层间距1mm;横轴位FSE T2WI:TR 6202ms,TE 107ms,FOV 42cm,层厚5mm,层间距1mm;扩散加权成像(DWI)序列:b 值800s/mm2,TR 4358ms,TE 69.6ms,FOV 42cm,层厚5mm,层间距1mm。

表1 患者MRI表现

表2 MRI检查诊断CSP与病理结果对照
1.3 图像分析
由2 位具有丰富MRI 诊断经验的高级职称医师在不知病理情况下对图像进行单独阅片分析,如有不同意见经讨论后达成一致。主要观察指标有:(1)剖宫产瘢痕厚度;(2)孕囊位置与大小;(3)CSP 类型:分为两型(根据孕囊种植深度和生长方向)[3]。内生型:孕囊种植于子宫瘢痕表面,向宫腔内生长;外生型:孕囊种植于子宫瘢痕内,向子宫肌层生长甚至突破子宫浆膜层。(4)孕囊血供:根据孕囊周围是否有丰富血管流空影分为血供丰富和乏血供两类。
1.4 统计学方法
应用SPSS22.0 统计学软件,计算MRI 诊断CSP的准确率、敏感度、特异度、阳性预测值、阴性预测值,MRI 诊断与病理结果一致性比较用Kappa 检验。
2 结果
2.1 MRI表现
所有28 例患者MRI 图像上均能明确显示剖宫产瘢痕,瘢痕均位于子宫下段前壁。MRI 表现为子宫壁于瘢痕处明显的变薄,子宫肌层连续性中断(图1),瘢痕厚度平均(3.43±1.44)mm。28 例均清楚显示孕囊,孕囊大小平均(17.75±28.33)cm3。1 例孕囊位于子宫体部,边缘距离剖宫产瘢痕约2.9cm,其余27 例孕囊均位于子宫峡部,孕囊与子宫瘢痕关系密切(图1 ~4)。T1WI 发现出血16 例(图2b)孕囊周围见丰富血管流空6 例(图3)。囊状孕囊25 例,21 例孕囊为长T1 长T2 信号,4 例孕囊中可见斑点状短T2 信号胚芽,3 例包块状孕囊,表现为不规则团块状长、短T1 长、短T2 混杂信号(图4)。见表1。
2.2 术后病理结果与MRI检查比较
术后病理诊断CSP25 例,其中CSP1 型16 例,CSP2 型9 例,其余3 例为宫内妊娠。MRI 正确诊断CSP24 例,其中诊断为CSP1 型15 例,CSP2 型9 例,2 例宫内妊娠误判为CSP,诊断宫内妊娠2 例,其中1 例为CSP。患者MRI 检查结果与病理诊断对照,MRI 诊断CSP 准确率、灵敏度、特异度、阳性预测值和阴性预测值分别为89.3%,96.0%,33.3%,92.3%,50.0%(表2),MIR 检查与病理结果比较一致性较弱,Kappa 值0.344(P >0.05)。
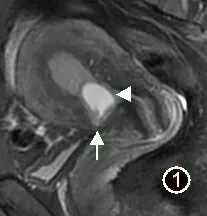
图1 女,40 岁,CSP,矢状位FST2WI 序列,显示子宫前下壁肌层变薄,邻近宫腔见类圆形高信号孕囊(箭头),下缘与子宫前下壁切口紧贴(箭)
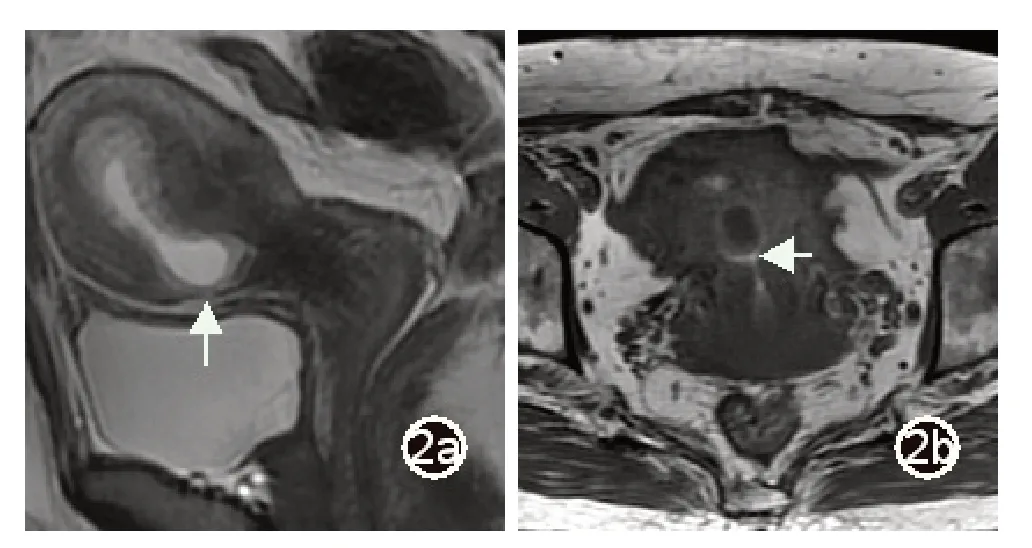
图2 女,33 岁,CSP,图2a 为矢状位T2WI 序列,显示子宫前下壁纤维瘢痕,该处肌层明显变薄,信号减低(长箭),与高信号孕囊紧贴,图2b 为轴位T1WI 序列,宫腔内见高信号出血(短箭)
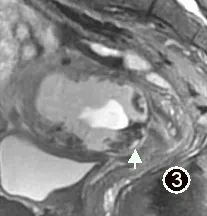
图3 女,43 岁,CSP,矢状位FST2WI,子宫前下壁瘢痕处见大量低信号流空血管
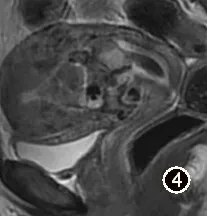
图4 女,32 岁,包块型CSP,矢状位FST2WI,子宫腔内见团块状高、低混杂信号病灶,与子宫前下壁瘢痕紧密相贴
3 讨论
剖宫产术后瘢痕妊娠(CSP)是一种罕见的异位妊娠,近年来,随着临床剖宫产率的增加以及目前二胎政策的放开,CSP 的发病率有不断增高的趋势[4]。
目前,CSP 的发病机制尚未明确,多数学者支持子宫切口缺损学说,认为子宫下段剖宫产后存在裂隙,孕卵种植于切口处,该区存在内膜缺损[5]。CSP 的临床表现缺乏特异性,早期症状多不明显,大部分患者以阴道流血为首发症状,仅16%的患者存在轻~中度腹痛,9%的患者主诉仅仅是轻度腹痛而无阴道流血,近40%的患者可无任何症状[6]。随着患者孕龄的增加,孕囊的增大及绒毛组织对肌层的侵袭,如没有及时得到正确诊断和处理,最终可能导致子宫破裂、大出血。张淋淋[7]认为病灶大小、分型、血流分级及瘢痕厚度为CSP 大出血的危险因素。早期明确诊断,尽早清除妊娠物,修复损伤的瘢痕是治疗原则[8],临床更注重个性化治疗[9],需要对CSP 进行充分的术前评估,也凸显出准确的术前影像诊断的重要性。
超声检查是筛查CSP 的重要方法,超声检查具有无创、简便,具有可重复性的优点。超声诊断CSP的符合率高,可达85.5%[10],可以较好判断CSP 类型,建立了比较成熟的标准,指导临床治疗[4,9]。虽然超声对CSP 具有较高的诊断正确率,但表现不典型者仍可能被误诊,特别是包块型的CSP,由于是不全流产后形成,是妊娠残留物和凝血块组成的混合包块,已不具有完整的孕囊,超声图像容易和滋养细胞疾病混淆,误诊率较高[10]。本研究中,1 例CSP超声误诊为宫内早孕,1 例包块型CSP,超声诊断为绒毛膜癌,1 例在外院超声中诊断为宫颈妊娠,均在MRI 检查后得以正确诊断。
MRI 检查具有组织分辨率高和多方位、多序列成像及大视野的特点,相对于超声检查,MRI 检查更加清晰,能够显示更多细节,可以对肌层及宫旁组织的病变范围进行全面评价。MRI 检查近年应用于CSP 的诊断,逐渐凸显出其在CSP 分型及指导临床治疗上的优势与重要作用[11-12]。
CSP 的MRI 诊断目前尚无明确标准,雷岩等[11]认为以下MRI 特点可提示CSP:(1)孕囊位于子宫前壁下段峡部瘢痕及瘢痕周围0 ~2lmm 以内,局部肌层变薄;(2)膀胱与妊娠囊间肌壁薄弱;(3)宫颈管内无孕囊。
MRI 检查可清晰显示CSP 的孕囊在子宫着床的位置,并对其进行分型,显示子宫瘢痕的厚度,孕囊与周围组织的关系和周围血运的情况(包括胎盘内或外),有无新鲜或陈旧性出血,这些可作为评估预后的有力指标,并决定手术方式的选择。
MRI 可以对子宫瘢痕厚度进行精确测量。子宫瘢痕的厚度可以提示发生子宫破裂的风险,当其<2mm 时,清宫时极易发生大出血和子宫破裂[7]。外生型CSP 的瘢痕厚度平均为2mm 左右,且有56.3%的病例<2mm,临床上对于影像提示外生型CSP 的患者治疗手段更为积极,多采用子宫动脉栓塞术后宫腹腔镜下孕囊摘除术加瘢痕修补术,以最大限度减少子宫破裂风险。而内生型的CSP,其瘢痕厚度平均达4.55 mm,一般不小于2mm,其治疗相对简单,疗效也较好[12]。本研究中外生型CSP 瘢痕厚度<2mm 的有7 例,内生型CSP 瘢痕厚度均>2mm,本研究发现瘢痕厚度的最佳观察序列为矢状位压脂T2WI 序列。
孕囊周围血供情况能影响子宫动脉栓塞术的栓塞材料的选择和用量,也能影响清宫术的出血量,是术前重要的参考信息[13]。MRI 的T2WI 序列对孕囊周围的血管流空信号敏感,可以比较好的显示孕囊周围血供情况。本研究中发现孕囊周围见丰富血管流空6 例,术中发现有大量新生血管。
MRI 可以清楚显示孕囊与瘢痕之间关系,主要表现在两者相交长度,相交长度越大,绒毛越可能植入,子宫肌层,剥离难度亦随之增大,子宫破裂或大出血发生风险亦越高[14]。而超声受分辨率所限,仅能根据CSP 的孕囊周边血流分布情况对绒毛与切口肌层是否发生粘连或者植入进行预测[15]。本组病例MRI 检查与病理结果一致性较弱,可能与病例数太少有关,在后续研究中需要补充更多病例进行分析。
CSP 的MRI 影像特点为妊娠物于子宫前壁瘢痕处种植。MRI 除可对CSP 进行明确诊断外,还可提供瘢痕厚度、孕囊周边血供等多种诊断信息,可为临床治疗提供重要指导。有剖宫产术史的患者再次妊娠时尽早行B 超检查以筛查CSP,当可疑CSP 而B 超检查不能确诊时,应尽早进行MRI 检查明确诊断,B 超检查提示为CSP,MRI 检查也可以起到很好的补充诊断作用。

