奇亚籽油微胶囊的制备
罗文涛,王姿颐,彭彬倩,沈晓芳
(江南大学 食品学院,江苏 无锡,214122)
奇亚籽(chia seed)是1年生草本植物芡欧鼠尾草(SalviahispanicaL.)的种子,原产于危地马拉北部和墨西哥南部地区,主要生长在热带和亚热带气候的山区,能够很好地适应干旱和半干旱气候[1-4]。营养全面且丰富,是油脂、膳食纤维和蛋白质的绝佳来源,同时还富含生育酚、甾醇、多酚类等多种抗氧化活性化合物[5-7]。奇亚籽含油率为20%~35%,油中多不饱和脂肪酸含量极高,特别是α-亚麻酸的含量,高达68%,远高于亚麻籽油、大豆油、葵花籽油[8-13]。由于奇亚籽油中不饱和脂肪酸含量高,不饱和键较多,在光照、热、氧气存在的情况下不稳定,极易氧化变质。为解决这一问题,除了传统的改变储藏环境、添加脱氧剂和抗氧化剂等方法以外,微胶囊技术作为一种新的解决方案,即将油脂包埋起来,减少油脂受外部不良环境的影响,达到保护和防止氧化的目的[14-15]。同时将液态的油转化为固态的粉末油脂,拓宽了其应用范围,而且有利于储藏和运输,并在某种程度上能够实现控制释放。
本实验以大豆分离蛋白(soy protein isolate,SPI)和麦芽糊精(maltodextrin,MD)为壁材、奇亚籽油为芯材、单硬脂酸甘油酯和蔗糖脂肪酸酯为乳化剂,利用喷雾干燥技术制备奇亚籽油微胶囊,以微胶囊包埋率作为评价指标,研究包埋工艺。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
奇亚籽(Naturkost de Mexico,原产地墨西哥);大豆分离蛋白、麦芽糊精、单硬脂酸甘油酯、蔗糖脂肪酸酯,均为BR级,上海源叶生物科技有限公司;石油醚(60~90 ℃),AR级,国药集团化学试剂有限公司。
1.1.2 仪器与设备
三柱A型液压榨油机,天津市伺达机械制造有限公司;BSA124S分析天平,赛多利斯科学仪器(北京)有限公司;GC-2030 气相色谱仪,日本岛津公司;RV8旋转蒸发仪,德国IKA工业设备;T18数显型分散机,德国IKA工业设备;ATS AH-2010 高压均质机,安拓思纳米技术(苏州)有限公司;SD-1500喷雾干燥机,上海沃迪智能装备股份有限公司;su1510扫描电子显微镜,日本日立株式会社;D2 PHASER X射线衍射仪,德国布鲁克AXS有限公司;IS10傅里叶变换红外光谱仪,美国Nicolet公司;TGA2热分析系统,梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 奇亚籽油的制备
将奇亚籽样品置于电热鼓风干燥箱内,60 ℃下烘烤2 h,而后置于干燥器内冷却备用。采用液压法压榨制备奇亚籽油样,所得油样于3 000 r/min 离心15 min,取上清油样密封避光保存,并于4 ℃储藏直至使用。
1.2.2 奇亚籽油基本理化指标的测定
酸价参考《食品中酸价的测定》(GB 5009.229—2016)冷溶剂指示剂滴定法;过氧化值参考《食品中过氧化值的测定》(GB 5009.227—2016)中滴定法;皂化值参考《动植物油脂 皂化值的测定》(GB/T 5534—2008);水分及挥发物含量参考《动植物油脂 水分及挥发物的测定》(GB 5009.236—2016)、脂肪酸含量参考《食品中脂肪酸的测定》(GB 5009.168—2016)。
1.2.3 奇亚籽油微胶囊的制备
将复配乳化剂[m(单硬脂酸甘油酯)∶m(蔗糖脂肪酸酯)=1∶4,HLB=12.76]溶解在70 ℃蒸馏水中,完全溶解后,称取一定量的复配壁材(SPI与MD)溶于蒸馏水中,恒温搅拌至完全溶解,接着逐滴加入奇亚籽油,室温下搅拌30 min。
将上述溶液置于高剪切分散机中进行乳化,以10 000 r/min的速度剪切5 min,而后通过高压均质机,调整均质压力至60 MPa,均质5次,制得均匀分散的O/W型乳液。
通过喷雾干燥对O/W型乳液进行干燥,设置进风口温度为180 ℃,出风口温度为85 ℃,蠕动泵转速600 mL/h,撞针时间为1 s,撞针间隔为4 s。将制得的均匀分散的O/W型乳液通过蠕动泵进样,待干燥完成后,在收集瓶中收集微胶囊样品。
1.2.4 单因素实验
1.2.4.1 芯壁比
在复配壁材比[m(SPI)∶m(MD)]为1∶2、乳化剂添加量为1.0%(质量分数,以下相同)、固形物含量为20%(质量分数)的条件下,分别制备芯壁比(芯材与壁材质量比)为1∶1、1∶2、1∶3、1∶4、1∶5的微胶囊,并测定奇亚籽油微胶囊的包埋率。
1.2.4.2 壁材复配比
在m(芯材)∶m(壁材)=1∶2、乳化剂添加量为1.0%(质量分数)、固形物含量为20%(质量分数)的条件下,分别制备复配壁材比为2∶1、1∶1、1∶2、1∶3、1∶4的微胶囊,并测定奇亚籽油微胶囊的包埋率。
1.2.4.3 乳化剂添加量(质量分数)
在m(芯材)∶m(壁材)=1∶2、m(SPI)∶m(MD)=1∶2、固形物含量为20%(质量分数)的条件下,分别制备乳化剂添加量为0、0.5%、1.0%、1.5%、2.0%(质量分数)的微胶囊,并测定奇亚籽油微胶囊的包埋率。
1.2.4.4 固形物含量(质量分数)
在m(芯材)∶m(壁材)=1∶2、m(SPI)∶m(MD)=1∶2、乳化剂添加量为1.0%(质量分数)的条件下,分别制备固形物含量为15%、20%、25%、30%、35%(质量分数)的微胶囊,并测定奇亚籽油微胶囊的包埋率。
1.2.5 正交设计
在单因素实验的基础上,对芯壁比、壁材复配比、乳化剂添加量、固形物含量4个因素进行优化,以奇亚籽油微胶囊的包埋率为指标,通过正交试验对奇亚籽油微胶囊的制备工艺进行优化,实验因素和水平表见表1。

表1 正交实验因素水平表Table 1 The orthogonal experimental factors and levels
1.2.6 包埋率的测定
1.2.6.1 总含油率的测定
总含油率的测定采用索氏抽提法。称取1~2 g奇亚籽油微胶囊产品放入滤纸筒内,将滤纸筒置于抽提管中,抽提管下部连接接收瓶,上部连接冷凝管,加入石油醚至接收瓶中,并将接收瓶置于电热套中加热,使石油醚不断回流抽提,抽提8 h后取下接收瓶,利用旋转蒸发仪回收溶剂,最后置于105 ℃烘箱中干燥至恒重,即可计算微胶囊总含油率。
1.2.6.2 表面含油率的测定
称取1~2 g奇亚籽油微胶囊产品于锥形瓶中,加入20 mL石油醚振荡30 s,紧接着使用滤纸过滤,并用10 mL石油醚洗涤滤渣数次,合并滤液,利用旋转蒸发仪回收溶剂,而后置于105 ℃烘箱中蒸干溶剂。将称量瓶转移至干燥器中,待其冷却后称重,即可计算出微胶囊表面含油率。
1.2.6.3 包埋率的计算
奇亚籽油微胶囊包埋率的计算如公式(1)所示:
(1)
式中:EE,包埋率;TO,总含油率;SO,表面含油率。
1.2.7 奇亚籽油微胶囊水分的测定
水分的测定参考《GB 5009.3—2016 食品中水分的测定》中的直接干燥法。
1.2.8 奇亚籽油微胶囊溶解性的测定
精确称取2~3 g已知水分含量的奇亚籽油微胶囊样品于离心管中,加入20 mL蒸馏水,涡旋2 min使样品溶解,然后以4 000 r/min速度离心10 min,弃上清液,同样地添加20 mL蒸馏水于离心管中,重复上述涡旋、离心、去上清液步骤,最后将下相的沉淀转移至干燥的玻璃培养皿中,置于105 ℃烘箱中,使其干燥至恒重。
1.2.9 奇亚籽油微胶囊堆积密度的测定
精确称取质量m的奇亚籽油微胶囊样品,将其缓慢加入具塞量筒中,将量筒竖直放置,左右晃动量筒使堆积面平整,待其稳定测定体积,根据公式(2)计算奇亚籽油微胶囊的堆积密度:
(2)
式中:ρ,堆积密度,g/cm3;m,样品质量,g;V,样品体积,cm3。
1.2.10 奇亚籽油微胶囊的微观结构
取少量干燥的奇亚籽油微胶囊粉末,均匀地散涂在导电双面胶上,将多余的样品轻轻吹去,并进行喷金处理,设置加速电压为5 kV,使用扫描电子显微镜观察样品的微观结构,调节至合适的视野观察并拍照。
1.2.11 奇亚籽油微胶囊的红外光谱分析
称取少量的奇亚籽油微胶囊样品,加入经干燥处理的KBr,质量比为1∶50~1∶100,将二者混合并充分研磨,取少量混合样品用压片机制成透明薄片,设置红外光谱仪扫描范围为650~4 000 cm-1。分别测定奇亚籽油、空微胶囊(不含奇亚籽油)和奇亚籽微胶囊的红外光谱。
1.2.12 奇亚籽油微胶囊的X射线衍射分析
X射线衍射以Cu-Kα射线作为激发源,测定麦芽糊精、大豆分离蛋白和奇亚籽油微胶囊的晶体衍射数据,设置测试范围为3~60°,步长为0.05°。
1.2.13 奇亚籽油微胶囊的热重分析
采用热分析系统对奇亚籽油微胶囊进行热重分析,设置升温范围为30~600 ℃,升温速率为10 ℃/min,氮气流速为30 mL/min。
2 结果与讨论
2.1 奇亚籽油的理化指标
奇亚籽油的理化指标见表2,均满足国家对食用油的标准要要求。其中所含有的亚油酸、α-亚麻酸,作为人体必需脂肪酸,对人体健康至关重要,是预防和治疗癌症、心血管疾病和代谢疾病的基础[13, 16]。

表2 奇亚籽油的理化指标Table 2 Physicochemical properties of chia seed oil
注:表中数值为平均值±标准偏差(n=3)
2.2 单因素实验
2.2.1 芯壁比对包埋率的影响
由图1-a可知,随着芯壁比的减小,奇亚籽油微胶囊的包埋率先增加,而后减小,当m(芯材)∶m(壁材)=1∶4时,包埋率最高。当芯壁比较大时,即奇亚籽油的含量较高时,壁材不足以包埋芯材,造成较多的芯材露在表面,同时内部的芯材容易泄露,包埋率较低;当芯壁比逐渐减小,即奇亚籽油的含量逐渐降低,此时壁材成膜性好,膜厚,包埋完全,包埋率高;当芯壁比继续减小,壁材含量过高,导致乳液体系黏度增加,乳化不完全,包埋率降低。
2.2.2 壁材复配比对包埋率的影响
由图1-b可知,随着壁材复配比的减小,奇亚籽油微胶囊的包埋率先增加,而后减小,当m(SPI)∶m(MD)=1∶2时,包埋率最高。随着壁材复配比的增加,SPI含量也在增加,由于其具有一定的乳化性能,使得奇亚籽油与SPI形成的乳液稳定性提高,因而包埋率增加;壁材复配比进一步增加,导致SPI含量过高,MD的含量过低,使得SPI和MD的接枝度降低,不利于喷雾干燥过程中成型,导致壁材稳定性下降,包埋率降低。这与黄雨洋等[17]对核桃油微胶囊化得研究结果一致。
2.2.3 乳化剂添加量对包埋率的影响
由图1-c可知,随着乳化剂添加量的增加,奇亚籽油微胶囊的包埋率先增加后减小,添加量为1.0%时,包埋率最高。当乳化剂添加量的逐渐增加时,乳液体系的总体乳化能力增加,微胶囊的包埋率显著增加,当达到1.0%时,继续增加乳化剂添加量不会进一步提高微胶囊的包埋效果,同时还会增加乳液的黏度,造成搅拌不均匀,乳化不完全,包埋率降低。
2.2.4 固形物含量对包埋率的影响
由图1-d可知,随着固形物含量的增加,奇亚籽油微胶囊的包埋率先增加后略微降低,固形物含量为25%(质量分数)时,包埋率最高。这可能是因为固形物含量较低时,体系中含水量过高,喷雾干燥时间过长,影响囊壁的形成。增加体系的固形物含量,促使微胶囊形成致密的囊壁,包埋率增加;当固形物含量继续增加,造成体系黏度过大,乳化不彻底,均质不完全,包埋率降低,还容易造成喷嘴堵塞。这与刘斯博等[18]的研究结果相符合。

a-芯壁比;b-壁材复配比;c-乳化剂添加量;d-固形物含量图1 实验条件对包埋率的影响Fig.1 The influence core-wall ratio, different wall material ratio, emulsifier content, solid content on the encapsulation efficiency注:不同小写字母表示差异显著
2.3 正交设计
由表3可知,4个因素对奇亚籽油微胶囊包埋率影响程度为:芯壁比>乳化剂添加量>复配壁材比>固形物含量。由表4可知,芯壁比、壁材复配比、乳化剂添加量对奇亚籽油微胶囊包埋率的影响具有显著差异(P<0.01),而固形物含量对包埋率的影响不显著(P>0.05)。由正交实验结果可知,制备奇亚籽油微胶囊的最佳工艺组合为A1C2B2D2,即:芯壁比m(芯材)∶m(壁材)=1∶3,乳化剂添加量为1.0%(质量分数),复配壁材比m(SPI)∶m(MD)=1∶2,固形物含量为30%(质量分数)。
在最佳工艺组合条件下,重复实验3次进行验证,最终测得奇亚籽油微胶囊的包埋率为(93.79±0.16)%,表明正交实验可行。
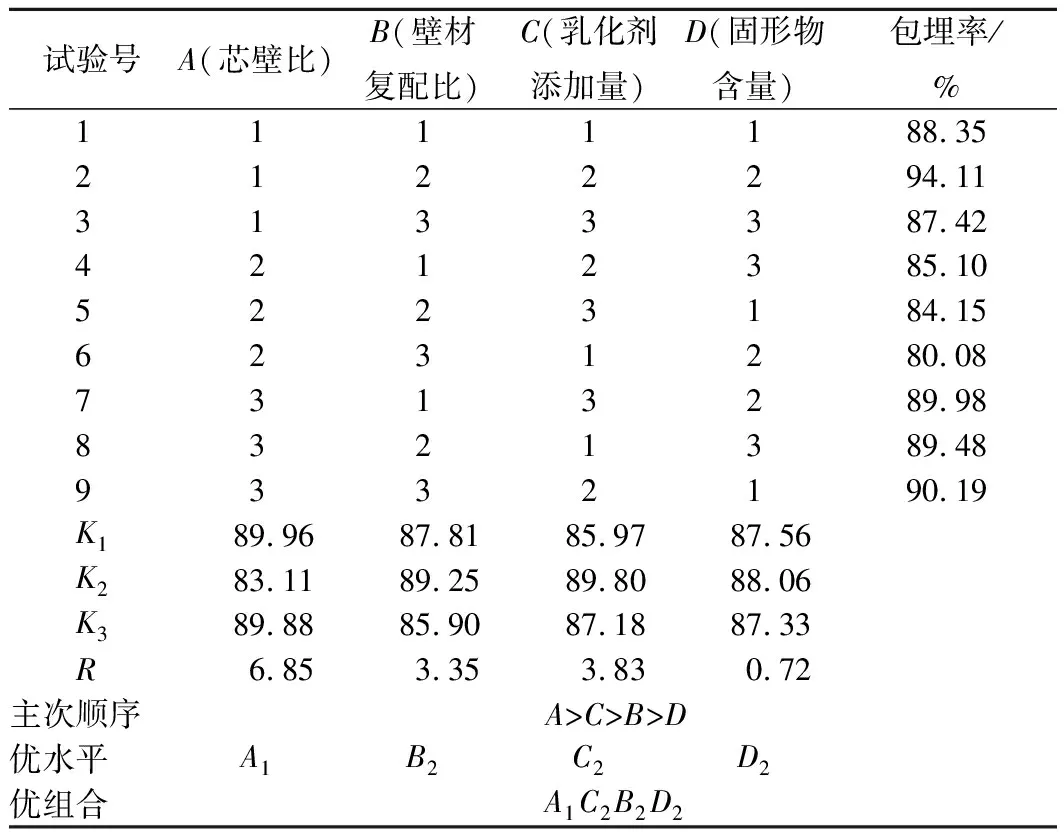
表3 微胶囊制备工艺正交实验结果Table 3 The orthogonal experimental results ofmicroencapsulation process
注:包埋率的结果为3次重复试验的平均值

表4 正交结果方差分析Table 4 The results of analysis of variance
注:*,在P<0.05水平上显著,**,在P<0.01水平上显著
2.4 奇亚籽油微胶囊的理化性质
奇亚籽油微胶囊为白色粉末状,颗粒规则,分布均匀,总含油率为21.44%,表面含油率为1.33%,包埋率为93.79%,初步认定奇亚籽油微胶囊包埋效果良好,其水分含量为1.65%,产品干燥,利于储藏;堆积密度为0.36 g/cm3,溶解度为87.31%,溶解性好,利于冲调。
2.5 微观结构分析
图2是奇亚籽油微胶囊的电子显微图。可以看出,微胶囊的散布较为均匀,只有少量颗粒粘连在一起,其粒径大部分小于10 μm,外观呈球形,结构致密,但表面有些许凹陷和裂痕,这可能与喷雾干燥时水分的蒸发有关。

图2 奇亚籽油微胶囊的扫描电子显微图Fig.2 Scanning electron microscopy of chia seed oilmicrocapsule
2.6 红外光谱分析

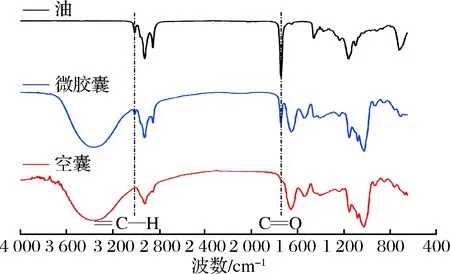
图3 奇亚籽油、微胶囊及空囊(不含油)的红外谱图Fig.3 Infrared spectra(FT-IR) chia seed oil microcapsule,blank (non-oil) and chia seed oil
2.7 X射线衍射分析
由图4可知,MD和SPI的主要特征峰位于18.3°和19.6°,而奇亚籽油微胶囊在18.9°具有主要衍射峰,与MD和SPI不同,同时衍射强度增加,说明微胶囊中存在新的结晶相,证明奇亚籽油微胶囊的合成。

图4 麦芽糊精、大豆分离蛋白和奇亚籽油微胶囊的X-射线衍射图Fig.4 X-ray diffractograms of maltodextrin, soy proteinisolate and chia seed oil microcapsule
2.8 热重分析
热重分析是在程序升温过程中,通过热分析系统中精密天平所记录样品的质量变化,分析其分解过程,从而实现对样品热稳定性的评价[20]。由图5可知,在升温过程中,奇亚籽油微胶囊的质量损失主要分为3个阶段:温度低于200 ℃时,主要是水分和挥发性物质的损失,由于二者含量低,质量损失较少;当温度高于200 ℃时,微胶囊开始裂解,MD发生糊化,SPI开始变性,化学键断裂,导致质量迅速降低;当温度高于450 ℃时,微胶囊分解完全,整个样品被碳化,质量变化曲线趋于平稳。由此可知,奇亚籽油微胶囊在200 ℃以下具有一定的热稳定性,可以应对一般的食品加工过程。

图5 奇亚籽油微胶囊的热重分析图Fig.5 Thermogravimetric analyses for the chia oilmicrocapsule
3 结论
本实验以SPI和MD作为复配壁材、单硬脂酸甘油酯和蔗糖脂肪酸酯为复配乳化剂,对奇亚籽油进行微胶囊化。对工艺条件进行了优化:m(芯材)∶m(壁材)=1∶3,m(SPI)∶m(MD)=1∶2,乳化剂添加量(质量分数)1.0%,固形物含量30%(质量分数),此条件下制备的奇亚籽油微胶囊包埋率为93.79%,包埋效果良好。
而后对奇亚籽油微胶囊的基本理化性质进行测定,所制备的微胶囊水分含量低,产品较干燥;微胶囊形态较为规则,呈球形,颗粒大小及分布较为均匀,胶囊表明有一些褶皱;奇亚籽油微胶囊的红外光谱图具有芯材和壁材的特征峰,同时奇亚籽油的特征峰在微胶囊中有所减弱,表明壁材对奇亚籽油的包埋较好;X-射线衍射图表明了奇亚籽油微胶囊的形成,热重分析显示其具有一定的热稳定性。奇亚籽油的微胶囊化,将液态的奇亚籽油转化为固态的粉末油脂,改变了流动性与溶解性,拓宽了其在食品加工领域的应用。

