通电加热过程中凡纳滨对虾虾肉糜核苷酸及关联产物的变化
谷文静,金英善,郑睿林,程裕东,金银哲*
1(上海海洋大学 食品学院食品热加工工程中心,上海,201306) 2(扬州大学 生物科学与技术学院,江苏 扬州,277600) 3(北伦敦济州国际学校,韩国 济州,697600)
通电加热(ohmic heating,OH),也称为电阻加热或焦耳加热,是一种电流流经食品物料从而直接进行加热的加工方式[1]。与传统加热相比,它的主要优点是加热快速、均匀,即开即停,能量转换率高,能最小程度地改变食品的结构、营养或感官,从而提高产品品质[2]。这项技术已广泛应用于高黏度和固液混合物的糊状产品的灭菌,鱼糜的烹饪和冷冻食品的解冻等方面[3-4]。
电导率(σ)是衡量通电加热效应的重要因素,是热量产生的先决条件[5]。温度、频率、场强、电解质/离子添加剂、食品成分和食品相态都会通过改变食品电导率从而影响加热效果[6]。张烈等[7]测定了频率、温度对草鱼鱼块和鱼皮电导率的影响,发现样品的电导率都呈现了温度和频率的依存性。SARANG等[8]认为,基于糖或盐的总离子电导率的测定可能是未来研究通电加热效果的方向,因此研究金属离子对食品电导率的影响十分有意义。
电导率会影响通电加热速率,而加热速率不同也导致加热过程中的一些化学变化的改变,如核苷酸、蛋白质、脂质的降解过程等。核苷酸及关联产物(nucleotides and related compounds,NRCs)是虾类等水产动物肌肉中重要组成成分,主要包含三磷酸腺苷(adenosine triphosphate,ATP)、一磷酸鸟苷(guanosine monophosphate,GMP)、二磷酸腺苷(adenosine diphosphate,ADP)、一磷酸腺苷(adenosine monophosphate,AMP)、肌苷酸(inosine monophosphate,IMP)、次黄嘌呤核苷(inosine,HxR)、次黄嘌呤(hypoxanthine,Hx)、腺苷(adenosine,AdR)、腺嘌呤(adenine,Ad)和黄嘌呤(xanthine,Xt)等[9]。水产动物死后,肌糖原分解并且在短时间内产生大量ATP,ATP逐渐降解为ADP和AMP。AMP在AMP脱氨酶作用下脱氨生成IMP[10],IMP通过酸性磷酸酶(acid phosphatase,ACP)缓慢转化为HxR和Hx[11]。死后肌肉中核苷酸及关联化合物的变化与新鲜度和滋味有关。
核苷酸及关联产物含量受到各种直接和间接因素影响,如年龄、性别、迁徙行为、物种、处理和季节变化。此外,温度、离子的存在以及AMP脱氨酶和ACP活性的变化也会影响核苷酸及关联产物含量[12-16]。
综上所述,加热方式和温度,以及金属离子含量或添加物会影响水产品中核苷酸及其关联产物。作为新兴的加热方式,通电加热在水产品中的应用会越来越广泛。金属离子的种类和含量会在很大程度上影响物料的电导率,导致通电加热速率和效果的不同。因此,有必要探究水产品在通电加热过程中核苷酸及关联产物含量的变化,特别是金属离子含量或添加物对其核苷酸及关联产物含量尤其是对滋味的影响。
本研究探究了通电加热过程中金属离子添加剂对凡纳滨对虾电导率的影响,并采用HPLC法检测通电加热期间虾肉中核苷酸及关联产物的含量。同时,研究了添加不同金属离子的凡纳滨对虾在通电加热过程中核苷酸及关联产物的变化。
1 材料与方法
1.1 实验材料
鲜活的凡纳滨对虾于2019年6月购自菜市场,放置充氧袋中并迅速运送到实验室,立即进行预处理。ATP、GMP、 ADP、AMP、IMP、HxR、Hx、AdR、Ad标准品,Sigma公司;去离子水和超纯水来自上海海洋大学;甲醇、K2HPO4、KH2PO4均为HPLC级,高氯酸、KOH、H3PO4、ZnCl2、CuCl2、AlCl3、FeCl3均为优级纯,国药集团化学试剂有限公司。
1.2 仪器与设备
BS224S电子分析天平,赛多利斯科学仪器(北京)有限公司;IMS-20制冰机,常熟市雪科电器有限公司;FSH-2可调高速匀浆机,常州国华电器有限公司;WRNK-135K型热电偶,大华仪器仪表有限公司;TDGC2接触调压器,浙江德力西电器有限公司;LCR测量仪(IM3533),日置电机株式会社;DZF-2ASB真空干燥箱,中仪泓瑞科技发展(北京)有限公司;MP522型精密pH计,上海三信仪表厂;T-50溶剂过滤器,天津市津腾实验设备有限公司;E2695高效液相色谱仪,美国沃特斯股份有限公司;ODS-3高效液相色谱柱,上海安谱实验科技股份有限公司。
1.3 实验方法
1.3.1 样品的制备
挑选体长、体积相近,质量约为10 g的鲜虾去头去尾脱壳除虾线,清洗并沥干表面水分。取150 g凡纳滨对虾置于预冷匀浆仪中,以30 s的间隔在10 000 r/min下搅拌5 min,以虾与溶液料液比为10∶1(g∶mL)加入预冷金属离子溶液(1、5、10 mmol/L),对照组加入等量去离子水,形成均匀的复合虾肉糜。混合后,将样品转移到500 mL容器中并用保鲜膜密封以防止水分的蒸发。共13组样品,在(4.0±0.1) ℃下保持30 min。
1.3.2 金属离子溶液的制备
称取1.36 g ZnCl2粉末,去离子水溶解并定容到1 L容量瓶中,得到10 mmol/L ZnCl2溶液,并稀释得到1、5 mmol/L ZnCl2溶液。用同样的方法分别配制1、5、10 mmol/L的CuCl2、AlCl3、FeCl3溶液,共得到12组离子溶液。
1.3.3 通电加热及电导率的测定
静态通电加热装置由加热腔体、钛电极、K型热电偶等组成。自制的加热腔(20 mm×20 mm×20 mm,厚5 mm)由聚乙烯材料与绝缘胶带制成。钛电极(20 mm×60 mm,厚0.1 mm)作为导电极板,在氯化物环境中具有高度耐腐蚀性。腔体外部包裹泡沫塑料隔热以减少样品的热量损失。K型热电偶探针(φ=0.5 mm)裹上聚四氟乙烯膜(防止电场干扰热电偶的信号传输)从顶部插入至样品几何中心。
将4 ℃复合虾肉糜样品约8 g快速填充至总体积为8 cm3的加热腔中。通电加热的关键是电极与腔体中样品表面之间达到完全接触,接触不良可能导致加热不均。接触调压器通过电极板将20 V恒定电压施加到电极上,加热样品直到样品中心温度达到指定温度(25、40、55、65、75、85和95 ℃)。此时停止加热并记录加热时间。电极两侧连接LCR测量仪,并在50 Hz~20 kHz下测量样品的瞬时阻抗(Z)。由于在此频段下样品阻抗(Z)在数值上几乎与电阻(R)相同。因此阻抗(Z)用于计算样品的电导率,如公式(1)所示。
(1)
式中:R,样品电阻,Ω;L,两电极之间的间隙,m;S,电极表面积,m2。
通电加热后,取出样品在冰水浴中冷却至4 ℃,然后立即进行下一步实验操作。
1.3.4 核苷酸及关联产物的提取
核苷酸及关联产物的提取参考ZHANG等[13]的方法,并作适当修改。称取冷却后的样品5.0 g于离心管中,加入20 mL预冷的100 g/L高氯酸溶液充分匀浆,将悬浮液在5 000 r/min下冷冻离心10 min,收集上清液,沉淀物中再次加入10 mL预冷的50 g/L高氯酸溶液浸提、离心(条件同上),合并2次离心的上清液,调pH至5.8。将上清液转移至50 mL容量瓶中并用超纯水定容。使用孔径为0.22 μm微孔滤膜过滤。将样品保持于-20 ℃冰箱备用。
1.3.5 核苷酸及关联产物的测定
核苷酸及关联产物的检测参考QIU等[17]的方法,并作适当修改。在装有Waters 2996光电二极管阵列检测器和empower 2软件包(Waters Co.,Massachusetts,MA,USA)的Waters Alliance 2695 HPLC系统上进行NRC分析。色谱条件如下:色谱柱Shimadzu ODS-3 C18(4.6 mm×250 mm,5 μm)柱;流动相A为甲醇,B为V(20 mmol/L KH2PO4)∶V(20 mmol/L K2HPO4)=1∶1,用磷酸调节pH至5.8(所有溶剂通过0.45 μm膜滤器过滤并脱气);柱温30 ℃;进样量10 μL;检测波长254 nm;流速1.0 mL/min;梯度洗脱:0~8 min 100% B,8~10 min 3% A,10~15 min 6% A,15~23 min A线性增加至30%,23~26 min 30% A,26~30 min 100% B。
1.3.6 滋味活性值的计算
滋味活性值(taste active value,TAV)为食品基质中某一呈味物质的浓度与其相应的味道识别阈值之比。尽管TAV方法没有考虑到同时存在的化合物在食品基质中的掩蔽、增强或协同作用的可能性,但TAV被广泛用于评估那些单独的味道活性化合物的味道影响。
(2)
式中:C,某一呈味物质的浓度,mg/100 g;T,呈味物质的味道识别阈值,mg/100 g。
1.3.7 统计分析
使用SPSS软件(版本13.0,SPSS Inc.,Chicago,IL,USA)对实验结果进行方差分析和平均值比较。显著性差异为P<0.05。所有数据使用Origin 9.1(Origin Lab,Massachusetts,MA,USA)作图。所有实验平行测定3次。
2 结果与讨论
2.1 凡纳滨对虾虾肉糜电导率的变化
2.1.1 电导率的频率依存性
在不同温度下,虾肉糜在50 Hz~20 kHz的电导率为0.15~1.36 S/m(图1)。这符合ZELL等[18]提出的通电加热物料的电导率值在0.01~10 S/m范围内,最佳效率在0.1~5 S/m范围内的结论。
如图1所示,频率和电导率具有对数函数关系。在50 Hz~20 kHz内,样品电导率随频率先显著增加(P<0.05),后趋于稳定。在较低温度(25~40 ℃),频率低于1 000 Hz时,电导率急剧增加,之后变化不大;在高温(55~95 ℃), 电导率随频率不断增长,但在5 000 Hz后无显著变化(P>0.05)。当频率接近测定终点频率(20 kHz)时,样品电导率略有下降。这与SHYNKARYK等[19]和GUO等[1]的结论一致。
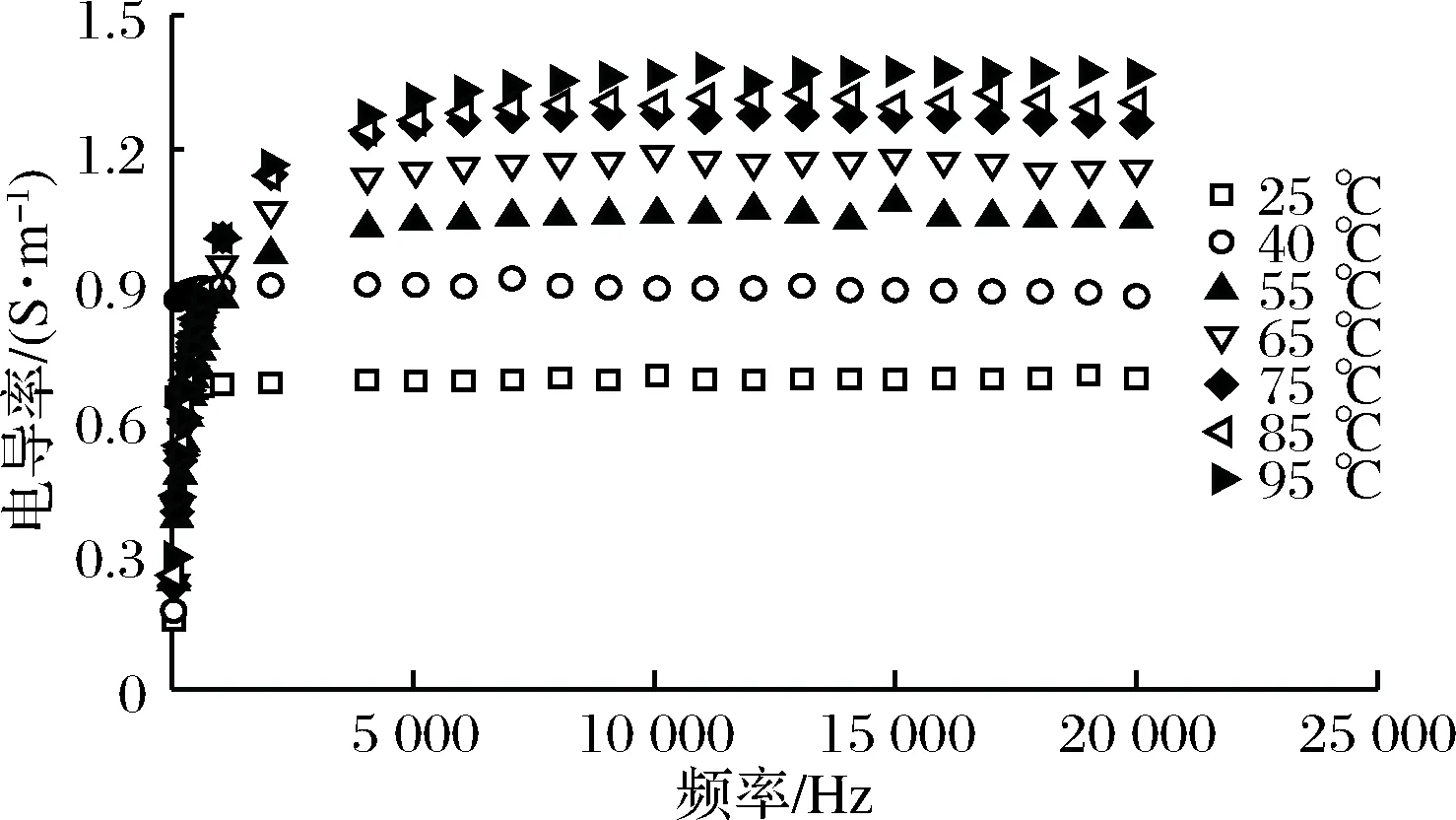
图1 通电加热过程中虾肉糜的电导率Fig.1 Electrical conductivity of minced shrimpduring ohmic heating
电导率的频率依存性可能与细胞膜的渗透性和频率的分散机制有关。在低频下,样品组织中存在α-分布机理,当施加电压时,细胞膜渗透性的变化为离子运动打开许多通道[20],此时内源酶与大分子物质的相互作用也将增加离子的数量,导致细胞结构导电性增强。在高频率下,由于细胞结构已经完全透化,电导率趋于稳定。并且完整细胞和破裂细胞的电导率差异几乎可以忽略不计[1]。当接近20 kHz时,细胞可能存在的β-分散机制,导致细胞膜逐渐失去通透性[21],另外细胞膜可能的可逆透化也会造成电导率的轻微减小。
作为绝缘细胞膜在电场中充电极化的结果,电导率的频率依存性存在于所有生物细胞中。因此,研究特定频率范围(例如本实验使用的频率段是在α色散范围内和仅高于α色散频段的β色散范围内)对电导率的影响,这对于预测具有细胞结构的食品材料在加工、贮藏和运输时发生的细胞损伤和破裂行为是十分有价值的。
2.1.2 电导率的温度依存性
样品的电导率随温度升高而升高(图2),这是由于高温处理对离子运动的阻碍作用不如低温时显著,即温度升高导致离子迁移率增加[22]。电导率也与离子电荷密度有关,在通电加热过程中,随着加热温度的升高,虾肉糜的内源性酶促进了带电荷量少的大分子聚合物(如蛋白质和脂肪)分解成带电荷量多的小分子物质,这可能会增加样品的电导率[23-24]。此外,蛋白质通道和细胞膜中脂质结构域的热损伤,肌原纤维蛋白的热变性和蒸煮损失也影响样品在高温下的电导率[24]。

图2 虾肉糜在不同温度下的电导率Fig.2 Electrical conductivity of minced shrimp atdifferent temperature注:图中同一折线图上不同字母代表着差异性显著,P<0.05
图2显示了50 Hz和20 kHz(20 kHz为通电加热的工业用频率)下的电导率的温度依存性,样品的电导率与温度呈线性关系而高于65 ℃时电导率非线性增加。这可能是由于在60~70 ℃时肌动蛋白、肌束膜和肌外膜胶原蛋白变性,导致离子运动发生变化[25]。此外,由于部分蛋白质热变性,样品也有一些收缩,这导致样品与电极接触不良[26]。如DARVISHI等[22]所示,样品电导率下降的另一个主要结构变化是由于样品中蒸汽的产生和氧化还原反应副产物中气体(例如H2或O2)的增加导致样品体积膨胀,而这些气体通常是电绝缘体。SARANG等[8]指出,样品中更多的孔隙和大量的气体是样品电导率降低的原因。这种同时膨胀和收缩将导致通电加热中整体体积变化,进而影响电导率。
在95 ℃,20 kHz下样品的电导率约为50 Hz时的5倍左右(分别为0.28 S/m和1.36 S/m)。20 kHz条件下,由σ-T曲线的斜率可以看出,随着温度升高,这两者的差异更为明显。20 kHz时样品温度升高到95 ℃所用时间约50 Hz条件下的1/6,这意味着在指定温度,高频条件下电导率的增加速率比低频条件快,也就是说,与低频相比,电导率的温度依赖性在高频时表现得更为明显。
2.1.3 金属离子浓度对虾肉糜电导率的影响
通电加热过程中经不同浓度的Zn2+、Cu2+、Al3+和Fe3+处理的虾肉糜的电导率的变化见图3、图4。发现含金属离子添加物的虾肉糜的电导率高于没有添加金属离子的电导率,这是因为可电离的盐在通电加热中充当电流载流子,导电性增强。
经不同种类的金属离子(浓度分别为1、5和10 mmol/L)处理的虾肉糜在通电加热下的电导率见图3。在相同温度下,经同一种金属离子处理的虾肉糜的电导率与离子浓度的关系Zn2+:σ(1 mmol/L)>σ(5 mmol/L)>σ(10 mmol/L);Cu2+: σ(5 mmol/L)>σ(10 mmol/L)>σ(1 mmol/L);Al3+:σ(10 mmol/L)>σ(1 mmol/L)>σ(5 mmol/L);Fe3+:σ(10 mmol/L)>σ(5 mmol/L)>σ(1 mmol/L)。
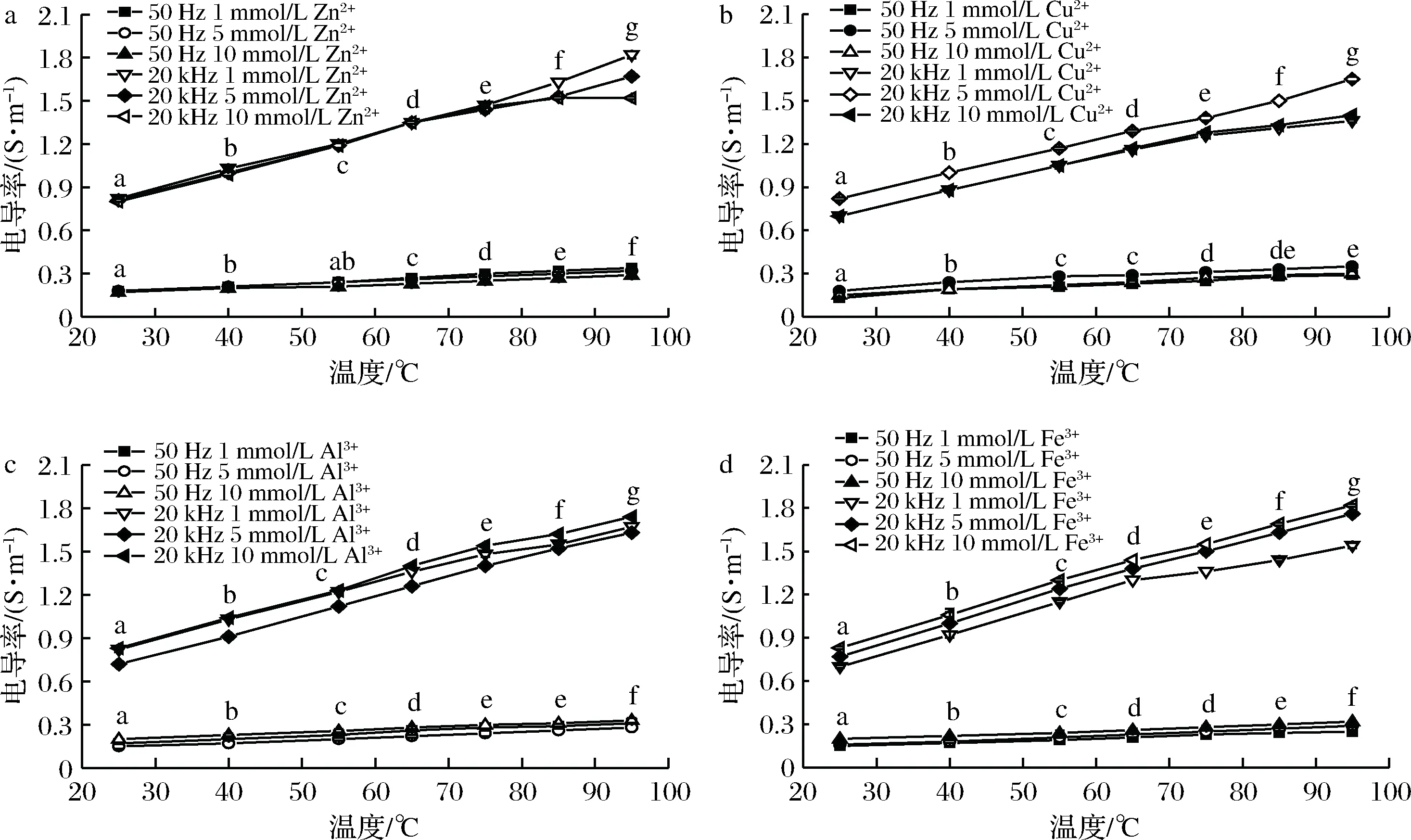
a-Zn2+处理组;b-Cu2+处理组;c-Al3+处理组;d-Fe3+处理组图3 不同浓度的金属离子处理的虾肉糜在通电加热下的电导率Fig.3 Electrical conductivity of minced shrimp treated with different concentrations of metal ions during OH注:图中不同字母表示差异显著(P<0.05)
从图3可以看出,电导率与金属离子浓度之间没有强烈的相关性。这是由于电导率取决于游离或未结合的金属离子量而不是与虾肌肉蛋白结合的金属量或给定金属的离子量[27]。Zn2+易与蛋白质表面氨基酸残基中的咪唑基、硫醇和吲哚基等官能团结合[28],低浓度的Zn2+只能与部分氨基酸残基相结合,而高浓度的Zn2+能够与更多氨基酸残基结合使暴露的氨基酸残基的离子量减小[28],电导率相应也减小。Cu2+与蛋白质结合的官能团与Zn2+相同,但是Cu2+具有比Zn2+更强的结合能力[29],低浓度的Cu2+可与蛋白质结合形成更紧密的结构,1 mmol/L Cu2+处理组的电导率大于5、10 mmol/L处理组。Al3+、Fe3+与蛋白质结合的特征官能团是羧基和磷酸酯,且二者与蛋白质的结合能力弱于Zn2+、Cu2+[28]。浓度越大,未能与蛋白质结合的Fe3+量越多,所以对于Fe3+处理组来说,浓度越高,电导率越大。此外,金属与蛋白质螯合物的稳定性受到金属离子的半径和电荷密度的影响[28],这可能是造成Al3+处理组与Fe3+处理组的结果有差异的原因。
2.1.4 金属离子种类对虾肉糜电导率的影响
经不同浓度的金属离子处理的虾肉糜在通电加热下的电导率见图4。在相同温度下,经同一离子浓度处理虾肉糜的电导率与离子种类的关系:1 mmol/L:σ(Zn2+)>σ(Al3+)>σ(Fe3+)>σ(Cu2+);5 mmol/L:σ(Fe3+)>σ(Zn2+)>σ(Cu2+)>σ(Al3+);10 mmol/L:σ(Fe3+)>σ(Al3+)>σ(Zn2+)>σ(Cu2+)。
离子种类和浓度会对样品的电导率产生影响。Zn2+和Cu2+比Al3+和Fe3+对蛋白质有更强的亲和力,而Cu2+与蛋白质的结合能力稍强于Zn2+ [28]。在高浓度下Zn2+和Cu2+优先中和蛋白质表面上的电荷,导致样品的自由离子更少。AROCKIADOSS等[27]也认为,铜比铁更有效地结合蛋白质。金属离子与蛋白质、脂质等生物大分子的结合机理复杂,且食品生物大分子中的游离电荷量不能确定,目前金属离子对食品电导率的影响机理没有准确的理论,有待进一步研究。
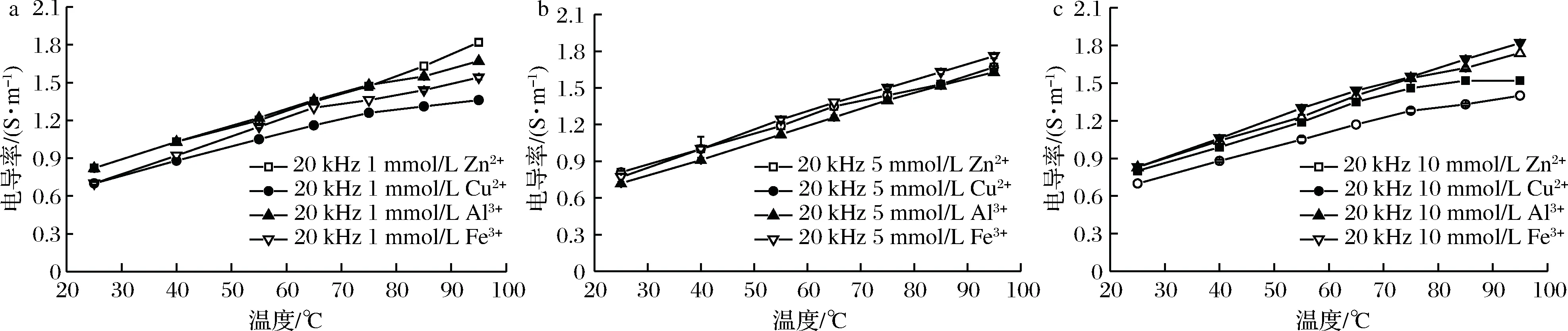
图4 不同种类的金属离子处理的虾肉糜在通电加热过程中的电导率(P<0.05)Fig.4 Electrical conductivity of minced shrimp treated with different metal ions during OH(P<0.05)
此外,当达到指定加热温度时,较高的电导率导致较快的加热速率和较短的加热时间。95 ℃时,经10 mmol/L Fe3+处理的样品中,电导率(1.86 S/m)增加了37%并且加热时间(239 s)缩短了19%。因此,具有最大电导率,最短加热时间以及最弱金属结合水平的10 mmol/L Fe3+是虾肉糜样品中的最佳导体。
2.2 通电加热对虾肉糜中核苷酸及关联产物变化的影响
2.2.1 通电加热温度对虾肉糜核苷酸及关联产物含量的影响
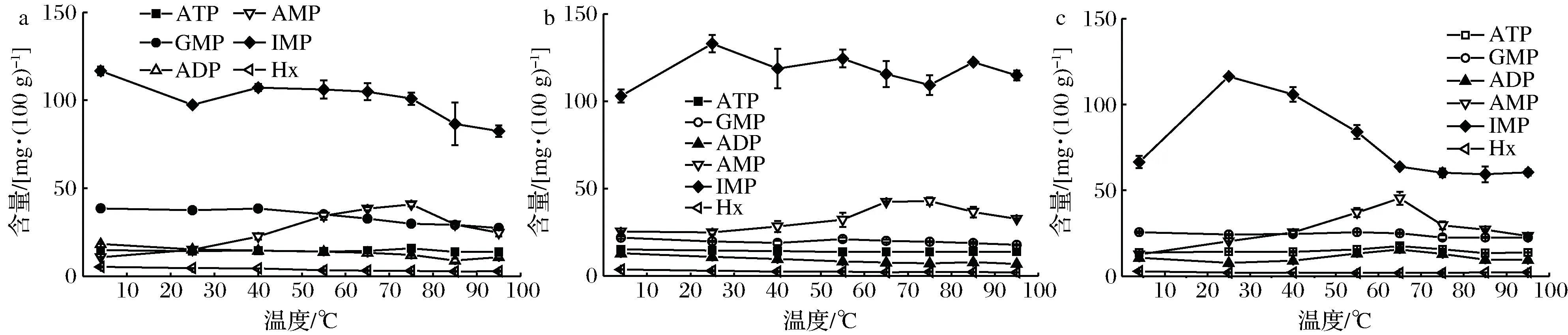
通电加热过程中虾肉糜的9种核苷酸及关联产物含量的变化情况如图5所示。ATP含量在7.7~8.2 mg/100 g范围内波动,ADP含量随着温度的升高而增大,到达高温(85~95 ℃)后略有下降。凡纳滨对虾存活时,虾肉中的核苷酸主要是ATP和ADP。在死后初期,Ca2+-ATP酶受膜上大量Ca2+激活并分解ATP。在虾死后1 d内,大部分ATP和ADP主要降解为AMP和IMP,所以仅剩下少量ATP和ADP。
AMP、IMP都在65 ℃达到最大值,温度升高促进了AMP、IMP的积累,温度进一步升高时,二者均略有下降。这是由于温度升高,Ca2+-ATP酶的活性增强,而温度过高导致该酶失活,这与ZHANG等[13]的研究结果一致。HxR分别在40 ℃和65 ℃时达到最小和最大值,而AdR在75 ℃时达到最大值,GMP在55 ℃时达到最大值。故通电加热温度最好控制在40~65 ℃之间,不宜超过75 ℃。

a-7种核苷酸;b-GMP和AdR图5 通电加热过程中9种核苷酸及关联产物的变化Fig.5 Changes of 9 NRCs during OH注:不同字母代表着差异性显著(P<0.05)
核苷酸及关联产物对虾类滋味的产生具有重要贡献,在本研究中,GMP、AMP和IMP是对凡纳滨对虾滋味贡献最大的核苷酸,且它们的TAV都大于1。GMP和IMP是水产品呈现鲜味的核心物质,二者浓度越大,呈味效果越好。而AMP的呈味效果取决于AMP在样品中的浓度,低浓度(50~100 mg/100 g)下即TAV在1~2之间,AMP呈现甜味,但没有鲜味;中等浓度(100~200 mg/100 g)下即TAV在2~4之间,AMP呈现甜味和轻微的咸味。
4种呈味核苷酸的TAV随通电加热温度的变化如图6所示。GMP、IMP的TAV均大于1,其中GMP的TAV最大,并在55 ℃时达到最大值;AMP、IMP的TAV均在65 ℃达到最大值;Hx的TAV随着温度的升高略有降低且始终远远小于1,故通电加热过程中凡纳滨对虾能够产生一定的鲜味但不会产生明显的苦味。IMP和AMP的TAV都在65 ℃达到最大值,故通电加热温度控制在55~65 ℃之间更有利于虾肉糜良好滋味的产生。

图6 四种呈味核苷酸的TAVFig.6 TAVs of four kinds of taste nucleotides注:同一折线图上不同字母代表差异性显著(P<0.05)
2.2.2 通电加热过程中金属离子对虾肉糜中核苷酸及关联产物的影响
不同金属离子添加剂对虾肉糜中核苷酸的降解途径的影响如表1所示,对照组(纯虾肉糜)与Zn2+处理组均有2种降解途径,分别是IMP途径:ATP→ADP→AMP→IMP→HxR→Hx和AdR途径:ATP→ADP→AMP→AdR→HxR→Hx→Ad,而10 mmol/L Zn2+处理组虾肉糜中未检测到AdR却有Ad的积累,这可能是由于高浓度的Zn2+更多地与AMP脱氨酶与酸性磷酸酶形成配合物,从而改变了IMP的降解途径与产物。Cu2+、Al3+处理组的虾肉糜都只有1种降解途径为ATP→ADP→AMP→IMP→Hx,而Fe3+处理组也只有1种降解途径为ATP→ADP→AMP→IMP→HxR→Hx,二者之间的差异可能是由于金属离子种类不同,对关键酶的构象与活性的影响不同所致。

表1 不同金属离子处理下虾肉糜中核苷酸的降解途径Table 1 Degradation pathways of nucleotides in shrimptreated with different metal ions
注:空白处表示该途径有对应物质,但实际未测出
不同金属离子对ATP降解途径的影响作用主要是通过改变酶的构象及影响酶活性实现的,目前研究最多的是AMP脱氨酶和ACP,这2种酶与IMP的生成和降解有关。LI等[15]发现Na+、K+、5 ~ 9 mmol/L Fe2+和Zn2+通过增强AMP脱氨酶活性进而产生大量IMP,Fe2+和Zn2+抑制ACP活性进而减少了IMP的分解和Hx的形成。金属离子对ATP降解途径的影响机理还与加工方式(如通电加热等)和物种(水产品鱼、虾、贝等)有关,这有待进一步研究。
不同浓度Zn2+处理的虾肉糜中的核苷酸及关联产物的含量变化如图7所示。其中ATP、ADP的含量没有明显地变化(P<0.05),始终保持在较低的水平(<10 mg/100 g),这是由于凡纳滨对虾死后,ATP、ADP迅速降解为AMP与IMP。AMP的含量分别在65 ℃(1 mmol/L)、65 ℃(5 mmol/L)、75 ℃(10 mmol/L)达到最大值,而IMP的含量分别在40 ℃(1 mmol/L)、75 ℃(5 mmol/L)、40 ℃(10 mmol/L)达到最大值。1 mmol/L Zn2+处理组的AMP+IMP最大,说明1 mmol/L Zn2+处理的虾肉糜的鲜味与甜味呈味效果更好。而对同样呈鲜味的GMP来说,3种浓度处理的虾肉糜中均呈上下波动趋势,但在加热温度25~65 ℃时,GMP(1 mmol/L Zn2+)> GMP(10 mmol/L Zn2+)> GMP(5 mmol/L Zn2+),并且在添加1 mmol/L Zn2+加热到40 ℃时,GMP含量达到最大值。1 mmol/L Zn2+处理组虾肉糜的AdR随温度的升高缓慢增大,直到85 ℃时达到最大值,然后略有下降;5 mmol/L Zn2+处理组虾肉糜的AdR随温度的升高持续下降,直到95 ℃时,样品中无法检测到AdR。添加10 mmol/L Zn2+加热到55 ℃时,HxR的含量误差较大(n=4)。其原因有待进一步证实。加热温度超过55 ℃后,HxR的含量较低且变化不大。
不同浓度Cu2+处理的虾肉糜中的核苷酸及关联产物的含量变化如图8所示。3种浓度下的IMP含量均处于较高的水平,分别在加热到40 ℃(1 mmol/L Cu2+)、85 ℃(5 mmol/L Cu2+)、95 ℃(10 mmol/L Cu2+)达到最大值,分别为126.5、107.6、119.4 mg/100 g。3个浓度处理组的AMP的变化趋势与IMP大致相同,进一步加强了样品的鲜味和甜味。Hx含量始终很小。对于低浓度(1 mmol/L)处理组来说,较适宜的加热温度为中低温(40 ℃),对于高浓度(5、10 mmol/L)处理组来说,较适宜的加热条件为高温(85、95 ℃)。

a-1 mmol/L Zn2+处理组;b-5 mmol/L Zn2+处理组;c-10 mmol/L Zn2+处理组;d-GMP与AdR图7 Zn2+处理的虾肉糜中的核苷酸及关联产物的含量变化(P<0.05)Fig.7 Changes of the content of NRCs in Zn2+ treated minced shrimp (P<0.05)

a-1 mmol/L Cu2+处理组;b-5 mmol/L Cu2+处理组;c-10 mmol/L Cu2+处理组图8 Cu2+处理的虾肉糜中的核苷酸及关联产物的含量变化(P<0.05)Fig.8 Changes of the content of NRCs in Cu2+ treated minced shrimp (P<0.05)
不同浓度Al3+处理的虾肉糜中核苷酸及关联产物的含量变化如图9所示。对于1 mmol/L Al3+处理组来说,ATP、ADP、GMP、Hx的含量随通电加热温度的升高略有减小;AMP的含量先增大后减小,在75 ℃时达到最大值;IMP的含量在通电加热前的初始温度4 ℃时达到最大值后减小,在25~40 ℃短暂增大后持续减小。对于5 mmol/L Al3+处理组,AMP的含量随着加热温度的升高先增大后减小,在65 ℃达到最大值;IMP的含量随着温度增大不断上下波动,在低温(25 ℃)下,达到最大值。对于10 mmol/L Al3+处理组,ATP、ADP、AMP的含量均随温度先增大后减小,在65 ℃达到最大值;IMP的含量先增大后减小,在25 ℃达到最大值。Al3+处理的虾肉糜均在较低温度下达到较好的风味。
不同浓度Fe3+处理的虾肉糜中核苷酸及关联产物的含量变化如图10所示。1和5 mmol/L Fe3+处理组的IMP含量均在40 ℃达到最大值,而10 mmol/L Fe3+处理组的IMP含量在85 ℃达到最大值。3种不同浓度处理组的AMP的含量变化趋势基本一致,均随温度的升高先增大后减小,分别在75、65、75 ℃达到最大值。低浓度Fe3+处理组在较低温度(40 ℃)下获得最佳风味,高浓度Fe3+处理组在高温(85 ℃)下获得最佳风味。
根据IMP是水产品中主要的鲜味相关物质,Hx是苦味化合物,以二者含量的差异来确定虾肉糜的最佳加热条件。而Hx是首要考虑的滋味指标,若通电加热期间Hx浓度很低且无明显积累,则该研究才能进一步优化虾肉糜中存在的IMP量。经金属离子处理的虾肉糜在通电加热下其Hx的TAV变化如表2所示,在通电加热期间,无论虾肉糜是否经金属离子处理,Hx的TAV(<0.05)都远远低于1,这表明升高温度和添加金属离子都不会引起虾肉糜滋味恶化和引起食品安全问题。
a-1 mmol/L Al3+处理组;b-5 mmol/L Al3+处理组;c-10 mmol/L Al3+处理组图9 Al3+处理的虾肉糜中的核苷酸及关联产物的含量变化 (P<0.05)Fig.9 Changes of the content of NRCs in Al3+ treated minced shrimp (P<0.05)

a-1 mmol/L Fe3+处理组;b-5 mmol/L Fe3+处理组;c-10 mmol/L Fe3+处理组图10 Fe3+处理的虾肉糜中的核苷酸及关联产物的含量变化(P<0.05)Fig.10 Changes of the content of NRCs in Fe3+ treated minced shrimp (P<0.05)
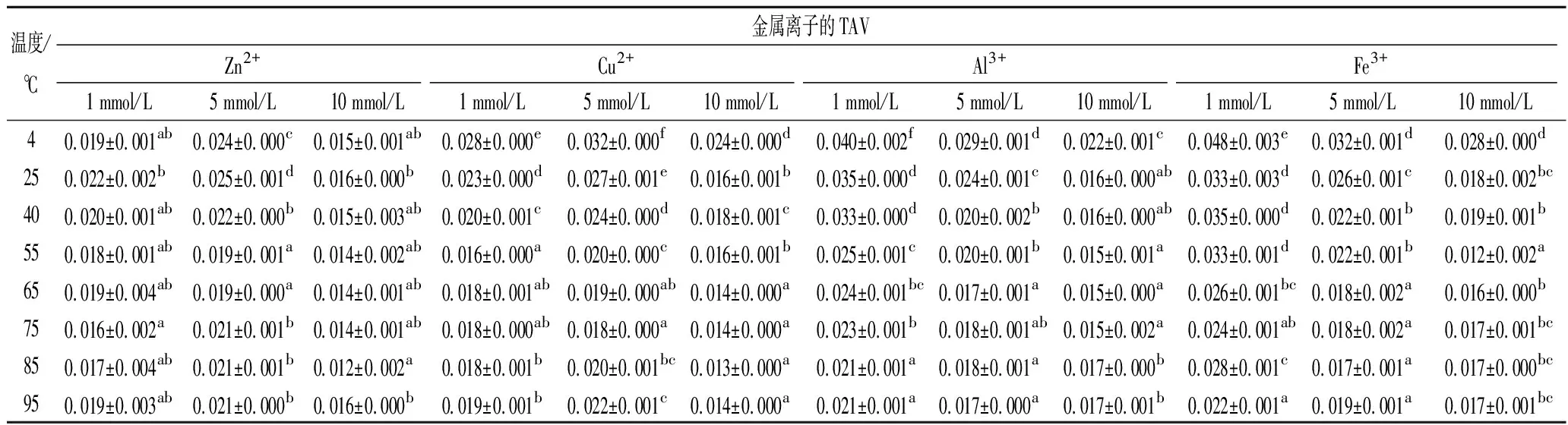
表2 经金属离子处理的虾肉糜在通电加热下Hx的TAV变化Table 2 TAVs of Hx in the minced shrimp treated with different metal ions during OH
注:同列不同小写字母代表差异显著(P<0.05)
4种金属离子处理的虾肉糜在通电加热期间其IMP的TAV变化如图11所示。除Zn2+处理组所有样品中IMP的TAV均>1,这表明金属离子处理的虾肉糜中IMP是其主要的滋味物质,对虾肉糜的滋味产生明显影响。
通电加热过程中,金属离子促进了IMP的产生。三价离子对IMP的促进作用要大于二价离子,这可能是因为三价离子所带电荷量更多,从而更增强AMP脱氨酶的活性。5 mmol/L Zn2+对IMP影响最显著,且随着温度的升高,IMP的TAV增大。1和10 mmol/L Cu2+均表现出高水平的IMP,1 mmol/L Cu2+处理组对低温更敏感,而10 mmol/L Cu2+处理组对高温更敏感。在低温(4 ℃)下,1 mmol/L Al3+处理组的IMP水平高于5、10 mmol/L Al3+处理组,而通电加热后,5 mmol/L Al3+处理组的IMP的TAV最大,10 mmol/L Al3+处理组IMP的TAV最小。除25 ℃,其他温度条件下,10 mmol/L Fe3+处理组的IMP的TAV均大于1、5 mmol/L Fe3+处理组。通常,不同的金属离子对IMP具有不同的影响,除了与AMP脱氨酶活性相关之外,还可能与金属离子半径,电荷密度,蛋白质结合能力和稳定性有关。
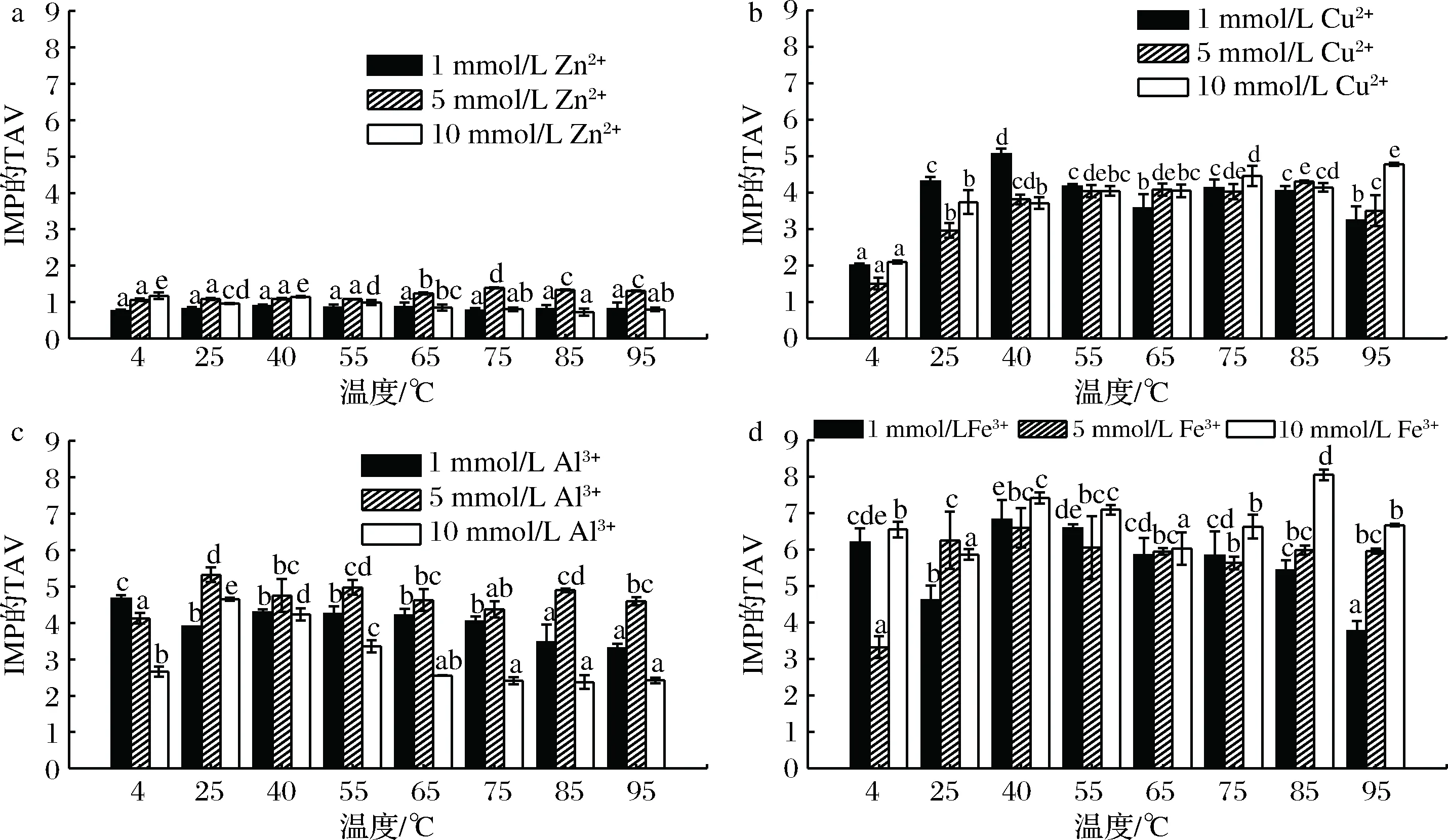
a-Zn2+处理组;b-Cu2+处理组;c-Al3+处理组;d-Fe3+处理组图11 四种金属离子处理的虾肉糜在通电加热期间其IMP的TAV变化Fig.11 TAVs of IMP in the minced shrimp treated with different metal ions during OH注:图中不同小写字母代表差异显著(P<0.05)
与温度相比,金属离子(除Zn2+外)对IMP含量的影响更为明显。这可能是因为金属离子改变了AMP脱氨酶活性位点催化基团的构象,而加热对该酶的作用速率或效果不及金属离子。金属离子对酶的反应速率有可能比热效应的反应速率更快。另外,金属离子可能会增加AMP脱氨酶活性随温度变化的稳定性。
基于IMP量先确定最佳金属离子再选择最佳加热温度。将整个加热过程划分成低温区(25、40、55、65 ℃)和高温区(75、85、95 ℃)。在某些处理组中低温范围内IMP的产生量略高于高温区,但更高的温度似乎更有利于抑制微生物生长并确保产品安全。因此,优先考虑高温处理组中IMP滋味的影响。在本研究中,10 mmol/L Fe3+处理组IMP的TAV最大,在85 ℃达到最大值8.06,对凡纳滨对虾的滋味贡献最明显。
3 结论
通电加热中频率、温度和金属离子添加物的种类及浓度均会影响凡纳滨对虾的电导率。电导率与频率呈对数关系,在低于65 ℃下与温度呈线性关系(P<0.05);添加金属离子,电导率增大,10 mmol/L Fe3+处理的样品电导率最大。通电加热有利于虾(未添加金属离子)鲜味的产生和保持;高温会积累AdR,通电加热纯虾肉糜(未添加金属离子)的温度应控制在55~65 ℃之间。水产品中ATP降解途径的研究为控制水产品的加工及贮藏过程、条件提供了理论依据,以便优化加工贮藏条件,获得滋味良好的水产品。在本研究中添加金属离子会改变凡纳滨对虾中ATP的降解途径,对照组(纯虾肉糜)与Zn2+处理组ATP降解途径有2种,分别为IMP途径:ATP→ADP→AMP→IMP→HxR→Hx与AdR途径:ATP→ADP→AMP→AdR→HxR→Hx→Ad,Cu2+、Al3+和Fe3+处理组ATP降解途径为IMP途径ATP→ADP→AMP→IMP→HxR→Hx。金属离子处理的虾肉糜不同加热温度下均产生大量IMP和少量Hx,有利于虾鲜味的形成;添加10 mmol/L Fe3+通电加热至85 ℃是一种较理想的处理方式,凡纳滨对虾产生更多鲜味。

