魔芋葡甘聚糖及其衍生物治疗乳糖不耐受症
张东霞,张琪,邓丽玲,2,钟耕*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市生物技术研究所有限责任公司,重庆,401121)
乳糖不耐受症(lactose intolerance,LI)在医学上是指与乳糖不完全消化相关的胃肠道症状,即由于小肠乳糖酶缺乏,牛奶中的乳糖不能被分解吸收,从而进入结肠,被肠道细菌分解后,产生大量短链脂肪酸和氢气,造成渗透压升高,使肠腔内的水分增多,引起腹鸣、肠鸣、腹绞痛甚至腹泻等症状[1]。其机制尚不清楚,除了乳糖酶缺乏,还包括个体乳糖消化量、胃肠道传送、直肠动力异常、性别、年龄等因素的差异[2]。目前,乳糖不耐受症的治疗主要通过添加乳糖酶,饮食调理,应用益生菌等。HE等[3]对11名中国乳糖不耐受症患者补充双歧杆菌胶囊和富含乳酸杆菌酸奶2 w后,明显提高了其结肠菌群乳糖代谢活性,显著改善了患者乳糖不耐受症状。SAVAIANO等[4]的一项随机、双盲临床试验证明,新型半乳寡糖(RP-G28)是改善乳糖消化和乳糖不耐受症状的一个潜在的方法。一些研究表明,结肠发酵可能在乳糖不耐受症中起作用[5-6],因此,改变结肠细菌以有效代谢乳糖是一种新颖且可能有用的改善乳糖消化和耐受性的方法。
魔芋葡甘聚糖(konjac glucomannan,KGM)是魔芋块茎中通过β-1, 4-糖苷键连接而成的葡萄糖和甘露聚糖聚合物。临床研究表明,KGM具有缓解便秘,降低超重和肥胖人群的体重,防止糖尿病,降低癌症风险等生理功效,食用KGM对健康有益,是一种潜在的益生元[7-8]。魔芋葡甘低聚糖(konjac oligoglucomannan,KOGM)是KGM降解形成的低聚糖,避免了KGM相对分子量大、黏度高、溶解度小等缺陷。在过去的几十年里,已经有研究表明低聚糖的益生元作用[7,9],美国等已有KOGM食品以及功能食品上市[10]。之前研究表明,KGM和KOGM可以选择性刺激双歧杆菌、乳酸杆菌等有益菌的生长并产生有利的短链脂肪酸(short chain fatty acids,SCFA)[11-13]。双歧杆菌可促进小肠绒毛上皮细胞增生,分泌乳糖酶,肠道内形成“乳糖酶-低聚半乳糖-双歧杆菌”的微生态循环平衡体系,3者具有相互协同作用,维持肠道内的微生态平衡[14]。因此适量的补充双歧杆菌可以减少乳糖不耐受症的发生。
本文通过人体体外发酵实验,探究KGM和KOGM在健康受试者和乳糖不耐受受试者粪便体外发酵特性,验证其益生性。通过小鼠动物实验,以及KGM和KOGM对乳糖体外发酵特性的影响研究,讨论KGM和KOGM治疗乳糖不耐受症的可行性,为开发一款益生元治疗乳糖不耐受症的新型产品提供理论研究基础和应用参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
雄性KM小鼠,购自重庆医科大学实验动物中心,许可证号:SCXK(湘)2016-0002。
1.1.2 主要实验材料
KGM,重庆康家客有限公司,符合NY/T 494—2010《魔芋粉》标准质量要求,葡甘聚糖含量≥90%;β-甘露聚糖酶(食品级60 000 U/g),昆明爱科特生物科技有限公司;乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸(色谱纯)标准品,北京振翔科技有限公司;思连康双歧杆菌四联活菌片,杭州远大生物制药有限公司;二糖酶试剂盒(乳糖酶),南京建成生物工程研究所;其他试剂如未特别说明均为分析纯。
1.1.3 主要仪器和设备
MAGM-Ⅱ微波快速制样系统,上海新仪公司;DZF-6020真空干燥箱,上海精宏实验设备有限公司;RE-52旋转蒸发仪,上海亚荣生化仪器厂;172F-602电热鼓风干燥箱,上海精密实验仪器有限公司;PHS-3C精度酸度计,上海大普仪器有限公司;5810台式高速冷冻离心机,德国Eppendorf公司;GC-2010 Plus气相色谱仪,日本岛津公司;FFAP气相色谱柱(30 m×0.53 mm×0.50 μm),安捷伦科技有限公司;HXF-DY高速分散器,宁波新芝生物科技股份有限公司;SYNERGYH1MG酶标仪,美国基因公司。
1.2 实验方法
1.2.1 魔芋葡甘低聚糖的制备
根据秦清娟等[15]的方法并稍作改动。采用微波辅助半干法酶解制备KOGM,称取20 g魔芋粉,加入34.0 mL pH 6.0柠檬酸-柠檬酸钠缓冲液,固液比为1∶1.7(g∶mL),以1 600 U/g加入β-甘露聚糖酶,高速搅拌均匀,将样品用可透气玻璃纸密封,于55 ℃条件下反应3.2 h。反应完全之后微波加热,使反应体系中酶的活性丧失(700 W加热1 min,物料中心温度达到95 ℃),产物置于45 ℃的真空干燥箱中干燥。将干燥样品溶于10倍(g∶mL)的蒸馏水中,充分搅拌后,6 000 r/min 离心20 min,收集上清液,经旋转蒸发将上清液浓缩至原体积的1/8~1/12,得到浓缩液,逐步加入9倍体积的无水乙醇,乙醇体积分数达到90%,醇沉1 h,8 000 r/min离心20 min,得醇沉物。低温(40 ℃)烘干,粉碎过筛(160目),得KOGM样品。得率达到48.4%,样品密封并于4 ℃低温保存,以备后续使用。
1.2.2 KGM和KOGM在不同人群粪便中的体外发酵特征
1.2.2.1 体外发酵实验溶液的制备
参照罗凯云[16]的方法制备体外发酵实验溶液,并在121 ℃高压灭菌20 min后加入0.25 g/L的L-盐酸半胱氨酸,于厌氧室中过夜待用。实验分为4组:空白组、葡萄糖组、KGM组、KOGM组,即准确称量(100±0.5)mg对应样品于已灭菌的50 mL离心管中,加入8 mL预还原的体外发酵实验溶液使样品完全水合。
1.2.2.2 粪便样本的收集和处理
取健康志愿者和乳糖不耐受症志愿者(每组各2男2女,22~28岁,至少在实验前3个月没有服用抗生素类药物)新鲜粪便,将其分为2组(健康组和乳糖不耐受症组),分别在组内将志愿者粪便样品等量混合,按质体比1∶5的比例(6倍稀释)向粪便中加入37 ℃的体外发酵实验溶液,混匀后过滤,收集滤液(2 mL)加入到完全水合好的样品管中,氮吹密封, 37 ℃厌氧培养箱中孵育。分别孵育0、3、6、12、24、48 h采集发酵液样品。
1.2.2.3 发酵液相关指标测定
用酸度计测定发酵液在不同发酵时间段的pH值。发酵液在4 000 r/min、4 ℃条件下离心5 min,取上清液测定发酵液SCFA含量。
1.2.2.4 SCFA分析
气相混标液的配制:分别取乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸标准品各100 μL,置于10 mL容量瓶中,用蒸馏水定容,即为10 mL/L的标准储备液,试验中需要稀释现配的7个稀释梯度的标准溶液做标准曲线如表1所示。

表1 标准溶液中SCFA的响应时间、标准曲线Table 1 Retention time, calibration curves of differentshort-chain fatty acids in standard solution
SCFA的提取和测定[17]:取人粪发酵液或小鼠粪便上清液(见1.2.3)测定其SCFA含量。配制50%酸性乙醇:取25 mL无水乙醇和3.29 mL 38%浓盐酸混合,用50%乙醇定容500 mL;0.5 mL体外发酵液和0.5 mL酸性乙醇混合,旋涡,超声20 min (40 W),5 000 r/min 离心20 min,过0.45 μm滤膜。取1 μL上清液经气相色谱仪测定SCFA含量。
1.2.3 动物实验
分别将3、5、7、9 w龄雄性KM小鼠处死,用二糖酶试剂盒(乳糖酶)经酶标仪测定小鼠小肠乳糖酶活性,以此选择合适的实验小鼠[18]。
动物饲喂在西南大学药学院[SYXK(渝)2014-0002)]标准动物房内开展。温度保持在(25±0.5) ℃,相对湿度(50±5)%,12 h/12 h的灯光/黑暗循环。标准饲料,自由饮水,适应性喂养1 w后,小鼠随机分为4组:空白组、药物组、KGM组和KOGM组,分别经口灌胃纯水、思连康双歧杆菌四联活菌片、KGM和KOGM,灌胃剂量均为195 mg/kg体重,根据实验室推荐成人每日KGM剂量(2 g/60 kg)和药物推荐剂量调整确定,每组9只小鼠。
灌胃28 d期间,每周1次收集小鼠新鲜的粪便,立即放入厌氧袋,转移至冰块中冷冻。快速测定粪便样品的含水量、pH值[19]。另取1份小鼠粪便,按照1∶5(g∶mL)的比例加入饱和NaCl溶液,10 000 r/min离心10 min,取上清液用于SCFA测定。
1.2.4 KGM和KOGM对乳糖体外发酵特性的影响
实验4 w后,将空白组小鼠处死,取其结肠内容物按照1∶9的比例加入9倍(mL∶g)生理盐水稀释,制备结肠内容物稀释液。采用MENKE等[20]的方法配制6份基础发酵液进行小鼠结肠内容物体外发酵。样品分组如表2所示,置于37 ℃、160 r/min的摇床中进行酵解培养24 h后,测定发酵液pH值、SCFA含量,用二糖酶试剂盒(乳糖酶)测定小鼠小肠乳糖酶活性。

表2 发酵样品的分组及名称Table 2 Group and name of samples in fermentation
1.2.5 数据分析
2 结果与分析
2.1 KGM和KOGM在不同受试者粪便中的体外发酵指标分析
2.1.1 人粪发酵液pH值的测定
不同受试者粪便体外发酵过程中,发酵液pH值的变化随时间呈现一定的规律性(表3)。在发酵的0~24 h期间,各组pH值逐渐下降,12 h之后趋于平稳,第24小时时达到最小,第48小时时,pH值有所上升,这与秦清娟等[21]采用KOGM在小鼠盲肠内容物体外厌氧发酵的研究结果一致。其中葡萄糖组pH值降低速率最快,KOGM组较KGM组稍快。KGM和KOGM 2组与空白组比较呈显著效果(P<0.05),即KGM和KOGM可有效降低健康组和乳糖不耐受症组发酵液的pH值。发酵液的pH值变化主要受微生物生长产生的有机酸和游离氨影响[22],可能是因为不同发酵液中微生物发酵产酸或游离氨速率不同,从而导致pH值变化速率不同。
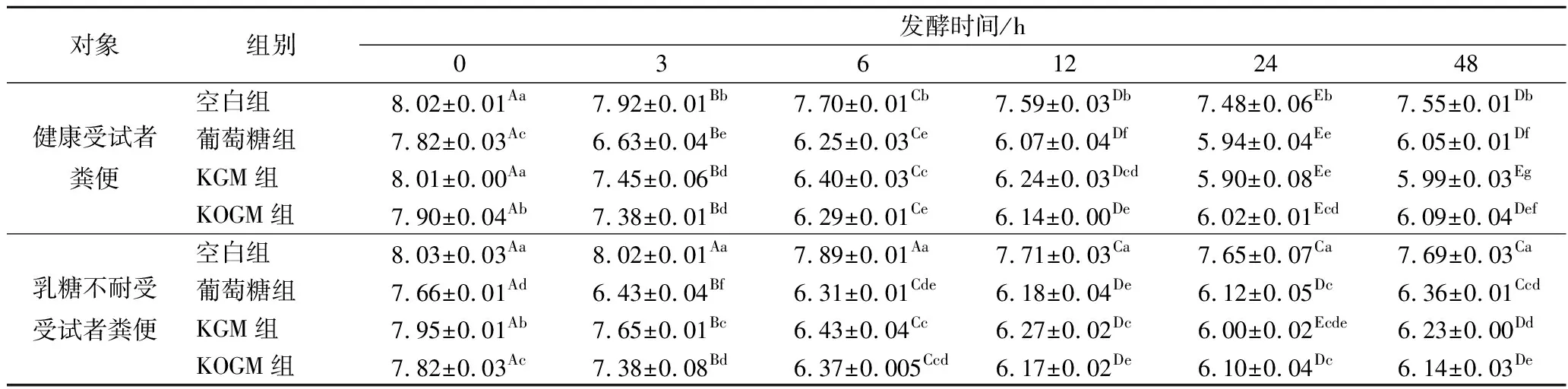
表3 不同添加物在体外发酵液中的不同时间点的pH变化Table 3 Changes of pH in fermented cultures added with different additives at different time during fermentation
注:同一行中不同大写字母表示同一组样品在不同时间段具有显著性差异(P<0.05),即组内差异;同一列小写字母不同表示同一时间段不同组别之间具有显著性差异(P<0.05),即组间差异(下同)
2.1.2 人粪发酵液SCFA含量的测定
在多糖酵解过程中,乙酸、丙酸和正丁酸是主要生成物,对人体健康是有益的。乙酸能被大脑、心脏和外周组织氧化。丙酸可以影响肝脏和胆固醇代谢。丁酸可作为结肠上皮细胞的能量来源,调节上皮细胞和免疫细胞的生长和凋亡,并能抑制结肠炎和结肠癌[23-24]。
由图1可以看出,KGM和KOGM酵解培养物中的乙酸、丙酸和丁酸在0~6 h之间浓度显著增加,12 h之后趋于稳定。6~24 h内,葡萄糖组、KGM组和KOGM组的SCFA产量均显著高于空白组(P<0.05)。由此可知,KGM和KOGM可以促进人体粪便体外发酵培养物中SCFA的产生,这与之前的研究结果一致[5,25]。

a- 乙酸;b- 丙酸;c- 丁酸图1 乳糖耐受和不耐受受试者粪便菌群体外发酵中乙酸(a)、丙酸(b)和丁酸(c)的产量Fig.1 Content of acetic acid (a), propionic acid (b) and butyric acid (c) in fecalbacteria of lactose tolerant and intolerant subjects
健康受试者和乳糖不耐受症受试者粪便体外发酵过程中,两者的空白组间SCFA含量没有显著性差异(P>0.05),说明SCFA产量与粪便菌群没有直接的关系;与健康组人群粪便体外发酵结果相比,KGM和KOGM能促进乳糖不耐受症组人群粪便发酵产生更多的乙酸和丁酸。由此可见,魔芋葡甘聚糖及其衍生物对促进乳糖不耐受症人群粪便体外发酵液中SCFA的产生也具有促进作用[9]。
2.2 各年龄组小鼠小肠乳糖酶活性
如表4所示,随小鼠年龄增加,小肠乳糖酶活性呈下降趋势,此结果与之前研究结果一致[18],这也符合人类肠道乳糖酶活性随年龄增长而下降的情况。另有研究表明[26],小鼠小肠乳糖酶基因与人类同源性较高,说明选用小鼠作为乳糖不耐受症的实验动物是可行的。因此,选用5 w龄成年小鼠作为本次动物实验受试对象。
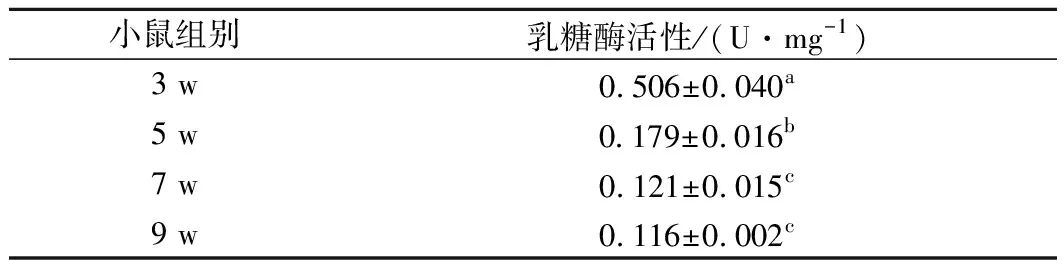
表4 各周龄组小鼠小肠乳糖酶活性Table 4 Intestine lactase activities of mice in differentage groups
2.3 KGM和KOGM对小鼠粪便参数的影响
2.3.1 小鼠粪便含水量的测定
小鼠在灌胃期间,药物组、KGM组和KOGM组结肠粪便中的水分含量显著高于空白组(P<0.05)。这表明在整个实验过程,摄入KGM、KOGM能增加小鼠粪便含水量,可以提高排泄物的体积,形成松弛的粪便[19]。这有利于结肠的健康,对控制肠道蠕动,加速有毒物质排除,维持肠道形态具有促进作用[27]。
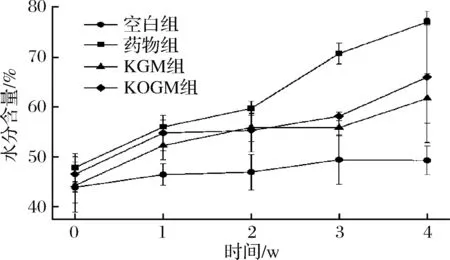
图2 灌胃后不同时间段内各组小鼠粪便含水量Fig.2 Mice faeces moisture of each group during differenttimeframes
2.3.2 小鼠粪便pH值的测定
结肠pH的降低对人体健康有益,较低的结肠 pH 能抑制有害病原菌的繁殖并影响结肠微生物酶活性[19]。因此,结肠粪便pH值的改变可作为评估KGM和KOGM对小鼠结肠影响的指标之一。如图3所示,小鼠结肠粪便 pH 在实验开始时均为弱碱性(pH 8.24)。摄入KGM和KOGM 28 d后,KGM组和KOGM组小鼠结肠粪便的pH值分别从(7.72±0.04)和(7.77±0.02)降低为(6.43±0.04)和(6.33±0.04)(P<0.05),而空白组小鼠结肠粪便的pH仍保持在(7.98±0.06),且在灌胃1~4 w内没有显著性差异(P>0.05)。结果表明,KGM和KOGM的摄入可以有效降低小鼠结肠粪便 pH 值,这可能是由于KGM和KOGM在小鼠结肠中的酵解所致。有研究结果表明[5,21],KGM和KOGM可以通过降低粪便pH和增加粪便中双歧杆菌和乳酸杆菌的比例来改善结肠生态,这些都对促进肠道健康有积极作用。

图3 灌胃后不同时间段内各组小鼠粪便pH值Fig.3 pH of mice faeces during different timeframes ineach group
2.3.3 小鼠粪便SCFA含量分析
不同组小鼠粪便中SCFA含量如图4所示,均随着时间的延长而增多。灌胃3 w后,短链脂肪酸的含量迅速增长,且实验组均显著高于空白组(P<0.05)。这表明,KGM和KOGM可有效改善小鼠肠道微生物菌群代谢产生SCFA[28]。
由图4-a,图4-e可知,KGM对乙酸和戊酸的增加作用显著,尤其是乙酸(P<0.05),这与CHEN等[7]研究结果一致。KOGM对促进丙酸、异丁酸、异戊酸,尤其是丁酸的作用显著(P<0.05)。因此,KGM和KOGM对SCFA含量会产生影响。
2.4 KGM和KOGM对乳糖体外发酵特性的影响研究
2.4.1 小鼠结肠内容物体外发酵液pH值测定
在小鼠结肠内容物体外发酵过程中,微生物利用不同底物发酵的pH值变化如表5所示。

a- 乙酸;b- 丙酸;c- 丁酸;d- 异丁酸;e- 戊酸;f- 异戊酸图4 KGM和KOGM对小鼠粪便SCFA含量的影响Fig.4 Effect of KGM and KOGM on SCFAs of mice faeces
表5 不同原料酵解培养物中pH的变化Table 5 Changes of pH in fermented cultures added with different materials at different time during fermentation
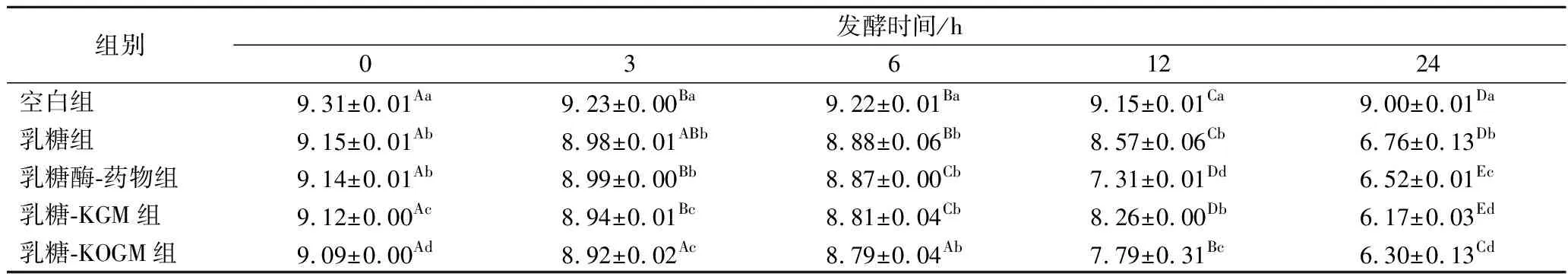
组别发酵时间/h0361224空白组9.31±0.01Aa9.23±0.00Ba9.22±0.01Ba9.15±0.01Ca9.00±0.01Da乳糖组9.15±0.01Ab8.98±0.01ABb8.88±0.06Bb8.57±0.06Cb6.76±0.13Db乳糖酶-药物组9.14±0.01Ab8.99±0.00Bb8.87±0.00Cb7.31±0.01Dd6.52±0.01Ec乳糖-KGM组9.12±0.00Ac8.94±0.01Bc8.81±0.04Cb8.26±0.00Db6.17±0.03Ed乳糖-KOGM组9.09±0.00Ad8.92±0.02Ac8.79±0.04Ab7.79±0.31Bc6.30±0.13Cd
在发酵6~24 h内,乳糖-药物组和乳糖-KGM组的发酵液pH值降低速率最快。发酵24 h之后,乳糖-KGM组和乳糖-KOGM组的发酵液pH值显著低于其他组(P<0.05)。综上所述,在乳糖中加入KGM和KOGM加速了发酵液pH值降低的速率,且与其他组相比,pH值更低,这有益于机体的健康。因此,在乳糖中加入KGM和KOGM能为机体提供良好的酸性环境。
2.4.2 小鼠结肠内容物体外发酵液SCFA含量分析
小鼠结肠内容物体外发酵24 h后,不同底物的发酵产物SCFA含量分析如表6所示,乙酸的产生量最高,是结肠微生物群产生的最丰富的SCFA[11],其次是丁酸,丙酸含量最低。与乳糖组相比,KGM和KOGM的添加显著提高了发酵液中乙酸和丁酸的产量(P<0.05),且KOGM的作用更显著,这可能是由于KOGM更易被分解并吸收利用,KGM的分子量影响发酵速度[12]。KGM和KOGM在发酵24 h时与其他组的丙酸产量没有差异,这与CHIU等[12]在实验中得到的丙酸含量的结果不同,这可能是由于小鼠的结肠吸收率和/或结肠细菌和代谢能力的差异所致[12]。简言之,在乳糖中添加KGM和KOGM可以促进小鼠结肠内容物发酵液中SCFA的产生,这些都可以说明KGM和KOGM对肠道健康具有积极作用。
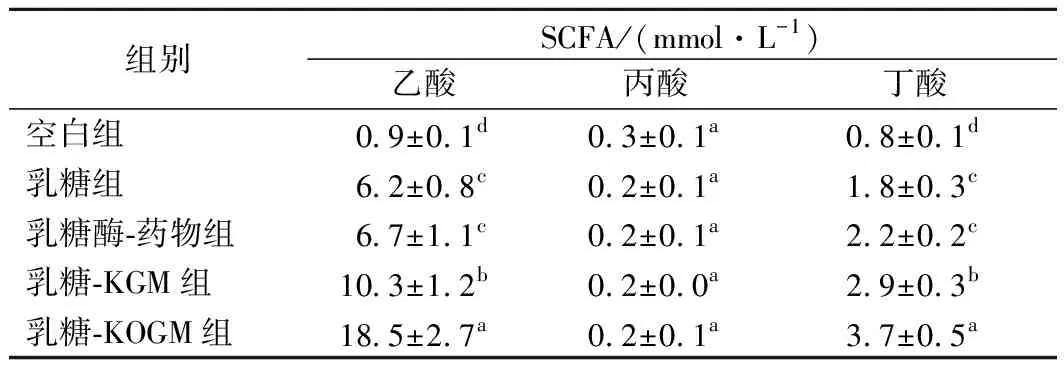
表6 酵解24 h时不同原料酵解培养物中的SCFA浓度(n=3)变化Table 6 SCFA concentrations in fermentation cultures at24 h using different materials (n=3)
2.4.3 小鼠结肠内容物体外发酵液乳糖酶活性测定
乳糖酶是动物体内消化分解乳糖的主要酶源,由图5可知,药物、KGM和KOGM的加入,使小鼠结肠内容物体外发酵液乳糖酶的活性高于其他组,且具有统计学差异(P<0.05),可见,KGM和KOGM可促进乳糖酶的恢复和增加。实验药物的主要成分是双歧杆菌,KGM和KOGM分解产生双歧杆菌,而双歧杆菌可以产生乳糖酶[14],故其对乳糖酶活性的增加具有显著作用。这些结果表明,KGM和KOGM可以作为治疗乳糖不耐受症的研究对象。但KGM和KOGM对乳糖在小鼠结肠内容物体外发酵特性的影响涉及其量效关系还未进行研究,值得后续深入探究。

图5 酵解24 h时不同原料酵解培养物中的乳糖酶活性变化(n=3)Fig.5 Lactase activity in fermentation cultures at 24 h usingdifferent materials
3 结论
本文对KGM和KOGM在健康受试者和乳糖不耐受症受试者粪便体外发酵中发酵液的pH值和SCFA含量随时间的变化进行研究,并探究了其对小鼠结肠粪便pH值、含水量和SCFA含量的影响,以及其与乳糖在体外发酵过程中发酵液的pH值、SCFA含量和乳糖酶活性的变化。结果表明,KGM和KOGM对健康受试者和乳糖不耐受症受试者均具有良好的益生作用,可以为机体提供良好的酸性环境,有效改善小鼠肠道微生物菌群代谢产生SCFA,促进结肠发酵和乳糖酶活性的增加,在治疗乳糖不耐受症的益生元制品开发具有应用潜力。
——壳聚糖固定化乳糖酶条件的优化

