扩张型心肌病患者左心室球形度与附壁血栓的相关性分析
王雪芹,张菲斐,杨廷杰
(郑州大学第一附属医院心内科,河南 郑州 450052)
扩张型心肌病(dilated cardiomyopathy,DCM)以心室腔扩大和心肌收缩功能下降为特征,临床表现为心力衰竭、心律失常和血栓栓塞,是引起猝死的常见疾病之一。DCM由于收缩功能障碍发生血栓栓塞并发症的风险较高,血栓脱落可导致脑栓塞、肺栓塞及周围动脉栓塞,使患者致残甚至死亡[1]。Gottdiener等[2-3]通过超声心动图观察发现8%~19%的左心室收缩功能下降患者的左心室内形成附壁血栓。Kaolawanich等[4]进一步的研究提出左心室重构过程中大小和形态的改变可能与其附壁血栓的形成密切相关。但左心室形态的改变与DCM患者附壁血栓的关系目前尚无定论。因此,本研究通过心脏磁共振(cardiac magnetic resonance,CMR)计算左心室球形度,定量描述左心室的球形重构,探究其与DCM患者附壁血栓的相关性。
1 对象与方法
1.1 研究对象收集2013年1月至2019年6月于郑州大学第一附属医院心内科因心衰住院诊断为DCM的患者,根据是否形成附壁血栓并经过年龄与性别配对后,纳入对照组和研究组共56对(112例)患者。对照组为无附壁血栓的扩张型心肌病患者,研究组为DCM病合并附壁血栓的患者。入选标准:(1)符合《中国扩张型心肌病诊断和治疗指南》[5]中扩张型心肌病诊断标准,具有心室扩大和心肌收缩功能降低的客观证据,左心室舒张末期内径(left ven tricular end-diastolic volume,LVEDd)>5 0 cm(女性)和 >5 5 cm(男性);(2)左室射血分数(left ven tricular ejection fraction,LVEF)<45%(Simpsons法),左室短轴缩短率(left ventricular fraction shortening,LVFS)<25%;(3)除外高血压、心脏瓣膜病、先天性心脏病或缺血性心肌病。排除标准:(1)既往高血压病史、心脏瓣膜病史、先天性心脏病史或缺血性心肌病史;(2)由于永久性起搏器或植入式心脏复律除颤器植入而无法进行 CMR;(3)既往钆过敏史;(4)幽闭恐惧症病史。对所有患者进行完整的体格检查及详细的病史采集,入院后次日早晨空腹进行肝肾功能、电解质、心肌酶谱等生化检查并行心脏彩超及心脏磁共振检查。
1.2 左心室球形度的测量飞利浦Ingenia 3 0 T进行心脏磁共振检查,每分钟心率>75次者给予β受体阻滞剂25~50 mg。采用16通道体线圈,平扫检查包括电影序列(心脏电影序列包括左心室短轴及两腔心、三腔心及四腔心长轴电影图像)、T2加权成像(T2WI)、增强前的T1定量检查;增强检查包括首过灌注、延迟增强及增强后的T1定量检查。准确测量左心室横径、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(left ventricular end-systolic volume,LVESV)、左心室舒张末期容积指数(left ventricular end-diastolic volume index,LVEDVI)、左心室收缩末期容积指数(left ventricular end-systolic volume index,LVESVI)、心肌质量指数、LVEF等参数。左室球形度是根据左心室舒张末期容积与四腔心切面中左室舒张末期长轴为直径所计算假想球体积之比[6]。见图1。左心室长轴为四腔心切面心尖至二尖瓣瓣环中点的连线。本研究最大与最小左心室球形度对应的心室切面形态见图2。
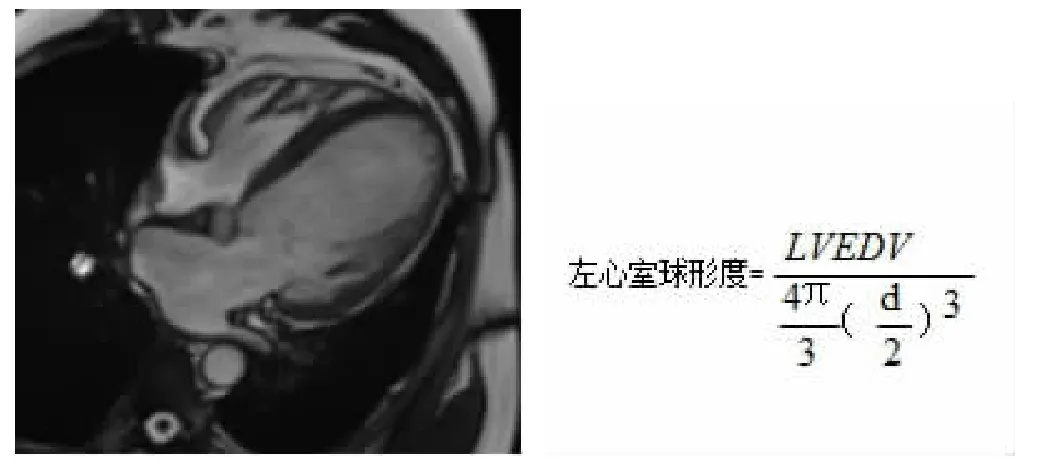
图1 左心室球形度计算示意图
1.3 统计学方法采用SPSS 22 0统计软件处理数据,计数资料按照例(%)来表示,服从正态分布的计量资料以(±s)表示,配对计数资料间的比较采用配对χ2检验,服从正态分布的配对计量资料间的比较采用配对t检验。绘制ROC曲线进一步分析左心室球形度的诊断价值。P<0 05为差异有统计学意义。
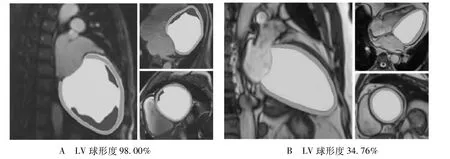
图2 A和B分别为最大与最小左心室球形度时矢状面、水平面、冠状面的左心室切面形态(图A中心室内的黑色代表附壁血栓)
2 结果
2.1 一般资料研究组房扑或房颤发生率高于对照组,差异有统计学意义(P<0 05)。两组其他指标间差异无统计学意义(均P>0 05)。见表1。
2.2 CMR结果研究组LVEF低于对照组,左室球形度高于对照组,差异有统计学意义(均P<0 05)。见表2。
2.3 左心室球形度与血栓形成的预测绘制受试者工作特征曲线(ROC曲线),显示左心室球形度:AUC=0 863,95%CI(0 785,0 940),P<0 001。根据ROC曲线及约登指数分析,左心室球形度以54 44%作为分界值时,其敏感度和特异度分别为82 9%和75 6%,Logistic回 归 显 示:OR =65 291,95%CI(2 452,1 738 904),P=0 013。左心室球形度以60 27%作为分界值时,其敏感度和特异度分别为68 3%和 90 2%,Logistic回归显示:OR=25 000,95%CI(3 397,184 503),P=0 002。
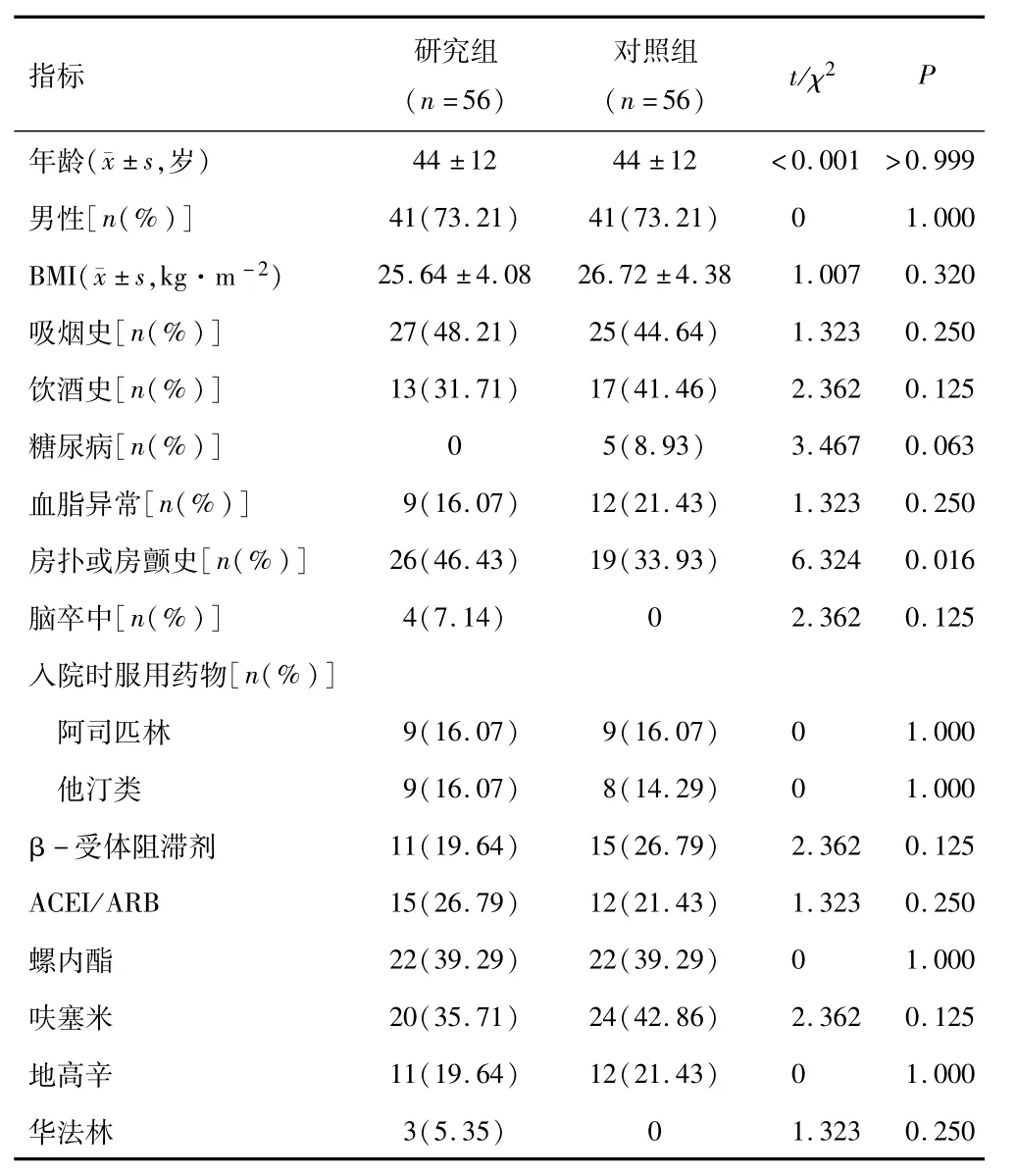
表1 两组临床资料比较
表2 两组心脏磁共振结果比较(±s)
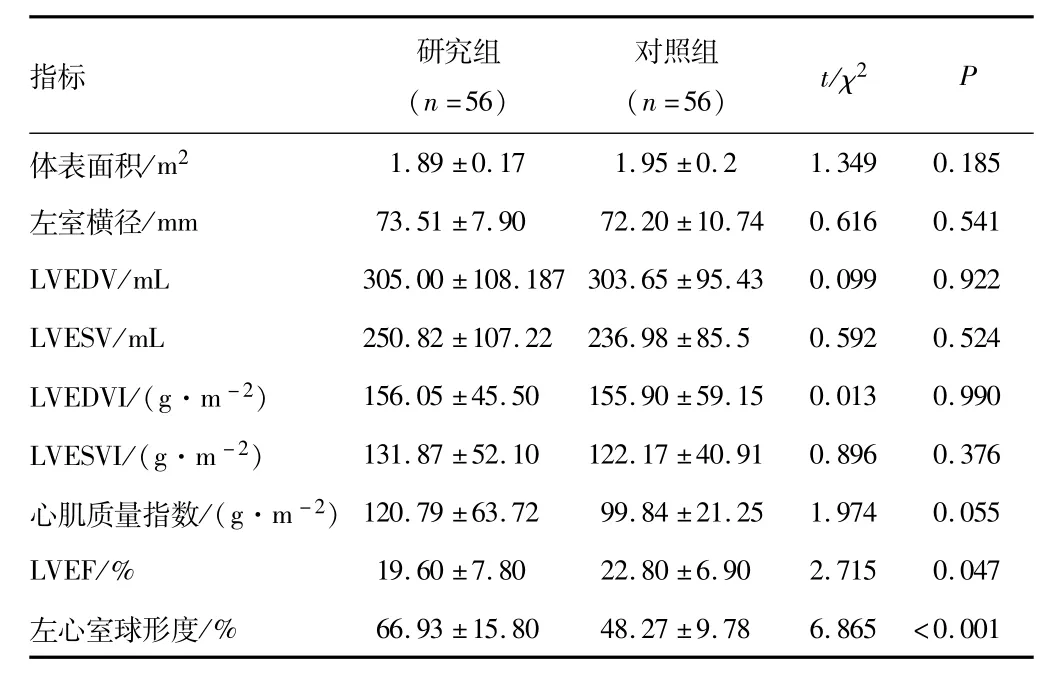
表2 两组心脏磁共振结果比较(±s)
指标 研究组(n=56)对照组(n=56) t/χ2P体表面积/m21.89±0.17 1.95±0.2 1.349 0.185左室横径/mm 73.51±7.90 72.20±10.74 0.616 0.541 LVEDV/mL 305.00±108.187 303.65±95.43 0.099 0.922 LVESV/mL 250.82±107.22 236.98±85.5 0.592 0.524 LVEDVI/(g·m-2) 156.05±45.50 155.90±59.15 0.013 0.990 LVESVI/(g·m-2) 131.87±52.10 122.17±40.91 0.896 0.376心肌质量指数/(g·m-2) 120.79±63.72 99.84±21.25 1.974 0.055 LVEF/% 19.60±7.80 22.80±6.90 2.715 0.047左心室球形度/% 66.93±15.80 48.27±9.78 6.865 <0.001
3 讨论
DCM患者的病理生理学基础是心室重构,表现为心室腔扩大、室壁变薄或相对变薄和心室腔几何形态的改变,附壁血栓形成的风险较高。有研究提出,左心室重构与附壁血栓密切相关[4]。但左心室形态的改变与DCM患者附壁血栓的关系目前尚无定论。
本研究发现研究组左心室球形度明显高于对照组,但两组性别、吸烟史、饮酒史、BMI、血脂异常、脑卒中、相关用药史、体表面积、左室横径、LVEDV、LVESV、LVEDVI、LVESVI无显著差异。ROC曲线分析显示左心室球形度以54 44%作为分界值时,其敏感度和特异度分别为82 9%和75 6%;左心室球形度以60 27%作为分界值时,其敏感度和特异度分别为68 3%和90 2%。提示左心室球形度作为一项定量描绘心室球形重构的指标,可能成为DCM患者附壁血栓形成的一项独立预测因子。
既往研究表明,心肌应力和心室壁张力的增加及心肌纤维化可能参与心室重构过程[7-8]。Kramer等[9]研究发现左心室形态改变与心肌纤维化进程密切相关,并提出左心室三维球形指数可成为评估心室重构的一项临床指标。Zeng等[10]研究发现心室重构过程中左心室由椭圆形向球形转变的趋势,并提出左心室球形指数可用于评估扩张型心肌病患者左心室形状的改变。Douglas等[11]提出左心室球形度是DCM患者发生不良心血管事件的独立预测因子。研究发现左心室附壁血栓的形成与射血分数下降、血流速度减慢、血液淤滞、心室内膜表面炎症状态和心室重构等多种因素密切相关。Fyrenius等[12]提出在不对称形态的心腔中,血液易产生涡流,可明显减少血液缓慢流动的区域。与此相反,对称的球形心腔结构则会明显减少涡流,促进血液淤滞及血栓形成[13]。Tumkosit等[14]研究也提出与正常受试者相比,球状左心室心尖部血流多为淤滞或湍流状态,易于形成附壁血栓。因此,心室重构过程中左心室的球形改变会引起心室腔内的血流动力学改变,促进附壁血栓的形成。此外,心室重构过程中伴随的室壁内膜的慢性炎症状态,可促进心内膜细胞的损伤和血小板及凝血酶的活化,促进附壁血栓的形成。
指南中提出对于已有附壁血栓形成和血栓栓塞并发症的DCM患者必须接受长期抗凝治疗[5]。DCM由于心室重构发生房颤或房扑的风险较高。本研究中DCM合并附壁血栓组中有26例(46 43%)患者合并有心房颤动,应当提前接受抗凝治疗,可能避免附壁血栓的形成。结合ROC曲线分析,本研究左心室球形度以54 44%作为分界值划分是否具有球形左心室,敏感度和特异度分别为82 9%和75 6%。进一步的Logistic回归分析显示球形左心室较非球形左心室患者,附壁血栓形成的风险增加约64倍,提示球形左心室与附壁血栓的形成密切相关。研究组中46例(82 14%)患者具有球形左心室,其中 23例(41 07%)未合并心房颤动,若给予此部分患者适当的抗凝治疗,41 07%的患者可能避免附壁血栓形成及其严重并发症的发生。因此,本研究从左心室形态的角度着手,探讨其与附壁血栓的相关性,获得独立于传统的抗凝治疗证据,在精准医疗的时代,有助于制定个体化治疗方案。
综上所述,左心室球形度是评估左心室结构重构过程的一种定量指标,与DCM患者附壁血栓密切相关,可能成为DCM患者附壁血栓形成的一项独立预测因子。本研究样本量较少,今后仍需进一步的大样本前瞻性临床研究证实左心室球形度对附壁血栓的预测价值。

