系统性红斑狼疮患者外周血单个核细胞中ADAR1与IFN-α的相关性及临床意义
狄雪琪,高聪聪,张纯 ,孙文博,梁文芳,姚孟辉,王倩倩,郑朝晖
(郑州大学第一附属医院风湿免疫科,河南郑州 450052)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多因素自身免疫性疾病,其发病机制尚未明确。研究显示SLE患者的血液系统有异常高的RNA编辑水平,一些会影响蛋白质翻译并可能产生新的自身抗原[1]。RNA腺苷脱氨酶(adenosine deamina ses acting on RNA,ADAR)是能将RNA中腺苷转变为肌苷的A至I编辑酶。ADAR1是第一个被识别且表达最广泛,是哺乳动物中有编辑酶活性的脱氨酶之一。近期发现ADAR1基因突变与多种自身免疫性疾病有关,如Aicardi-Goutières综合征某些表型与 SLE相似,患者I型干扰素(IFN)升高,其严重的自身免疫表现强调了ADAR1在维持体内免疫平衡方面的重要性[2]。Vlachogiannis等[3]明确所有类风湿性关节炎患者滑膜组织及活动性患者血液中ADAR1升高,经治疗改善后ADAR1下降。研究者在HeLa和MCF7细胞体外实验发现,IFN-α水平改变可调节ADAR1表达,而在SLE患者中,血清I型IFN升高(主要是IFN-α)并参与发病[4]。鉴于尚无探讨 SLE中 IFN-α与ADAR1相关性的研究,本研究旨在明确 SLE患者PBMCs中ADAR1与血清IFN-α的相关性及其临床意义。
1 资料与方法
1.1 一般资料选取2019年1—8月于郑州大学第一附属医院风湿免疫科住院治疗的30例SLE患者,均为汉族女性,符合1982年美国风湿病学会标准[5]对SLE的分类。排除标准:(1)合并其他自身免疫性疾病,如类风湿性关节炎、干燥综合征、皮肌炎等;(2)合并病毒感染、肿瘤、器官移植;(3)怀孕或哺乳期。另外有30名健康女性(体检信息未显示明显异常)志愿参与这项研究(对照组)。收集患者及对照组的年龄、发病时间等人口统计学信息,及患者的血尿常规、抗体检测结果等实验室检查数据,评估其临床症状并计算SLE活动指数 (SLE disease activity index,SLEDAI)[6]。此研究方案已获得郑州大学第一附属医院伦理委员会批准(伦理审查编号2019-KY-187)。所有患者均提供书面知情同意书。
1.2 PBMCs提取收集SLE患者和对照组清晨空腹外周静脉血20 mL,置于 EDTA抗凝管中,采用Ficoll-Hypaque(Pharmacia Biotech,Uppsala,Sweden)密度梯度离心法分离 PBMCs,用磷酸盐缓冲盐水(PBS)洗涤并经红细胞裂解液 (Solarbio,Beijing,China)裂解红细胞后,置于-80℃冷冻保存用于后续实验。
1.3 RNA提取和qRT-PCR实验采用 TRIzol(Servicebio,Wuhan,China)法提取 PBMCs的总 RNA后,经琼脂糖凝胶电泳鉴定其完整性,用 NanoDrop 2000超微量分光光度计(Thermo Fisher Scientific,Shanghai,China)检测 OD260nm/OD280nm的比值,对大于1 8~2 0的样品用 RevertAid First Strand cDNA合成试剂盒(Thermo Fisher Scientific,Shanghai,China)反转录为cDNA。另外,通过定量逆转录-聚合酶链反应(quantitative reverse transcriptase polymerase chain re action,qRT-PCR)来测量靶基因mRNA的相对水平。ADAR1的引物序列为 5’-TGTGGGTGGCCTTTTG GAGT-3’(正 向)和 5’ -ACCAGCGAC CCCCAACTTTT-3’(反 向)(Servicebio,Wuhan,China)。所有实验均重复3次。扩增人ACTIN cDNA作为内参对照。
1.4 血清IFN-α水平检测收集SLE患者和对照组清晨空腹外周静脉血5 mL,置于干燥的红头普通采血管中,低速离心获得血清后,按照制造商的说明,使用人IFN-α试剂盒(CUSABIO,Wuhan,China)通过酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测血清 IFN-α水平。检测范围为12 5~800 0 pg·mL-1。
1.5 统计分析采用 SPSS 21 0(IBM Corporation,Armonk,NY,USA)统计软件,进行正态性检验,符合正态分布的数据用均值±标准差(Standard Deviation,SD)表示,不符合正态分布的用中位数和四分位数表示,组间比较采用 Mann-Whitney U检验,采用Spearman相关性分析。P<0 05为差异有统计学意义。
2 结果
2.1 一般资料描述30例SLE患者均为女性,年龄为20~55岁,平均(32 93±4 97)岁,病程分布为30 00(2 00,99 00)个月,其中非活动期 6例,中度活动期12例,重度活动期12例,肾脏受累13例,24 h尿总蛋白(24 h UTP)为2 45(0 24,7 40)g,血液系统受累13例,关节受累12例。对照组年龄为24~52岁,平均(30 52±3 15)岁,其性别、年龄、种族与 SLE组比较,差异无统计学意义(均P>0 05)。
2.2 血清IFN-α和PBMCs中ADAR1的表达量及两者相关性分析SLE组PBMCs中ADAR1表达量[0 73(0 27,1 54)]高于对照组[0 44(0 25,0 69)](P<0 05)(图1A),SLE组血清 IFN-α水平[82 06(46 44,177 63)pg· mL-1]高 于 对 照 组 [0 00(0 00,4 62)pg·mL-1](P<0 01)(图 1B)。分析发现在30例SLE患者中有25例IFN-α水平<260 0 pg·mL-1,当血清 IFN-α水平 <260 0 pg·mL-1时,PBMCs中ADAR1的表达水平与血清IFN-α水平呈正相关(P=0 046,r=0 402,n=25)(图1C)。
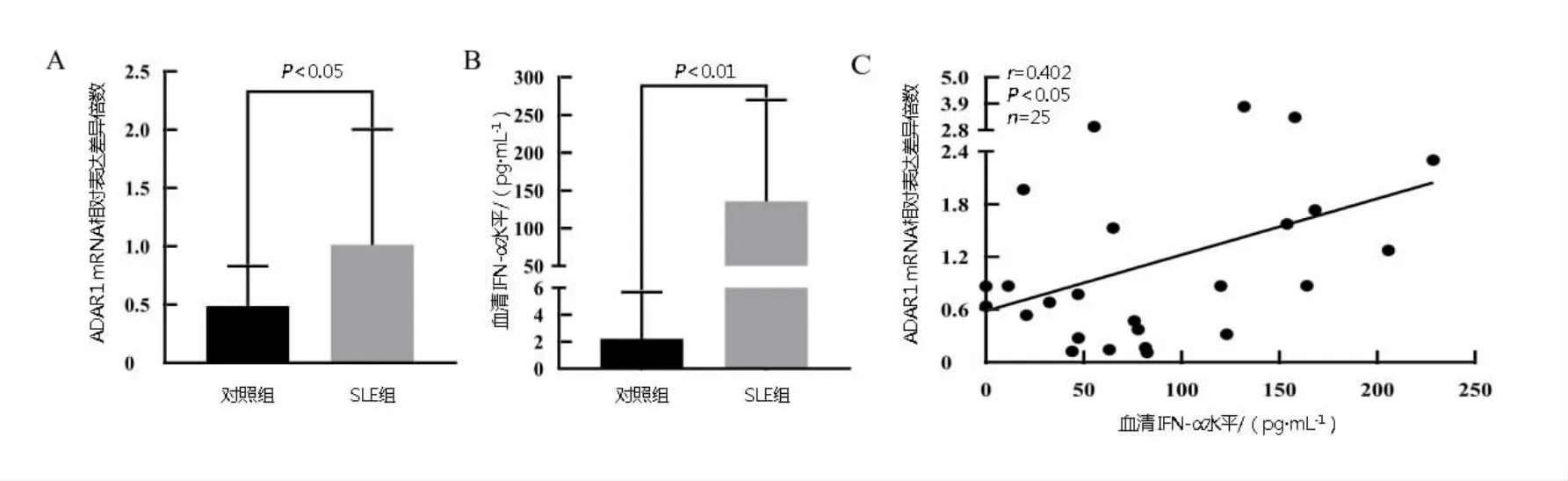
图1 血清IFN-α和PBMCs中ADAR1的表达量及两者的相关性分析
2.3 SLE患者血清IFN-α和PBMCs中ADAR1表达水平与疾病活动度的相关性分析SLE组PBMCs中ADAR1表达水平与SLEDAI和24 h UTP呈正相关,而与C3和C4无相关性。SLE组血清IFN-α水平与SLEDAI呈正相关,与C3呈负相关,而与C4和24 h UTP无相关性。见表1。
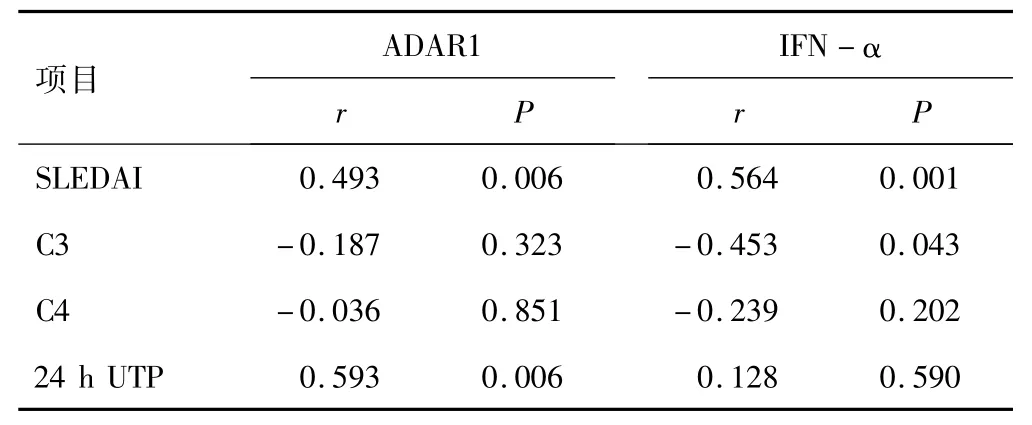
表1 SLE组血清IFN-α和PBMCs中ADAR1表达水平与临床指标的相关性分析
3 讨论
Laxminarayana等[7]提出SLE中较高的ADAR1水平可增加T细胞中的病理性RNA编辑,A至I RNA编辑是SLE中诱发基因突变的新机制。这是一种遗传信息修饰机制,是基因调控在转录后水平发生的另一重要事件,可催化转录初产物 RNA前体(pre-RNA)中特定部位的腺苷转变成肌苷,从而产生新的遗传密码,是蛋白质分子多样性发生的重要机制之一[8]。SLE患者整体编辑活动升高是炎症状态的一种表现,导致编辑的蛋白质种类增多、水平升高[9]。它们有可能被加工成自身抗原表位,之后可能被呈递至主要组织相容性复合体(major histocompatibility complex,MHC)分子上,从而刺激自身免疫反应[1],进而可能加重SLE患者的病情,临床上可表现为靶器官受损加重、SLEDAI评分增高等。本研究发现SLE组PBMCs中ADAR1表达水平高于对照组,这与Laxminarayana等[7]的研究结果一致。此外,实验中发现 SLE组PBMCs中ADAR1表达水平与SLEDAI呈正相关。因此,随着将来继续扩大样本量与完善实验,检测SLE患者PBMCs中ADAR1表达水平或可能和经典的抗dsDNA抗体发挥相似作用,成为一个评估SLE疾病活动度的潜在生物标志物。
SLE患者血清有较高水平的IFN-α,并在体内引起多种免疫反应。B细胞、T细胞和粒细胞等细胞内具有较高的I型IFN诱导基因[10]。IFN-α可通过调节各种免疫细胞的分化、激活和功能来影响免疫系统,从而促进SLE的发病[11]。本研究显示 SLE组血清IFN-α水平高于对照组,且与SLEDAI呈正相关,与C3呈负相关,这些发现与Oke等[4]的研究结果一致。Fritzell等[12]分别在Hela和MCF7两种体外细胞系中由低到高加入不同浓度的 IFN-α,最高浓度达200 U·mL-1,结果显示,随着加入IFN-α浓度的升高,两种细胞系均显示A至I的编辑率升高,ADAR1的表达量升高,说明在此浓度内的IFN-α可以最大程度的诱导编辑,而超过200 U·mL-1的IFN-α并不能继续诱导升高ADAR1的表达。我们的实验证实SLE组 PBMCs中ADAR1的表达与一定范围内血清IFN-α水平呈正相关。可能存在两种原因:第一,在此范围内的血清IFN-α可以最大程度地诱导编辑,以浓度依赖性增加ADAR1的表达,但Fritzell等[12]并未在其研究中明确这种诱导升高的机制;第二,ADAR1已被证实是IFN反应(包括IFN产生和IFN信号传导)的关键抑制因子,它保护细胞免受过度激活的IFN信号传导产生的有害影响[13],在SLE患者中有较高水平的IFN-α和IFN信号传导,ADAR1作为IFN反应的抑制因子,或可能是为抑制高水平的IFN相关反应而反馈性增加,进而可在一定程度内控制高水平的IFN-α,引起SLE患者病情加重。此外,研究发现血清IFN-α为260 pg·mL-1是一个分界点,当IFN-α超过此浓度时ADAR1表达水平开始呈下降趋势,但在本实验中仅有5例患者IFN-α浓度高于260 pg·mL-1,无法行严谨的相关性分析。Li等[14]在HEK293T细胞体外实验中证实高浓度的IFN-α可以剂量依赖性诱导ADAR1表达量下降,并认为IFN-α是通过促进 ADAR1泛素化导致其降解。因此,ADAR1在SLE患者中是否存在这种降解机制值得进一步研究。
本研究明确了ADAR1和血清IFN-α在SLE患者中的异常表达,并分析其与临床指标的相关性,发现SLE患者PBMCs中ADAR1表达水平与血清IFN-α的相关性,提出ADAR1或可成为一个评估SLE疾病活动度的潜在生物标志物,且SLE患者中异常表达的IFN-α可能参与调节PBMCs中ADAR1的表达。这些发现为进一步探索SLE发病机制提供了新线索,并为靶向药物的研发提供理论基础。

