颈动脉硬化与骨骼肌指数对中老年人群骨密度的影响
荚静芳 章秋 胡红琳
(安徽医科大学 1第一附属医院内分泌科,安徽 合肥 230022;2附属巢湖医院内分泌科)
骨质疏松、肌少症和动脉粥样硬化是伴随老年化而发生的常见退行性病变。它们随着年龄的增加而发病率逐渐增加,是老年人致残、致死的常见且主要的原因。肌少症与骨密度下降密切相关,而关于血管病变对骨密度的影响尚缺乏系统研究。本研究旨在探讨血管硬化对腰椎及髋关节各部位骨密度(BMD)的影响及四肢骨骼肌指数(SMI)与骨质疏松之间是否有相关性。
1 资料与方法
1.1研究对象及纳入标本 2015年1月至2016年12月安徽医科大学第一附属医院参加健康体检的≥50岁人群中,追问病史及完善检查后,排除影响骨代谢的相关疾病,如吸收不良,糖尿病,甲状腺疾病,严重肝肾疾病等。排除长期使用影响骨代谢的药物如皮质类固醇,抗惊厥药物。最终选取127例(男72例,女55例)进行研究,所有受试者签署知情同意书。
1.2研究方法 ①采用意大利esaote MyLabsix+型彩色多普勒超声诊断仪检查所有受试者颈动脉情况,根据颈动脉内膜硬化与否将受试者分为动脉硬化组和无动脉硬化组,统计学显示两组人群性别、年龄相匹配;②使用骨密度仪(Lunar Prodigy DF+352243,GE healthcare,USA),采用双能X线吸收法,测定所有受试者腰椎(L1~L4),取L1~L4平均值代表腰椎BMD。同时测定双侧股骨颈(简称股)与双侧髋关节(简称髋)的BMD。③同时用上述骨密度仪对受试者进行全身扫描及体成分分析,对四肢去脂肌肉质量进行相加计算出四胶骨骼肌质量(ASM),骨骼肌指数(SMI)采用公式〔SMI=ASM(kg)/身高(m)2〕计算。纳入的127例动脉硬化有52例,平均年龄为(63.6±7.5)岁,平均腰椎BMD的T值(0.10±1.34),平均左股BMD的T值(-0.84±1.0),平均右股BMD的T值(-0.84±1.1),平均左髋BMD的T值(-0.41±1.12),平均右髋BMD的T值(-0.44±1.09);平均SMI为(6.63±1.10)kg/m2。
1.3统计学方法 采用SPSS19.0统计软件进行t检验、多元线性回归分析、简单线性回归。
2 结 果
2.1两组颈动脉硬化与BMD关系比较 两组腰椎BMD、双股BMD、双髋BMD均存在显著差异(P<0.05),动脉硬化组的各个指标的绝对值均明显大于无动脉硬化组。见表1。
2.2两组SMI与BMD关系比较 简单线性回归分析发现SMI与腰椎BMD、左股BMD、右股BMD、左髋BMD和右髋BMD均有线性相关(P<0.001)。见表2。

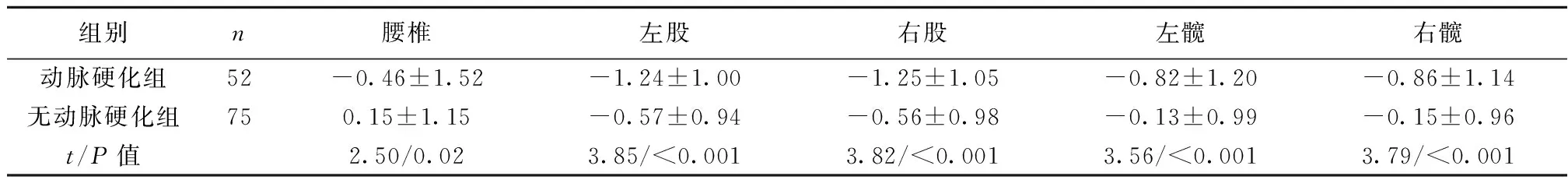
组别n腰椎左股右股左髋右髋动脉硬化组52-0.46±1.52-1.24±1.00-1.25±1.05-0.82±1.20-0.86±1.14无动脉硬化组750.15±1.15-0.57±0.94-0.56±0.98-0.13±0.99-0.15±0.96t/P值2.50/0.023.85/<0.0013.82/<0.0013.56/<0.0013.79/<0.001
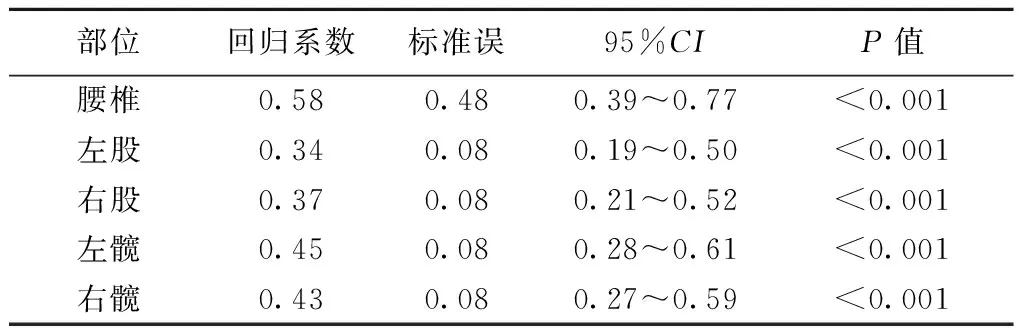
表2 SMI与各部位BMD间的线性回归分析
2.3SMI和颈动脉硬化对BMD的影响 采用多元线性回归分析SMI和颈动脉硬化对BMD的影响,纳入性别和年龄等混杂因素,结果显示年龄因素对双侧股骨颈及双侧髋关节BMD有一定影响,而对腰椎BMD未发现这一特征;有颈动脉硬化及SMI对各部位BMD有显著影响(P<0.05)。见表3。

表3 影响各部位BMD因素的多元线性回归分析〔β(95%CI)〕
1)P<0.05,2)P<0.001
3 讨 论
颈动脉硬化与骨质疏松既属于年龄相关性退行性疾病,两者的发病也有与年龄无关的直接联系。骨骼和血管之间一直有较强的联系,在骨骼和动脉中都存在类似的胶原纤维,遗传性结缔组织病可以同时表现出骨骼和动脉病变,例如,Ehlers-Danlos综合征〔1〕。颈动脉硬化是全身动脉硬化在颈部的表现,血管硬化是钙盐主动沉积于血管壁中一种细胞介导的高度可调节可逆转的过程〔2〕。血管钙化的复杂过程与骨基因表达、骨形态蛋白、钙化抑制剂(骨蛋白、基质Gla蛋白、Fetuin-A蛋白)和炎性细胞因子〔肿瘤坏死因子(TNF)、C反应蛋白(CRP)、CD40等〕有关〔3〕。血管钙化和骨骼形成过程有相似的过程,动脉粥样硬化的过程类似于软骨内骨化,即由血管平滑肌细胞向软骨样细胞或骨样细胞转化。作为破骨细胞特异性表达的溶酶体产物组织蛋白酶K,在血管内膜中层弹性蛋白与胶原蛋白的降解中发挥极其重要的作用〔4〕。
护骨素(OPG)的主要作用是抑制破骨细胞的生成并促进成熟破骨细胞凋亡,主要由成骨细胞和平滑肌细胞(VSMCS)产生,是破骨细胞活化的有效抑制剂〔5〕。核因子(NF)-κB配体激活因子又称RANKL由成骨细胞前体表达,RANK和RANKL的结合促进破骨细胞形成〔6〕。研究表明,动脉硬化异常患者的钙化沉积物中可发现OPG表达,而RANK则在其钙化灶周围的细胞外基质中表达〔7〕。另外,抑制骨形成的含糖蛋白——羧基谷氨酸蛋白(MGP)和骨钙素(OC)均同时表达于骨和血管,在动脉硬化血管中尤其表达上调,二者可以抑制BMP诱导的软骨细胞分化及血管间质的成骨分化〔8〕。此外,动脉硬化及BMD之间又有共同的致病因素导致病情发生发展。如雌激素缺乏及高脂血症亦可成为骨质疏松与动脉粥样硬化共同的危险因素。动脉和骨骼是雌激素的靶器官,雌激素受体可同时表达在血管内皮细胞、平滑肌细胞及成骨细胞、破骨细胞上,这表明雌激素在血管和骨细胞上均有直接的作用。中老年人群的生理性雌激素缺乏可能会对动脉和骨骼产生间接的影响,如产生白细胞介素(IL)-1和IL-6和TNF等,这些都与动脉粥样硬化及骨质疏松形成有关〔9〕。血脂升高可直接造成动脉内膜损伤,最终引起导致胶原纤维堆积及血管结构重建,从而加快动脉粥样硬化形成。骨骼中脂蛋白发生氧化后,抑制成骨细胞分化,增强破骨细胞作用,促进骨质疏松发生及进展〔10〕。
本研究表明颈动脉硬化发生后硬化血管的钙化灶及其周围的细胞外基质可以表达多种细胞因子影响骨的形成与吸收密切相关。随着年龄的增加,体内的骨量随之减少,钙离子能够从骨骼中游离出来并持续沉积于发生动脉粥样硬化的血管壁之上,从而形成异位钙化,当存在骨质疏松时使得大量的骨钙被释放入血,一旦大量的钙离子沉积于动脉壁内膜就会加速动脉粥样硬化速度。同时血钙含量的增加也会导致血管壁平滑肌细胞内的钙离子大量内流,引起动脉管壁的剧烈收缩,血管顺应性随之下降,患者自身的矿物质含量普遍存在着缺乏情形,直接影响成骨细胞生理功能的正常运转,骨形成与骨吸收发生障碍,使得骨细胞受到强烈刺激而大量的释放出IL-6等细胞因子,导致骨重建失衡及骨转化速度加快,最终导致动脉粥样硬化及骨质疏松的先后或者是同时发生,并且二者之间还具有一定的协同作用,进一步加剧病情的恶化程度。
通常情况下肌肉组织减少10%时就会对机体的免疫功能带来不良影响,使得感染风险大幅提高,当肌肉组织减少20%时就会出现肌无力并影响正常工作生活,发生摔伤、伤口延迟愈合的概率随之增加,当肌肉组织减少30%时肌肉功能就会出现严重下降,患者生活质量急剧下降,机体虚弱感持续增强,形成的创口无法愈合,当肌肉组织减少40%时发生死亡的风险明显增加,所以肌肉质量在一定程度上决定了个体的生命质量。关于肌肉对骨骼的影响近年来已被研究证实,两者均起源于间充质祖细胞,肌肉可以通过力学作用,及骨诱导因子和 FAM5C等多种活性因子的作用,影响骨骼发育及骨转换,造成骨量减少及骨折风险增加〔11〕。SMI下降可用来作为肌量减少的主要诊断标准。本研究结论表明腰椎BMD随着SMI的升高而升高,肌量的下降导致骨量减少。然而,长期以来肌肉健康并未引起国人及医学界的足够重视,由于肌肉减少属于一个渐进性过程,在绝大多数情况下并不会被人们所察觉,但是,一旦有所察觉时往往已经进展至肌肉衰减综合征,使得机体健康急剧下降。目前临床中常用的骨骼肌质量评价指标包括四肢骨骼肌质量、全身非脂肪体重、全身骨骼肌质量,前两个指标可以通过双能X线吸收法、生物阻抗分析法直接或者是间接测得,但在使用时容易受个体因素的影响而产生误差,所以SMI应运而生。一般情况下随着年龄的增加,SMI迅速下降,在35岁以后均值普遍低于80分,而45岁之后约有30%存在肌量减少或者低下,55岁以后仅徘徊在及格线水平。本研究证实,SMI数值越低,则腰椎BMD、左股BMD、右股BMD、左髋BMD和右髋BMD越小,之所以会出现此种变化趋势,总结其原因在于引起SMI下降及诱发骨质疏松的基因越发明确,包括维生素D受体、低密度脂蛋白受体相关蛋白5、雄激素受体、雌激素受体等,一旦SMI下降就会导致骨骼之中的基因表达水平异常改变,维生素D含量下降,低密度脂蛋白、雄激素及雌激素水平升高,大量的受体无法被其有机结合,从而对骨骼肌细胞正常运转、骨重建、骨转化和骨形成均带来不利影响,使得机体中髋部、股骨、腰椎等重要骨骼结构中的BMD大幅降低。因此,关注肌肉含量及SMI变化对于预防BMD的快速流失具有重要的现实意义。健康的中老年体检人群在疾病认知及医从性上有更好的优势,对体检中颈动脉硬化的病人及肌肉质量减少的患者进一步进行BMD筛查,减少因骨质疏松导致的骨折等不良事件的发生,在加强疾病的宣教和及时的诊治处理后可以取得更好的社会效益。

