生防菌链霉菌对西瓜枯萎病防治及幼苗生长的影响
孙洪宝, 李茂营, 吴慧玲, 郭绍贵, 张 洁, 任 毅, 张海英, 宫国义, 许 勇
(1.北京农学院植物科学技术学院,北京 102206;2.北京市农林科学院蔬菜研究中心,国家蔬菜工程技术研究中心,北京 100097;3.北京市农林科学院植物保护环境保护研究所,北京 100097)
西瓜是世界上重要的园艺作物[1],中国的西瓜栽培面积、总产量与人均消费量均居世界首位[2]。由于大棚种植长期连作引起连作障碍导致土壤理化性质发生变化,病原菌增加,极易引发病害,特别是枯萎病的大规模爆发已成为制约西瓜生产的重要因素[3]。
西瓜枯萎病是由镰孢属尖孢镰刀菌(Fusariumoxysporumf.sp.niveurn)寄生引发的真菌土传病害,严重影响西瓜产量和品质[4]。西瓜枯萎病的防治主要有砧木嫁接、培育抗病品种、轮作换茬及药剂防治等。但各具弊端,如嫁接导致果实风味和品质下降、抗病品种选育周期长、农药滥用引发环境污染等[5]。与之比较,生物防治有着安全、环保等优点。
链霉菌(Streptomyces)广泛分布于各类土壤中,因其能产生多类具有重要价值的次级代谢产物而倍受关注,在医药及农业领域有广泛的应用[6]。从土壤中分离筛选的利迪链霉菌(Streptomyceslydicus)A02,其代谢产物对植物病原真菌具有广谱抗性[7],可通过产生纳他霉素影响真菌的生长[8],A02发酵液也可诱发番茄体内防御酶活性,增强抗灰霉病的防御体系[7]。链霉菌VSMGT1014乙酸乙酯提取物对植物病原真菌有很好的拮抗作用[9]。链霉菌SSD49对苹果轮纹病病原菌、板栗疫病病原菌和大豆核盘菌等多种植物病原菌具有明显的抑制作用[10]。链霉菌M527发酵液能够抑制黄瓜枯萎病菌的生长[11]。链霉菌可以提高辣椒,黄瓜,草莓等作物多酚氧化酶活性,增强植物整体防御机能,降低病害的发生[12-14]。链霉菌还可以对植物生长发育产生一系列的促进作用,从而提高植物的抗病性[15-16]。如一些植物根际链霉菌可产生有效促进植物生长的吲哚乙酸[17]。
试验研究了链霉菌A02对西瓜枯萎病的防控效果以及对西瓜生长发育的影响,分析其固态菌剂对西瓜枯萎病防控应用的可行性,为链霉菌A02在生产上的推广应用提供理论依据。
1 材料与方法
1.1 供试材料
供试品种:枯萎病感病西瓜品种“YX”,由北京市农林科学院蔬菜研究中心西瓜课题组提供。
供试菌株:利迪链霉菌(Streptomyceslydicus)A02由北京市农林科学院植物保护环境保护研究所提供;Fusariumoxysporumf.sp.niveurnrace1(FON1)西瓜枯萎病生理小种1(FON1),由北京市农林科学院蔬菜研究中心抗病公共平台保存。
1.2 链霉菌A02皿上抑菌测定
将西瓜枯萎病菌菌饼置于马铃薯葡萄糖琼脂培养基(PDA)平板中央,距病菌等距离两侧接种链霉菌,以无菌空白PDA饼块为对照,每个处理重复3次。于25 ℃培养箱培养3~4 d后,观察链霉菌对枯萎病菌拮抗和抑制效果。
1.3 链霉菌A02固态菌剂和病原菌孢子悬浮液的制备
链霉菌固态菌剂的制备:链霉菌A02菌株发酵温度28 ℃,初始pH为7.0左右,接种量15%,培养6天。黄豆粉、麸皮与沙土占大米重量5%、20%与30%,米水比为1:1.5。发酵完成后干燥粉碎,活菌计数后待用。
FON1孢子悬浮液的制备[18]:将FON1菌块放在PDA培养基表面,置于28 ℃培养箱中,暗培养 3 d,从菌落边缘挑取菌饼,接种于PD(马铃薯葡萄糖液体培养基)培养基中,继续在28 ℃条件下摇床振荡(250 r/min)暗培养7 d,用血球计数板计数,调整孢子浓度为5×106conidia/mL。
1.4 链霉菌A02对西瓜枯萎病防控试验
1.4.1 盆栽试验设计
试验在北京市农林科学院蔬菜研究中心空调温室内展开,高压灭菌后的营养土装入育苗穴盘中(54 cm×28 cm),每穴盘播种催芽露白的西瓜种子100粒,待西瓜真叶初展时,按照每营养钵(9 cm×9 cm)含0.25 g、0.5 g与1.0 g链霉菌A02固态菌剂(1×109CFU/g)的量,与灭菌土混匀后分装于营养钵中,选取长势较为一致的西瓜幼苗进行病原菌接种,采用浸根接种法[19],浸根完成后定植到营养钵中。
试验共分为6个处理,分别为清水对照(Ctrl)、单独接种链霉菌A02固态菌剂(Ctrl+A02)、单独接种西瓜枯萎病菌(FON1)、接种西瓜枯萎病菌与0.25 g链霉菌A02(FON1+0.25 g A02)、接种西瓜枯萎病菌与0.5 g链霉菌A02(FON1+0.5 g A02)以及接种西瓜枯萎病菌与1.0 g链霉菌A02(FON1+1.0 g A02)。每个处理3个重复,每个重复30株西瓜幼苗,接种处理后遮荫2~3 d,温度保持在28 ℃。10 d后进行发病植株病情调查。
1.4.2 试验测定指标与方法
抗病性指标测定:西瓜苗期枯萎病的鉴定方法参照Martyn等的分级标准[20],并参照康振生和宗兆锋[21]的方法计算枯萎病病情指数。
接种处理14 d后,对西瓜幼苗生长指标与生理指标进行测定。
株高:用直尺测定茎基部到顶部之间的距离。茎粗:用游标卡尺测定中部茎粗度。植株鲜重与干重:植株洗净,用电子天平测定鲜重,65 ℃烘干后,测定干重。
光合作用相关指标测定:采用美国LiCOR公司的LiCOR-6400便携式光合仪测定,以不同处理西瓜植株完全展开功能叶为材料,测定叶片胞间CO2浓度(Ci)、蒸腾速率(Tr)、气孔导度(Gs)以及净光合速率(Pn)。用SPAD-502型叶绿素仪在植株功能叶上测定叶绿素含量(SPAD)。
植物激素测定:称取西瓜叶片1.0 g,采用高效液相色谱法测定激素含量。
1.4.3 数据统计与分析
数据统计分析利用Excel 2010整理原始数据,同时采用DPS V16.05软件,差异显著性分析利用LSD法进行多重比较,试验数据采用“平均值”表示。
2 结果与分析
2.1 链霉菌A02皿上抑菌效果
通过琼脂块法拮抗性和发酵液抑菌活性逐级筛选,在候选的100余株链霉菌中,得到2株链霉菌与西瓜枯萎病FON1形成明显的拮抗带,将其中一株链霉菌A02与病原菌进行皿内抑制试验,对峙培养4 d后可观察到枯萎病菌生长受到了明显的抑制,菌落形状为不规则形状,如图1所示。这表明链霉菌A02对西瓜枯萎病菌具有明显的抑制作用。

图1 链霉菌A02对FON1皿内抑制效果
2.2 链霉菌A02对西瓜枯萎病的防效
如表1所示,与单接种病原菌对照相比接种链霉菌A02能显著降低西瓜枯萎病的发病率和病情指数,不同浓度A02处理的防病效应也存在差异,0.5 g A02固体菌剂处理的效果优于0.25 g和1.0 g A02固体菌剂处理,对枯萎病防治效果也以0.5 g A02固体菌剂效果最好,对枯萎病防效达到68.23%,显著高于0.25 g A02(57.75%)和1.0 g A02(62.74%)。综合比较,选取0.5 g A02固体菌剂处理进行后续试验。
如图2所示,FON1处理导致西瓜幼苗整株严重萎蔫并枯死,而FON1+A02的西瓜幼苗病害程度降低并且新叶无病症,表明链霉菌A02对西瓜枯萎病具有显著的防控效果。
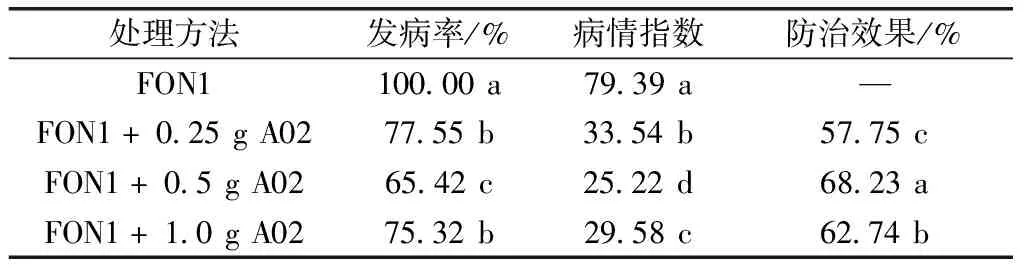
表1 不同处理对西瓜枯萎病的防治效果
注:数据是四次重复的平均值。当P≤0.05时,同一列中后跟相同字母的值没有显著性差异。

图2 链霉菌A02对西瓜枯萎病防病效果
2.3 链霉菌A02对西瓜幼苗生长的影响
如表2所示,FON1处理西瓜幼苗的株高、茎粗、鲜重及干重较清水对照显著性降低(P<0.05),严重影响西瓜幼苗生长。FON1+A02处理条件下西瓜幼苗株高、茎粗、鲜重及干重与FON1单独处理相比分别增加20.4%、25.8%、49.5%和41.3%(P<0.05),表明链霉菌A02能显著缓解枯萎病菌对西瓜幼苗生长的不利影响。与清水对照相比,添加A02处理西瓜幼苗株高与鲜重分别增加11.1%和4.9%(P<0.05),表明链霉菌A02对西瓜幼苗生长具有一定的促进作用。

表2 枯萎病接种条件下链霉菌A02对西瓜生长的影响
注:数据是四次重复的平均值。当P≤0.05时,同一列中后跟相同字母的值没有显著性差异。
如表3所示,FON1处理条件下光合作用相关指标与清水对照相比均有显著降低,FON1+A02处理条件下Pn、Ci、Gs、Tr及SPAD值较FON1单独处理分别增加17.9%、8.1%、75%、31.3%和10.7%(P<0.05),表明链霉菌A02可减轻枯萎病对西瓜幼苗光合系统的影响,增强西瓜叶片光合作用能力,进而增加光合产物的积累;气孔是植物与外界进行气体交换的主要通道,与清水对照相比,Ctrl+A02西瓜叶片气孔导度(Gs)提高27.3%(P<0.05),蒸腾速率(Tr)提高20.8%(P<0.05),表明植物生长适应性的增强,链霉菌A02对西瓜植株生长具有一定的促进作用。
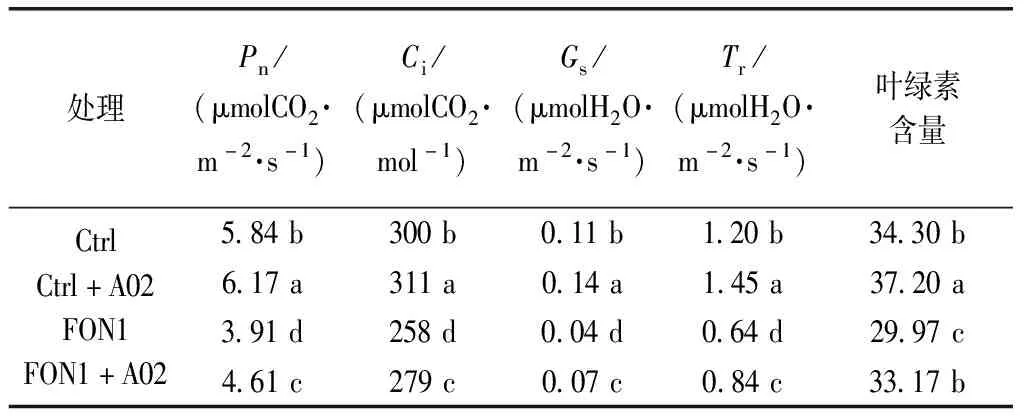
表3 枯萎病接种条件下链霉菌A02对西瓜光合作用相关指标的影响
注:数据是四次重复的平均值。当P≤0.05时,同一列中后跟相同字母的值没有显著性差异。
如表4所示,FON1单独处理条件下西瓜幼苗体内IAA含量低于可测水平,施用链霉菌A02后,FON1+A02处理中西瓜幼苗体内IAA含量显著性增加,SA较FON1单独处理增加62.00%(P<0.05)。
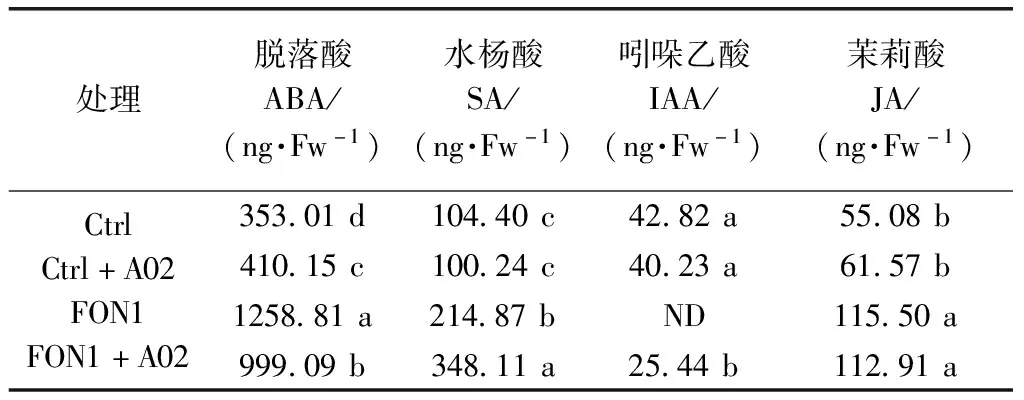
表4 枯萎病接种条件下链霉菌A02对西瓜激素含量的影响
注:数据是四次重复的平均值。当P≤0.05时,同一列中后跟相同字母的值没有显著性差异。
3 讨论与结论
利用生防链霉菌防治西瓜枯萎病国内外已有报道。任迁琪等[22]从辣椒根际土中筛选出10株对西瓜枯萎病有拮抗作用的放线菌,其中菌株F32为链霉菌属,对西瓜枯萎病的防效可达66.7%。但鉴于土传病害易受植物根际环境因素的影响,针对西瓜枯萎病使用单一生防菌剂的防效不高,且稳定性差,生产上亟需提供高效的防病促生的链霉菌生防制剂。固体发酵具有设备简单、成本低等优点,具有良好的发展前景,在本研究中,采用链霉菌A02固态发酵菌剂,盆栽试验表明A02对西瓜枯萎病防效高达68.23%,病情指数由79.39降至25.22,表明链霉菌A02固态发酵菌剂可有效防治西瓜枯萎病。目前研究大多数以盆栽试验等控制条件为主,尚需在大田等复杂环境中验证链霉菌的生防效果。
链霉菌不仅能通过诱导植物系统抗性实现其生防作用,还可通过影响植物光合作用能力和内源激素含量等生长发育指标来影响其植物抗病性[23],Wu等[24]发现利迪链霉菌(S.lydicus)能够增加番茄(Lycopersiconesculentum)叶片数量,提高光合能力,促进生长,并且增加植株体内水杨酸与脱落酸等植物生长调节剂含量,魏晓丽等[25]发现链霉菌对黄萎病接种条件下仍然具有促进棉花生长和提高光合生理特性的作用。辣椒内生细菌 BS-2可提高辣椒和白菜的生长类激素含量,减少脱落酸含量[26],植物体内生菌株XG32具ACC脱氨酶的活性,可以分泌IAA,促进植物的生长[27]。链霉菌JD211处理水稻幼苗后,促进生长提高株高与鲜重,并对水稻稻瘟病有极显著的抑制作用[28]。本研究中施用链霉菌A02后,西瓜幼苗株高与鲜重较对照增加11.1%和4.9%,西瓜幼苗叶片的叶绿素含量较对照组增加8.46%。链霉菌A02与枯萎病菌同时接种,西瓜幼苗叶片净光合速率(Pn)、细胞间CO2浓度(Ci)、气孔导度(Gs)以及蒸腾速率(Tr)均有显著性增加。在接种西瓜枯萎病条件下施用链霉菌A02后,西瓜幼苗叶片IAA含量显著增加,SA较FON1单独处理增加62.00%(P<0.05)。
综上研究结果表明,链霉菌A02对西瓜枯萎病具有良好的防控效果,进一步明确链霉菌A02固态菌剂作为生防农药的良好的应用前景。也可以考虑将其应用于其他作物病害的生物防治研究中。

