不同培养条件对哈茨木霉菌抑制串珠镰刀菌能力的影响
刘新宇 李大皓 李佩瑶
摘 要:目的:探究不同培养条件对哈茨木霉菌抑制串珠镰刀菌能力的影响。方法:采用平板对峙培养法,以抑菌率为指标,研究不同培养时间、碳源、培养基、pH值对哈茨木霉菌抑制串珠镰刀菌能力的影响。结果:不同培养时间、碳源、培养基、pH值对哈茨木霉菌抑制串珠镰刀菌的能力均有影响。培养到第4天时抑菌效果达到最佳,抑菌率为69.12%;不同碳源中,最优为葡萄糖、麦芽糖、甘露醇和乳糖;PDA培养基培养对哈茨木霉菌抑制串珠镰刀菌的生长效果最佳;pH值为5~9时,哈茨木霉菌对串珠镰刀菌抑制率无差异。结论:PDA培养基培养到第4天达到最佳抑制效果,多种碳源及广泛的pH值范围均适合哈茨木霉菌对串珠镰刀菌的生长形成抑制。
关键词:哈茨木霉菌;串珠镰刀菌;平板对峙培养法
Abstract: To investigate the effects of different culture conditions on the ability of Trichoderma harzianum to inhibit Fusarium moniliforme. The effect of different culture time, carbon source, culture medium and pH value on the ability of Rhizoctonia solani to inhibit the ability of Fusarium moniliforme was studied by using platelet confinement culture method and antibacterial rate as an index. Different culture time, carbon source, culture medium and pH value had an effect on the ability of Trichoderma harzianum to inhibit Fusarium moniliforme. The antibacterial effect was the best at the 4th day, and the antibacterial rate was 69.12%. Among the different carbon sources, best for glucose, maltose, mannitol and lactose; PDA culture medium is the best effect on Trichoderma harzianum to inhibit Fusarium moniliforme; pH value of 5 to 9 when Trichoderma harzianum on the inhibition rate of Fusarium moniliforme no difference.Conclusion: PDA culture medium reached the best inhibitory effect on the 4th day, and a variety of carbon sources and extensive pH range were suitable for the inhibition of the growth of Fusarium moniliforme.
Key words: Trichoderma harzianum; Fusarium moniliforme; Plate culture method
串珠鐮刀菌可引起植物茎腐、根腐[1]、穗腐[2]等症状,使植株生长不良,花梗易折断,最终倒伏。在玉米生长过程中,由多种病原菌单独或复合侵染造成根系和茎基腐烂的茎基腐病,俗称根腐病,是玉米产区一类重大病害。不同年代、不同地区,该病害的发病率略有不同,一般年份发病率在10%~20%,严重年份高达80%~90%,产量受损,严重者甚至颗粒无收[3-4]。一旦发生茎基腐病,玉米果穗与籽粒均受到危害,被侵染的果穗局部或全部被霉层覆盖,霉层呈现粉褐色、红色、灰黑色及黄绿色。发病植株的果穗失去光泽,颗粒不够饱满或瘪空腐烂等。该病主要由多种镰刀菌、腐霉菌侵染引起,其中镰刀菌主要之一为串珠镰刀菌[5]。另外,由串珠镰刀菌等镰刀菌产生的串珠镰刀菌素是一种水溶性毒素,其性质稳定,在pH值为4~10时,高温100℃加热及低温冷冻干燥均不会被破坏[6]。该毒素不仅对植物有危害,对动物亦有很大的危害作用。串珠镰刀菌素主要作用于动物心肌、肝、软骨细胞、骨骼肌和脾等增殖比较活跃的细胞,从而干扰细胞分裂增值,抑制细胞蛋白合成,影响各种酶活性及生物膜的通透性,降低机体免疫功能[7]。
生物防治和化学防治都是植物病害防治的重要手段。但由于化学农药的大量使用,造成了严重的大气、水体和土壤污染,并通过食物链累积循环进入到人体,危害人类健康;同时,化学农药的长期使用,不仅导致部分病菌、害虫产生了很强的抗药性,而且许多病菌害虫的天敌也被大量杀死,致使一些病菌、害虫的发生更加严重[8]。而利用生物防治抵御病虫害,就能有效地避免上述负面影响,具有广阔的应用前景。木霉菌作为一种生长繁殖速度快,适应性很强,广泛存在于世界各地土壤中的生防菌,利用其生命力旺盛、适应性强、生长速度快的特点,与病原菌竞争空间和营养,从而达到抑菌作用[9]。木霉菌作为国际公认的一种重要的生防菌,对大多数病原菌有抑菌作用,并且资源丰富,生产成本低。在国内外利用木霉菌做成的制剂,对多种病原菌均具有优良的防治效果[10-11]。基于此,在实验室现有条件下,笔者探究了不同培养条件对哈茨木霉菌抑制串珠镰刀菌能力的影响,以期为实际开发应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌 哈茨木霉菌本实验室提供,串珠镰刀菌由农学院提供。
1.1.2 试剂 葡萄糖、麦芽糖、蔗糖、可溶性淀粉、甘露醇、蔗糖、琼脂、磷酸氢二钾、磷酸二氢钾、乳糖、七水硫酸镁、七水硫酸亚铁、氯化钠、氯化钙、硝酸钠、盐酸、氢氧化钠,本实验室提供。
1.1.3 仪器 DL-CJ-2N型超级洁净工作台、SPX-400生化培养箱、SPX-LS-100A立式压力蒸汽灭菌器、LQ-C100001电子天平、C21-RK2106电磁炉、微波炉、BCD-190TMPK冰箱、便携笔式pH分析仪。
1.2 方法
1.2.1 培养基及其制备 (1)PDA培养基:马铃薯去皮洗净,切成边长约为1cm的块状,200g,加水煮沸20~30min至软化,双层纱布过滤,取滤液加入葡萄糖20g、琼脂20g,煮沸待琼脂熔化,定容1000mL。(2)胡萝卜煎汁琼脂培养基:制作方法与PDA培养基相同,仅将马铃薯换为胡萝卜。(3)稻草与麸皮培养基[12]:稻草剪成小段,80g,麸皮10g,煮沸20min,双层纱布过滤,取其滤液加CaCl2 0.3g、KH2PO4 2g、(NH4)2SO4 1.4g、MgSO4·7H2O 0.3g、琼脂20g,煮沸待琼脂熔化,定容1000mL。(4)Czapek培养基:蔗糖30g、FeSO4·7H2O 0.01g、KCl 0.5g、NaNO32g、MgSO4·7H2O 0.5g,琼脂20g,煮沸待琼脂熔化,定容1000mL。以上培养基pH值自然,均在121℃灭菌20min。
1.2.2 菌种的活化 取3℃保藏的哈茨木霉菌与串珠镰刀菌于PDA平板上进行活化培养,30℃培养4d,作为供试菌种备用。
1.2.3 平板对峙试验法 菌种活化后,用7mm打孔器分别在菌落边缘打取哈茨木霉菌与串珠镰刀菌,再用接种环挑取菌落接种于同一个PDA培养基的平板(平板外径9cm,内径8.8cm),两者相距(4±0.3)cm,作为处理组;然后取另一个PDA培养基的平板于中间仅接种串珠镰刀菌作为对照组,每组进行3个平行。30℃生化培养箱培养,分别于第1、2、3、4、5、6天观察测量对照组和处理组的串珠镰刀菌半径。对照组测量方法:以接种点为顶点,任意测量2条形成直角的菌落半径,取其平均值;处理组测定方法:测量哈茨木霉菌及串珠镰刀菌2个接种点连线上的串珠镰刀菌的菌落半径。抑菌率,计算公式如下:
抑菌率(%)=(对照组半径-处理组半径)/对照组半径×100
1.3 数据处理 用SPSS和Excel 2003软件处理数据。
2 结果与分析
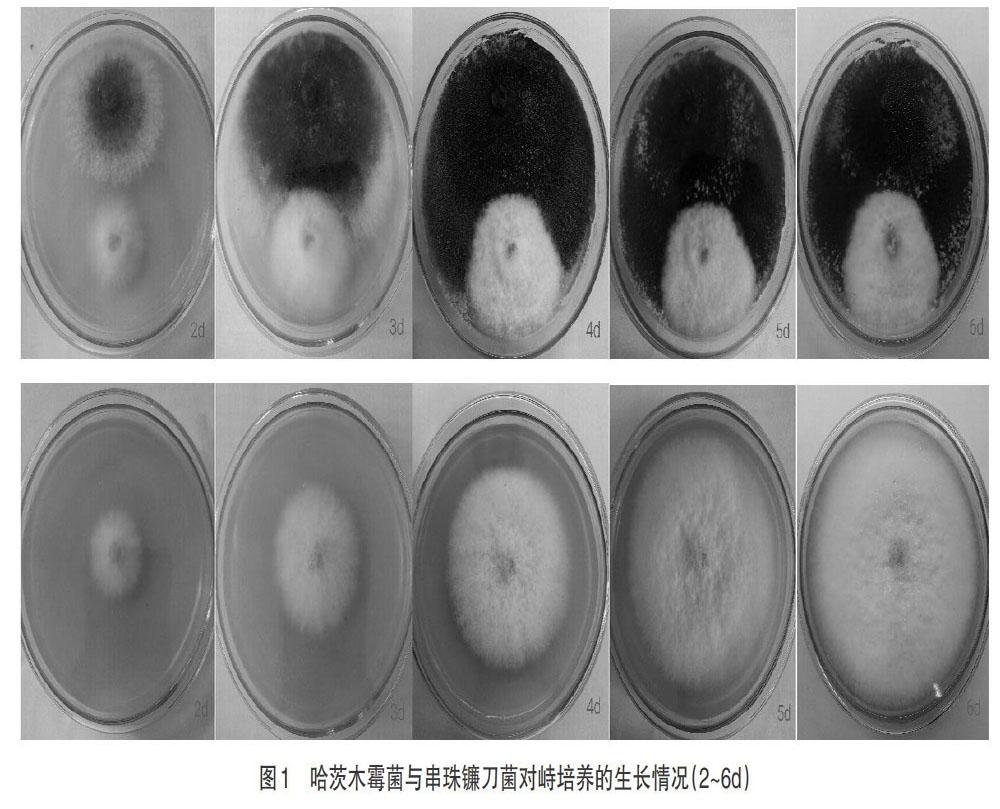
2.1 不同培养时间哈茨木霉菌对串珠镰刀菌对峙试验结果 在其他培养条件相同的情况下,在PDA培养基中进行哈茨木霉菌与串珠镰刀菌的对峙试验,分别计算第2、3、4、5、6天的抑菌率,方法参照1.2.3。用目力估测法[13]观察处理组中哈茨木霉菌的生长情况。测量记录2~6d处理组中2个菌落连线中串珠镰刀菌的平均半径。从图1可以看出,培养到第2天时,哈茨木霉菌与串珠镰刀菌菌丝生长开始接触,并未出现抑制效果;随着时间的延长,哈茨木霉菌和对照组中串珠镰刀菌的生长半径均呈增大的趋势,对照组的串珠镰刀菌在培养的第6天长满培养皿,处理组的哈茨木霉菌与串珠镰刀菌在培养第4天时半径均呈不增加的趋势。
不同培养时间哈茨木霉菌对珠镰刀菌的抑菌率见表1。由表1可知,随着培养时间的延长,哈茨木霉菌对串珠镰刀菌的抑制率呈现逐渐升高的趋势。培养到第2天时,哈茨木霉菌与串珠镰刀菌菌丝刚接触,并未出现抑制效果。培养到第6天时,哈茨木霉菌对串珠镰刀菌的抑菌率显著高于2~4d的处理,与培养5d的处理无差异。而由图1可知,培养4d时,处理组的哈茨木霉菌与串珠镰刀菌均已不再生长,5~6d时的抑菌率的提高是由于对照组的串珠镰刀菌的菌落半径继续增加造成的。故后续试验以培养4d的抑菌率为指标进行试验。
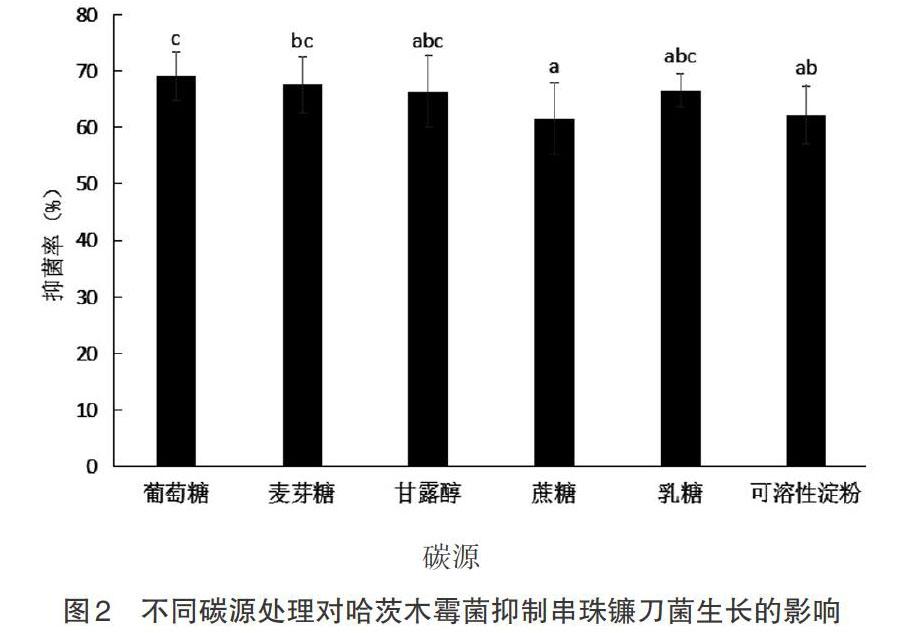
2.2 不同碳源处理对哈茨木霉菌抑制串珠镰刀菌生长的影响 在其他培养条件相同的情况下,分别用等量的淀粉、蔗糖、甘露醇、乳糖、麦芽糖替代PDA培养基中的葡萄糖,进行哈茨木霉菌与串珠镰刀菌对峙试验,于第4天计算抑菌率,方法参照1.2.3。用目力估测法观察处理组中哈茨木霉菌的生长情况。由图2可知,葡萄糖、麦芽糖、甘露醇及乳糖对哈茨木霉菌抑制串珠镰刀菌生长能力的影响无差异。葡萄糖、麦芽糖处理显著高于蔗糖处理。甘露醇、蔗糖、乳糖及可溶性淀粉对哈茨木霉菌抑制串珠镰刀菌生长的能力影响无差异。可见,在供试碳源中,葡萄糖、麦芽糖、甘露醇和乳糖的处理抑菌率较高。这与林志伟等[14]研究结论,黄绿木霉菌在液体培养过程中,结构单一的碳源更有利于有效抑菌物质的产生不同。
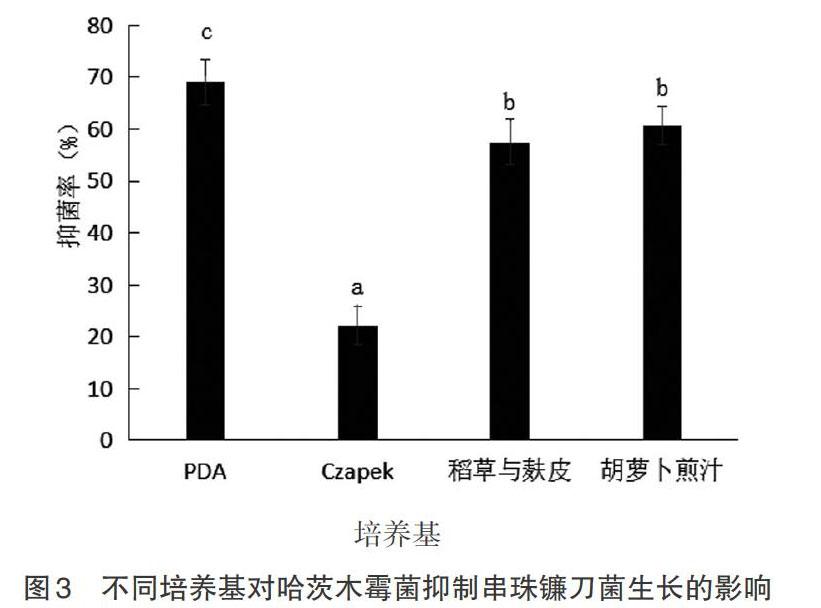
2.3 不同培养基培养对哈茨木霉菌抑制串珠镰刀菌生长的影响 在其他培养条件相同的情况下,分别在PDA培养基,胡萝卜煎汁琼脂培养基,稻草粉与麸皮培养基,Czapek培养基进行哈茨木霉菌与串珠镰刀菌对峙试验,于96h计算抑菌率,方法参照1.2.3。用目力估测法观察处理组中木霉菌的生长情况。由图3可知,供试的4种不同培养基中,PDA培养基的处理的抑菌率显著高于Czapek、稻草与麸皮和胡萝卜煎汁培养基。稻草与麸皮和胡萝卜煎汁培养基对哈茨木霉菌抑制串珠镰刀菌生长的能力影响无差异,但均显著高于Czapek培养基的处理。目力观察明显可见,在Czapek培养基中无论哈茨木霉菌还是串珠镰刀菌的生长速率均受到影响,而且木霉菌更加明显,长势微弱,但是依然对串珠镰刀菌有抑制作用。2个菌种在此培养基中生长不够旺盛的原因有待进一步研究。
2.4 不同pH值对哈茨木霉菌抑制串珠镰刀菌生长的影响 在其他培养条件相同的情况下,在未加入琼脂的PDA培养基,用10mol/L的HCI和NaOH把其pH值分別调至4.5、5.0、6.0、7.0、8.0、9.0、10.0,再加入琼脂煮沸待其熔化,进行木霉菌与串珠镰刀菌的对峙试验,于96h计算抑菌率,方法参照1.2.3。用目力估测法观察对照组串珠镰刀菌和处理组木霉菌的生长情况。由图4可知,pH值为7、8时抑菌率最高,两者间处理对哈茨木霉菌抑制串珠镰刀菌生长能力的影响无差异,但该处理显著高于pH值为4.5、10.0。当pH值为4.5、6.0、9.0、10.0时,对哈茨木霉菌抑制串珠镰刀菌生长能力的影响无差异。当pH为5.0~9.0时,哈茨木霉菌对串珠镰刀菌的抑菌率无差异,也印证了哈茨木霉菌作为生防菌适应能力强,生命力旺盛的特点。当pH值为4.5、5.0较低时,串珠镰刀菌菌落生长较慢,并且目力观测可以看出,菌落生长厚薄与密度均较弱。
3 讨论
近年来,由于化学农药污染严重,人们环保意识的提高,对生物防治的研究与关注越来越多。木霉菌作为国际公认的优秀生防菌,其本身和代谢产物均得到了各国学者青睐。根据研究报告,不同方法、不同的木霉菌或其代謝产物对不同的病原菌抑制效果具有很大区别。孙冬梅等[12]研究表明,黄绿木霉菌代谢产物在50%浓度下对杨树烂皮病菌的抑制效果达到100%。侯巨梅等[15]用平板对峙培养法研究表明,当培养到第3天时,棘孢木霉菌天Q1对串珠镰刀菌的抑菌率达到57.14%。
本试验采用平板对峙试验法,在PDA培养基中随着时间延长抑菌率增大。从理论上来说,如果有足够的生存空间和营养充足,处理组中的哈茨木霉菌利用其快速生长的优势能够从四周包围串珠镰刀菌,而对照组中的串珠镰刀菌则会无限长大,因此抑菌率将无限接近于100%。但在一定条件下得出来的试验结果存在一定的局限性。本试验特定的条件下培养1~6d中,第6天抑菌率高达76.13%,但是结合处理组中两菌相对面串珠镰刀菌的半径来看,当培养到第4天时已经出现了最好的抑菌效果。不同的碳源对对哈茨木霉菌抑制串珠镰刀菌生长的能力影响差异显著。在试验的6种不同碳源中,葡萄糖作为碳源时抑菌率最高,但葡萄糖与麦芽糖、甘露醇、乳糖4者处理差异不显著。不同的培养基对哈茨木霉菌抑制串珠镰刀菌生长的能力影差异显著,最好的为PDA培养基抑菌率高达69.12%,而最差的Czapek培养基才22.09%。这可能是因为Czapek培养基碳源(蔗糖)单一,营养物质不够丰富造成的。同时,如Czapek培养基这些采用已知化学成分的有机化合物、无机化合物和生长因素等作为营养物质配制而成的培养基总称为合成培养基,一般都会添加多种微量元素,价格昂贵且配置麻烦,不适用于现实大量使用。由本试验结果表明,在pH值为5.0~9.0时,对哈茨木霉菌抑制串珠镰刀菌生长影响的差异不显著,它们在较大pH值跨度中均能生存,性质稳定。因此,在配置培养基时一般取pH值自然即可。
根据每次相同培养基重复中3次平行处理来看,处理组中两菌接种点距离远近对抑菌率也存在很大影响。在其他条件相同的情况下,随着距离的增大,抑菌率反而减小。近距离造成两菌对生存空间及营养物质竞争更激烈。
5 结论
哈茨木霉菌能抑制串珠镰刀菌的生长,PDA培养基培养到第4天达到最佳的抑制效果,多种碳源及广泛的pH值范围均适合哈茨木霉菌对串珠镰刀菌的生长形成抑制。
参考文献
[1]陈光登.大麦抗镰刀菌型茎基腐病遗传及其与重要农艺性状间关系[D].雅安:四川农业大学,2013.
[2]郭成,魏宏玉,郭满库,等.甘肃玉米穗腐病样品中轮枝镰孢菌的分离鉴定及生物学特性[J],植物病理学报,2014,44(01):17-25.
[3]徐富义,王玉爽.玉米茎基腐病的发生及其防治[J].新农业,2015,11:27-28.
[4]马金慧,杨克泽,张建超,等.甘肃省制种玉米茎基腐病的发生与防治[A]//中国植物保护学会.植保科技创新与农业精准扶贫——中国植物保护学会2016年学术年会论文集[C].中国植物保护学会,2016,04.
[5]胡韬纲.玉米穗腐病研究进展[J].粮食科技与经济,2015,40(03):50-52.
[6]高思,雷明彦,齐德生,等.串珠镰刀菌素的理化性质、毒作用机理及中毒动物概况[J].饲料工业,2012,33(08):53-57.
[7]黄露菡,王凯,唐兆新,等.串珠镰刀菌素对仔猪部分免疫指标的影响[J].动物医学进展,2010,08:64-68.
[8]张振华.化学农药对蔬菜的污染及人体健康的危害[J].海峡预防医学志,2009,15(06):59-60.
[9]屈海泳,刘连妹,王雪梅.木霉菌在生物防治上应用的研究进展[J].湖北农业科学,2009,48(03):743-746.
[10]Chen Jie,Dou Kai,Gao Yongdong,et al.Mechanism and application of Trichoderma spp.in biological control of corn diseases.[J].Mycosystema,2014,33(06):1154-1167.
[11]Harman G E.Myths and Dogmas of Biocontrol~changes in perceptions from Reserch on Trich-oderma harzianum T-22[J].Plant Disease,2000,84(04):377-393.
[12]孙冬梅,杨谦,宋金柱.黄绿木霉菌代谢产物对杨树烂皮病菌抑菌能力的研究[J].北京林业大学学报,2006,28(01):76-79.
[13]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:141.
[14]林志伟,靳学慧.培养条件对黄绿木霉菌抑制稻瘟病菌能力的影响[J].黑龙江八一农垦大学学报,2006,18(05):17-20.
[15]侯巨梅,刘铜.棘孢木霉菌天Q1对几种植物病原菌拮抗作用研究[J].吉林农业,2014,16:19.
[16]咸洪泉,李雅华,郭立忠,等.木霉菌株TD31培养条件研究[A]//中国菌物学会.中国菌物学会第二届青年菌物学术讨论会论文集[C].中国菌物学会,2006,23(04):303-305.
(责编:张宏民)

