培养方式对纤细裸藻脂肪酸与氨基酸含量的影响
高金伟 张文慧 窦 勇 姜智飞, 贾旭颖 邵 蓬 周文礼
(1. 天津大学化工学院生物工程系系统生物工程教育部重点实验室,天津 300350; 2. 天津市水产生态及养殖重点实验室,天津农学院水产学院,天津 300384; 3. 农业农村部渔业环境及水产品质量监督检验测试中心(天津),天津 300221)
纤细裸藻(Euglena gracilis)属于裸藻门、裸藻属, 主要分布在阳光充足、有机质丰富、静止无流水的小水体中[1], 在营养充足、天然原生态的环境中得以繁殖[2]。其营养方式为兼性营养[3], 既可以通过光合作用制造营养, 有效固定环境中的CO[4],2
又可以通过渗透营养来摄取有机物, 如牛肉膏、蛋白胨、醋酸盐、乙醇等[5—8], 不同的营养方式对微藻代谢产物的种类与含量有较大的影响[9,10]。
纤细裸藻含有丰富的营养成分, 包括氨基酸、不饱和脂肪酸、维生素、裸藻糖和抗氧化成分(如β胡萝卜素、维生素C、维生素E等), 富含59种人体必需的营养元素, 氨基酸种类尤其丰富, 含有人类所需的全部氨基酸。目前, 纤细裸藻在生物饵料应用方面的重要性逐渐被认识, 已被增补到《饲料原料目录》中。但是, 对纤细裸藻代谢产物与环境互作机制这一问题的研究尚未见报道。
本文在此基础上, 选取自养、异养、兼养、光诱导四种培养方式, 实验室条件下研究了培养方式对纤细裸藻生长、脂肪酸、氨基酸的影响, 并探讨了可能的作用机理, 为阐明纤细裸藻对不同培养方式的响应提供科学依据, 同时为其开发应用提供数据支持。
1 材料与方法
1.1 微藻
纤细裸藻(Euglena gracilis)由天津农学院渔业资源与环境实验室提供。
1.2 培养方法
自养培养纤细裸藻的光自养实验在三角瓶中进行, 使用本实验室配制的AF-6自养培养基进行培养, 培养温度为(25±1)℃, 光照30 μmol/(m2·s),光暗比12 L∶12 D。每天摇瓶数次, 防止微藻细胞附壁或下沉。连续培养, 每5天扩培一次, 培养完成后进行浓缩干燥, 得到藻粉待用。
兼养培养纤细裸藻的兼养培养实验在三角瓶中进行, 使用本实验室配制的HUT异养培养基(KH2PO4: 0.02 g/L; MgSO4·7H2O: 0.025 g/L; 酵母抽提液: 0.4 g/L; 乙酸钠: 0.4 g/L; 蛋白胨: 0.6 g/L)进行培养, 其他条件同自养培养。
异养培养将纤细裸藻在0.8%的琼脂培养皿中划线, 置于黑暗环境中筛选, 选择在黑暗条件下生长状况良好的裸藻细胞, 挑取并接入三角瓶中进行培养, 光照为0, 其他条件同上。
异养培养+光诱导(简称光诱导)在黑暗条件下纤细裸藻异养培养方法同上, 培养96h后, 将其转入光照条件下光诱导48h, 温度控制在25℃左右,连续光照30 μmol/(m2·s) 48h, 培养完成后进行浓缩干燥, 得到藻粉待用。
1.3 实验方法
细胞密度与比生长速率μ的测定使用血球计数板测定藻细胞密度。
根据公式计算比生长速率μ[11]。

式中,X2为第二次取样时(t2)的细胞密度;X1为第一次取样时(t1)的细胞密度
细胞干重的测定取10 mL藻液, 分别稀释8个梯度后测藻细胞密度, 然后将样品置于烘箱中,105℃下烘干, 干燥后使用电子天平测定藻细胞干重,作细胞密度-干重的标准曲线(图1), 计算藻细胞干重[12]。

图1 藻细胞干重与密度的标准曲线Fig. 1 Curves of the relation between algal cell dry weight and cell density
脂肪酸组成分析甲脂化方法: 取样品加入到15 mL离心管中, 加入2 mL 2%氢氧化钠甲醇溶液, 水浴回流至油滴消失。加入3 mL 14%三氟化硼甲醇溶液, 继续煮沸30min。加入适量异辛烷溶液, 移去冷凝管, 加入20 mL饱和氯化钠溶液。吸取上层溶液1—2 mL, 加入无水硫酸钠脱水, 进样。
使用Agilent 7890A气相色谱-质谱联用仪进行分析, 所使用的色谱柱型号为CNW CD-2560, 规格为100 m×0.25 mm×0.20 μm。运行参数为: 进样口温度为250℃, 检测器类型为FID, 检测温度为260℃,进样量为1 μL, 分流比为10∶1, 载气流速为0.5 mL/min。柱温箱升温程序如下: 温度达到130℃后, 保持5min, 然后以4℃/min的速率升温至240℃, 保持30min。
氨基酸含量测定取0.5 g藻粉于20 mL水解管中, 加入6 mol/L的盐酸溶液16 mL, 真空脱气30min, 充氮封管; 在110℃下水解22—24h后, 用去离子水无损转移到50 mL容量瓶中定容; 取1 mL水解液于小瓶中, 真空脱酸抽干; 连续两次加入1 mL蒸馏水后抽干, 备用; 加入0.02 mol/L盐酸溶液1 mL,充分溶解后, 取500 μL置于5 mL的离心管中, 分别加入1 mol/L三乙胺乙腈溶液250 μL, 0.1 mol/L异硫氰酸苯酯乙腈溶液250 μL混匀; 室温放置1h后, 加入正己烷, 剧烈摇动, 放置10min; 取下层溶液, 用0.22 μm的水相滤膜过滤, 上机分析。
使用Agilent 1260液相色谱仪进行分析, 流动相A为乙腈(0.1 mol/L), 3%乙酸钠溶液, pH为6.5。流动相B为80%乙腈水溶液。所使用的色谱柱填充剂为十八烷基硅烷键合硅胶, 规格为4.6×250 mm×5 μm。运行参数为: 柱温为40 ℃, 流速为1.0 mL/min, 检测波长为254 nm, 洗脱梯度如表1所示。

表1 洗脱梯度Tab. 1 Elution gradient
1.4 数据统计
采用Excel 2003整理数据, 使用SigmaPlot10.0及Excel 2003绘制图形, SPSS 19.0进行单因素方差分析(One-way ANOVA), 设定显著性水平为P<0.05。
2 结果
2.1 四种培养方式对纤细裸藻细胞密度的影响
如图2所示, 在0—48h四种培养方式下藻细胞均呈对数生长, 自养组纤细裸藻生长速度显著低于其他三组(P<0.05), 光诱导组与兼养组藻细胞生长最快, 明显高于其他两组(P<0.05)。48h后, 异养组藻细胞密度开始下降, 显著低于其他实验组(P<0.05)。生长至168h, 兼养条件下藻细胞密度、细胞干重和平均比生长率(表2)显著高于其他组(P<0.05), 密度达到1.27×106cells/mL, 细胞干重高达0.044 g/L; 自养组与光诱导组细胞密度、比生长速率均无显著性差异(P>0.05)。

图2 四种方式培养纤细裸藻细胞密度的变化Fig. 2 Effects of four culture methods on the cell density ofEuglena gracilis
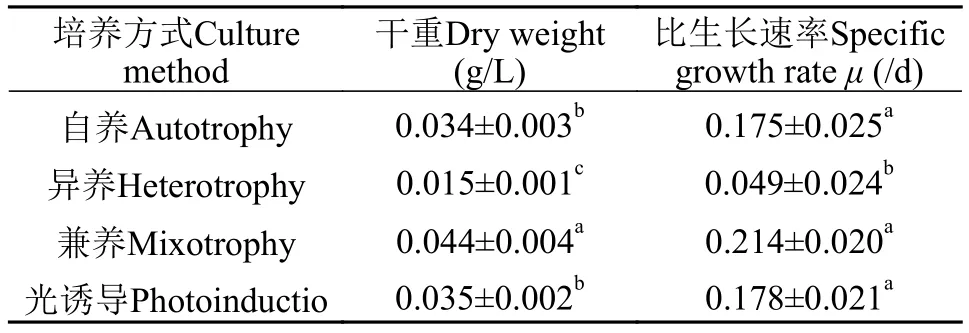
表2 四种方式下纤细裸藻干重和细胞比生长速率结果对比Tab. 2 Dry weight and specific growth rate of Euglena gracilis grown by four culture methods
2.2 四种培养方式下纤细裸藻脂肪酸含量变化
表3列出了纤细裸藻在四种培养方式下脂肪酸种类, 自养组和兼养组纤细裸藻脂肪酸碳链组成均在C12—C22, 主要为油酸甲酯(C18∶1N9C)、反式亚油酸(C18∶2N6T)和α-亚油酸(C18∶3N3)等。其中,自养组纤细裸藻共含有21种脂肪酸, 其中饱和脂肪酸(SFA)7种, 主要为月桂酸(C12∶0)、银杏酸(C13∶0)、肉豆蔻酸(C14∶0)、十五碳酸(C15∶0)、棕榈酸(C16∶0)、十七烷酸(C17∶0)和硬脂酸(C18∶0), 单不饱和脂肪酸(MUFA) 4种, 多不饱和脂肪酸(PUFA)10种。
兼养条件下共有19种脂肪酸, 饱和脂肪酸5种,主要为月桂酸(C12∶0)、肉豆蔻酸(C14∶0)、十五烷酸(C15∶0)、棕榈酸(C16∶0)和十八烷酸(C18∶0), 与自养组相比, 减少了银杏酸(C13∶0)和十七烷酸(C17∶0)两种, 单不饱和脂肪酸5种, 增加了反式油酸(C18∶1n9t); PUFA9种, 减少了二十二碳二烯酸(C22∶2n6)。

表3 在四种培养方式下纤细裸藻脂肪酸种类Tab. 3 The kinds of fatty acids in E. gracilis grown by four culture methods
异养组与光诱导组纤细裸藻脂肪酸碳链组成均在C8—C22之间, 与自养组和兼养组相比, SFA增加了3种, 分别为辛酸(C8∶0)、月桂酸(C10∶0)和十一烷酸(C11∶0)。异养组共含有29种脂肪酸组分,主要为肉豆蔻酸(C14∶0)、棕榈酸(C16∶0)、油酸(C18∶1N9C)、花生四烯酸(C20∶4N6)和二十碳五烯酸EPA(C20∶5N3)等, 占总含量的58%以上, 其中SFA12种, MUFA8种, PUFA9种。光诱导组共含有28种组分, 主要为棕榈酸(C16∶0)、油酸(C18∶1N9C)、亚油酸(C18∶2N6C)和α-亚油酸(C18∶3N3), 占总脂肪酸含量的60%以上, 其中SFA12种, MUFA6种,PUFA10种。
虽然四种培养方式下脂肪酸碳链组成相似, 但是脂肪酸含量与所占比例变化十分明显。由表4和图3可知, 脂肪酸组分含量由高到低依次为光诱导组、异养组、兼养组、自养组。在异养组中, 饱和脂肪酸占比例最高, 为49.29%, 其他三个实验组均为多不饱和脂肪酸占比最高, 其自养组、兼养组和光诱导组占比分别为65.90%、68.08%和54.83%。
2.3 四种培养方式下纤细裸藻氨基酸含量变化
氨基酸自动分析仪对17种游离氨基酸进行检测, 检测结果如表5所示, 氨基酸种类略有差别, 在自养组和兼养组检测出了半胱氨酸(Cysteine), 而在异养组和光诱导组未检测出, 而在异养组和光诱导组检测出了胱氨酸(Cystine), 在自养组和兼养组未检出。游离氨基酸含量由高到低依次为: 光诱导组>兼养组>异养组>自养组, 其中, 自养组主要为亮氨酸(LEU)、谷氨酸(GLU)和精氨酸(ARG), 占总量的39%; 异养组主要为谷氨酸(GLU)、精氨酸(ARG)和脯氨酸(PRO), 占34.7%; 异养组主要为亮氨酸(LEU)和谷氨酸(GLU), 占30.6%, 光诱导组主要为亮氨酸(LEU)、精氨酸(ARG)和脯氨酸(PRO), 占总量的30.5%。
四个实验组中均检测到7种必需氨基酸(EAA):甲硫氨酸(MET)、缬氨酸(VAL)、异亮氨酸(ILE)、苯丙氨酸(PHE)、亮氨酸(LEU)、苏氨酸(THR)和赖氨酸(LYS), 四个实验组必需氨基酸含量由高到低为兼养组>光诱导组>异养组>自养组, 含量分别为134.37、128.86、100.97和85.84 mg/g。实验组EAA/TAA值均超过30%, 兼养组>自养组>光诱导组>异养组, 占比分别为37.52%、37.15%、33.77%和30.58%, EAA/NEAA分别为0.6、0.59、0.51和0.44。

表4 四种培养方式下纤细裸藻脂肪酸含量Tab. 4 Grouping of E. gracilis grown by four culture methods based on fatty acids
3 讨论
3.1 培养方式对藻细胞生长的影响
本研究发现, 纤细裸藻在异养培养后期, 细胞密度下降, 比生长速率仅为0.049/d, 李姿等[13]的研究中发现, 钝顶螺旋藻异养培养后期藻密度也存在下降趋势, 汪晶等[14]发现, 混养培养Syuechococcussp.时, 有机碳的存在会促进无机碳的利用。在异养条件下纤细裸藻细胞密度下降可能是因为没有足够的无机碳源满足其生长的需要, 也可能与共生菌在异养条件下占优势有关。
在实验后期兼养条件下纤细裸藻生长最佳,说明兼养条件下纤细裸藻更能有效地积累生物量,李昌灵等的研究[15,16]表明, 兼养条件下培养小球藻与钝顶螺旋藻也有同样的规律, 在光暗条件转换过程中, 纤细裸藻代谢方式可以快速由自养切换到异养[17]。

图3 四种培养方式下纤细裸藻脂肪酸组分百分比叠加图Fig. 3 Grouping of E. gracilis grown by four culture methods based on fatty acid percentages
3.2 培养方式对脂肪酸的影响
脂肪酸是指一端含有一个羧基的长的脂肪族碳氢链, 二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)具有很高的营养价值和医学价值。陆嘉欣[18]研究中显示, 纤细裸藻(4d)碳链组成在C11—C22,饱和脂肪酸7种, 占比最高的为饱和脂肪酸。而在本研究中, 自养组和兼养组碳链组成在C12—C22,异养组和光诱导组在C8—C22, SFA种类增多, 均有12种。在本研究中, 除异养组占比最高的是SFA,其余三个实验组占比最高的为PUFA, 其结果不一致的原因一方面可能是因为本实验中纤细裸藻未经过诱变, 另一方面可能是因为培养基的不同导致代谢产物的差异。
3.3 培养方式对氨基酸的影响
在四种培养方式下, 纤细裸藻均含有17种氨基酸, 其中必需氨基酸占总氨基酸质量分数均大于30.5%。氨基酸含量兼养条件下最高, 比生长速率在此条件下也最高, 为0.214/d。在自养和兼养条件下纤细裸藻所有氨基酸种类相同, 异养和光诱导条件下氨基酸种类相同, 可能的原因为不同培养方式下碳利用方式和途径不同导致纤细裸藻一些氨基酸代谢产生差异。
有学者曾测定石莼(Ulva lactucaL.)、麒麟藻(Eucheuma serra)、马尾藻(Scagassum)、羊栖藻(Sargassum fusiforme)、海带(Saccharina japonica)、裙带菜(Undaria pinnatifida)、紫菜(porphyra)、浒苔(Euteromorpha)和龙须菜(Gracilaria lemaneiformis)氨基酸的含量[19], 研究显示, 紫菜氨基酸的总含量最高, 为30.92 g/100 g, 除谷氨酸(Glu)外, 其他游离氨基酸含量均高于其他几种藻类。而在本实验中,四种培养方式下的纤细裸藻氨基酸含量远远高于紫菜含量, 自养组氨基酸含量最低, 达231.1 g/100 g,是紫菜氨基酸含量的7.47倍, 最高的光诱导组含量达到381.57 g/100 g, 是紫菜氨基酸含量的12.34倍。人体必需氨基酸的含量同样远高于紫菜, 是紫菜的7.50—11.74倍。

表5 四种培养方式下纤细裸藻氨基酸含量Tab. 5 Amino acid contents in E. gracilis grown by four culture methods
兼养组、自养组、光诱导组和异养组EAA/TAA值分别为37.52%、37.15%、33.77%和30.58%,EAA/NEAA分别为0.6、0.59、0.51和0.44, 除了兼养组, 其他组必需氨基酸含量与E/N值均略低于FAO/WHO(联合国粮农组织/世界卫生组织)标准规定的必需氨基酸含量40%左右和E/N值0.6[20], 这是由于实验过程中未检测色氨酸(Try)。有研究显示[21],蛋白核小球藻和椭圆小球藻的EAA/TAA值分别为38.05%和40.28%, E/N值分别为0.61和0.67, 本实验中纤细裸藻兼养组和自养组EAA/TAA值和EAA/NEAA值略低于小球藻。董黎明等研究显示, 异养培养的椭圆小球藻氨基酸组成品质更高[22], 本实验中结果相反, 异养组纤细裸藻氨基酸品质比自养组和兼养组都低。
4 结论
光诱导培养可显著提高纤细裸藻总脂肪酸、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)含量; 异养培养可显著提高纤细裸藻饱和脂肪酸含量; 兼养培养可显著提高纤细裸藻必需氨基酸含量。

