金属尾矿库生物土壤结皮的类型及物种组成
胡 瑶 彭成荣 李敦海
(1. 中国科学院水生生物研究所中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学,北京 100049)
尾矿库作为矿山的三大基础设施之一, 是用于堆存金属矿石或非金属矿石粉碎选别后所残余的有用成分含量低、当前经济技术条件下不宜进一步分选的固体废弃材料[1]。随着人类社会对矿产资源依赖程度的加剧, 一方面由于老旧矿山矿产资源耗竭而产生诸多废弃的尾矿库, 另一方面由于新矿山的开采而产生新的尾矿库, 尾矿库数量依旧处于较高水平, 据统计, 截至2015年底, 全国仍有“头顶库”1425座。金属尾矿库通常由于极高的重金属含量、极端的pH和极低的有机质含量限制了其向正常土壤的发育[2,3], 其自然恢复要经过50—100年的时间才能形成较好的植被覆盖[4]。常规的生态修复包括植物、动物和微生物修复, 该方法环保且成本低, 但金属尾矿库的极端条件限制了该环境下动植物的正常生长, 导致常规方法在金属尾矿库的早期修复中很难有效, 因此改善尾矿库环境和土壤质量以保证植被恢复是促进生态系统的快速恢复的前提[3]。
生物土壤结皮(Biological soil crusts, BSCs)是由藻类、地衣、苔藓、细菌和真菌等生物组分与其下薄层土壤结合形成的一种复杂的生物土壤复合体[5]。根据发育程度和优势种群的差异, 可将BSCs分为藻结皮、地衣结皮及苔藓结皮三个明显不同的演替阶段, 三个阶段依次从简单到复杂, 从低等到高等, 有时也会出现藻-地衣结皮、藻-藓结皮等中间型[6,7]。BSCs具有很强的环境适应性, 广泛分布于各种生境中, 尤其在一些维管束植物通常难以定植的退化生境中, BSCs的覆盖率可以高达70%,在改善极端土壤环境中具有重要作用[8]。
不同的退化生境具有不同的环境特征, 其适生的BSCs物种组成也有所不同。在干旱和半干旱地区, 通过对BSCs物种组成的解析发展出了一种行之有效的人工生物土壤结皮技术, 在我国北方荒漠化治理中发挥了重要的作用[9,10]。在尾矿库的修复中, 植被恢复被认为是减少水蚀和风蚀以及保护周围环境的传统有效手段之一[11], 金属尾矿库作为一种严重退化的污染生境, BSCs往往是最初拓殖的生物复合体。而对尾矿库现有物种的调查是筛选适生的先锋物种的必由之路。尽管一些研究尝试将生物土壤结皮应用于尾矿库的治理或修复[12,13],但这些尝试都是应用通识藻种, 并未针对尾矿库进行适生先锋物种的筛选。目前对尾矿库中的BSCs的物种组成所知甚少[14], 这限制了对BSCs在尾矿库中的生态功能的理解。因此, 本研究以两个废弃时间不同的尾矿库作为研究位点, 对其中的BSCs进行广泛的调查与分析, 采用空间代替时间的方式来表征结皮的演替年代, 以期能揭示重金属污染环境中BSCs的物种组成及其生态学意义, 为尾矿库的生态修复提供一定的数据参考。
1 材料与方法
1.1 采样点概述
本研究选取湖北省黄石市的鸡笼山金矿尾矿库(JLS; 29°49′15.1″ N, 115°24′41.4″ E)和牛头山铜矿尾矿库(NTS; 29°57′2.6″ N, 115°5′42.8″ E)两个废弃尾矿库进行调查研究, 其中JLS已废弃30余年, NTS废弃约8年。JLS尾矿库约3/5地表被草本植物覆盖, 约1/5地表被生物土壤结皮覆盖, 主要有藻-藓结皮、苔藓结皮、藻结皮, 剩余约1/5地表呈裸露状态。NTS尾矿库地表有少许草本植物零落分布, 约3/4地表被结皮覆盖, 主要为苔藓结皮、藓-藻结皮、藻结皮。
1.2 样品采集与预处理
本研究于2016年7月进行。根据每个尾矿库地表结皮类型及立地条件, 选取结皮生长较为一致且人为干扰较少的地方设置样方。根据结皮中藻类和苔藓优势度的不同, 划分为物理结皮、藻结皮、藻-藓结皮、藓-藻结皮及苔藓结皮5种样地(图1),每个样地内各选取2个2 m×2 m样方, 每个样方内采集3个重复样品。在每个样方内采集结皮层, 置于无菌的塑料培养皿内, 其中藻结皮、藻-藓结皮、物理结皮厚度约0.3 cm, 藓-藻结皮、苔藓结皮厚度约为0.7 cm。同时, 采集结皮下0—5 cm土层作为土壤层样品, 置于封口袋中。将用于微生物分析的样品装入无菌的EP管中, 立即放入冰盒中, 运回实验室后于-40 ℃冰箱保存, 用于DNA提取和后续微生物分析。土壤和结皮样品采集的同时现场测定结皮的盖度, 盖度的测定方法参考相关文献[15]。两个尾矿库中结皮的采集情况见表1。在实验室将一部分土壤样品摊开风干, 去除其中的动植物残体及石子, 研磨过筛, 用于土壤理化和重金属含量分析。

图1 尾矿库及其中分布的主要生物土壤结皮Fig. 1 The tailings pond and the biological soil crusts
1.3 土壤层与结皮层基本理化性质测定
土壤含水量(WC)采用105 ℃烘干法测定, pH用pH计测定水土比为5∶1的悬浮液, 有机质(OM)采用低温外热重铬酸钾氧化-比色法测定, 总氮(TN)采用凯氏法测定, 速效氮(AN)采用碱解扩散法测定,速效磷(AP)采用钼锑抗比色法测定, 速效钾(AK)采用火焰光度计测定, 上述指标的测定参照《土壤农业化学分析方法》[16]。总磷(TP)采用钼锑抗比色法测定, 总钾(TK)采用火焰光度计测定, 上述指标的测定参照《土壤农化分析》(第三版)[17]。

表1 尾矿库样品采集情况Tab. 1 Samples of biological soil crusts in different tailings ponds
1.4 土壤层重金属含量测定及污染评价
重金属的含量使用电感耦合等离子体-发射光谱仪(ICP-OES)进行测定。参考我国土壤环境二级标准, 采用内梅罗综合污染指数法评价标准对土壤重金属污染水平进行评价, 内梅罗综合污染指数计算公式如下[18,19]:

式中,Pm为某地区的综合污染指数;Ci为污染物i的实测含量(单位mg/kg);Si为污染物i的评价标准(单位mg/kg), 本研究中Si采用我国土壤环境二级标准; (Ci/Si)max为土壤污染物中单因子污染指数最大值; (Ci/Si)ave为土壤污染物中单因子污染指数平均值。本研究取尾矿库不同类型结皮下的土壤层的平均结果计算该尾矿库的各种理化指标、重金属含量及综合污染指数。
1.5 结皮色素含量测定
称取1.00 g风干的结皮样品, 充分研磨后加入5 mL纯丙酮, 4 ℃黑暗提取24h。于4 ℃下, 8000 r/min离心10min, 取上清, 用分光光度计测定384、490、663和750 nm处的光吸收值。按下列3个公式对叶绿素a(Chl.a)、类胡萝卜素(Car)和伪枝藻素(Scyt)吸光值进行修正[20]:
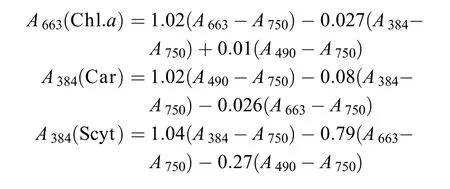
并根据叶绿素a、类胡萝卜素及伪枝藻素在丙酮中的消光系数92.5、250和112.6分别计算单位重量(干重, DW)结皮的叶绿素a、类胡萝卜素及伪枝藻素含量, 表示为μg/g DW。
1.6 结皮中蓝藻、真菌、苔藓丰度测定
使用Bio-Rad公司的荧光定量PCR扩增仪(CFX 96TMReal-Time system), 采用定量PCR (qPCR)方法检测蓝藻、真菌和苔藓的丰度, 分别采用蓝藻16S rRNA基因、真菌25-28S rRNA及苔藓叶绿体rps4基因作为遗传学标记, 其丰度来间接表示蓝藻、真菌、苔藓的生物量[21], 所用引物见表2。
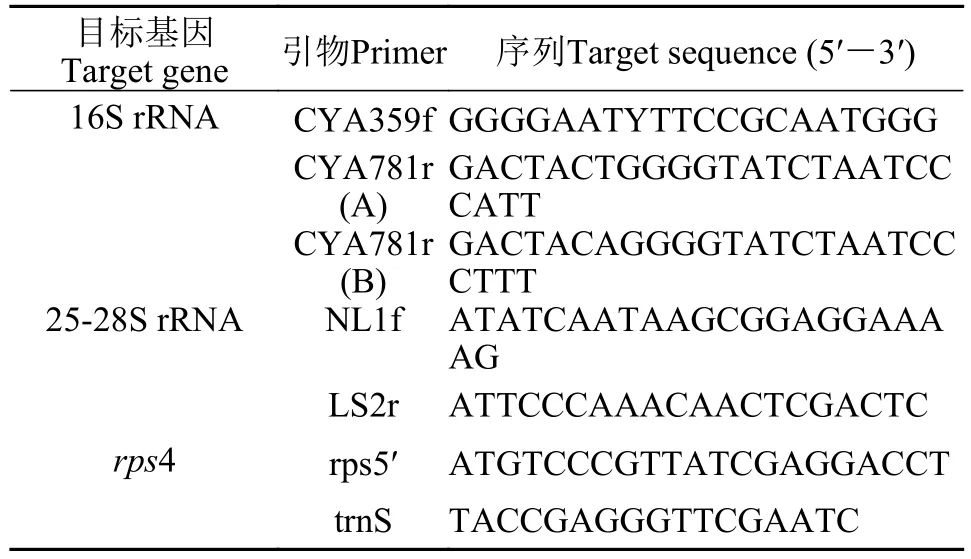
表2 蓝藻、真菌、苔藓目的基因及引物Tab. 2 Primers for cyanobacteria, fungi and moss
1.7 结皮微生物组成分析
结皮基因组DNA的提取在样品采集后2周内完成, 使用FastDNA®Spin Kit for Soil试剂盒进行提取, 采用琼脂糖凝胶电泳对提取的DNA进行完整性检测, 采用Nanodrop 2000 (Thermo, 美国)测定DNA样品浓度和纯度。然后基于HiSeq PE250平台, 利用双末端测序 (Paired-End 250)的方法, 以bar-coded 515F (5′-GTGCCAGCMGCCGTAA-3′)和bar-cod 806R(5′-GGACATCHVGGGTWTCTAAT-5′)为引物对16S rRNA基因的V4区进行扩增, 构建小片段文库进行双末端测序。对样品Reads进行拼接和过滤, OTUs(Operational Taxonomic Units)聚类和物种注释, 并进行丰度分析和多样性分析。
1.8 统计分析
结皮层指标之间采用one-way ANOVA进行方差分析, 结皮层与土壤层之间采用t检验进行分析,以上分析均在SPSS 20软件上进行。使用Qiime软件 (Version 1.7.0)计算微生物的物种数 (Observed species)、Chao1指数、ACE指数、Shannon多样性指数、Simpson多样性指数, 使用R语言进行Alpha多样性指数组间差异分析; Alpha多样性指数组间差异分别进行有参数检验和非参数检验, 选用T-test和wilcox检验。
2 结果
2.1 尾矿库土壤理化性质测定及重金属污染评价
JLS和NTS尾矿库的土壤基本理化性质见表3。两个尾矿库土壤呈弱碱性, 且JLS土壤pH显著低于NTS(P<0.05), 而JLS土壤的OM、TN、AK显著高于NTS(P<0.05)。根据全国土壤普查办公室对土壤养分的分级[22], JLS和NTS尾矿库中的大部分养分含量均为Ⅵ级, 因此两个尾矿库土壤均十分贫瘠。两个尾矿库的主要重金属含量见表4。结果显示两个尾矿库土壤中都是Cu的含量最高, 其次是Zn, 而Cd的含量最低, 且土壤中不同重金属含量差异较大。从内梅罗综合污染指数来看(表4), JLS尾矿库属于重度污染水平, 而NTS尾矿库属于轻度污染水平, 但仍然超过了警戒线水平。
2.2 不同演替阶段生物土壤结皮的生物量及蓝藻、真菌、苔藓丰度
分别对结皮层和土壤层中叶绿素a、类胡萝卜素和伪枝藻素含量进行测定, 叶绿素a含量来表示结皮的主要光合生物量(图2)。JLS和NTS尾矿库的结皮下层土壤中的叶绿素a、类胡萝卜素和伪枝藻素含量均接近于零, 可见土壤中的光合生物主要分布于结皮层, 特别是生物土壤结皮(BSCs)阶段的结皮层。物理结皮(PC)阶段时, 结皮层的三种色素含量均表现为最低, 且显著低于生物土壤结皮阶段, 但此时JLS的三种色素含量显著高于土壤层, 而NTS无显著差异。在JLS尾矿库中, 随着结皮从A、AM到M的演替, 结皮层叶绿素a呈逐渐增加趋势, 类胡萝卜素含量呈下降趋势, 伪枝藻素含量无显著变化。在NTS尾矿库中, 从A、AM到M2的演替过程中, 结皮层的叶绿素a与类胡萝卜素含量呈逐渐增加趋势, 伪枝藻素含量呈先增加后降低趋势。M1阶段是苔藓结皮发育的早期阶段,其结皮层的三种色素含量均处于A阶段和AM阶段之间, 且结皮层三种色素含量均显著低于发育后期的M2阶段。
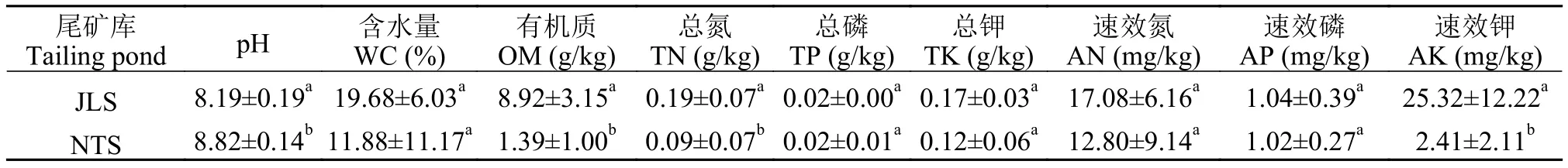
表3 JLS和NTS尾矿库土壤的理化指标Tab. 3 Physical and chemical parameters of soils from the two tailings ponds

表4 JLS和NTS尾矿库土壤的重金属含量及重金属污染评价Tab. 4 Heavy metal contents of soils and Nemerow multi-factor index in the two tailings ponds
对蓝藻16S rRNA基因、真菌25—28S rRNA基因及苔藓叶绿体rps4基因进行绝对定量qPCR, 用其丰度来表示结皮中蓝藻、真菌、苔藓的绝对丰度,测定结果如图3所示。BSCs中蓝藻、真菌和苔藓的绝对丰度分别为(0.63—2.01)×108、(0.19—1.53)×108和(0.08—3.34)×107copies/g DW soil; 物理结皮(PC)中蓝藻、真菌和苔藓的绝对丰度分别为(0.54—4.05)×107、(0.43—4.26)×106和(2.76—8.37)×105copies/g DW soil。不同废弃年代尾矿库中随着结皮的发育演替, 其蓝藻、真菌、苔藓丰度变化趋势有所差异。在JLS和NTS中, PC的蓝藻、真菌和苔藓绝对丰度均显著低于BSCs。同时在JLS中, 随着结皮的发育演替, 其蓝藻、真菌、苔藓的绝对丰度均呈增加趋势。在NTS中, 蓝藻绝对丰度随着发育演替逐渐降低; 真菌绝对丰度在M2阶段最高,M1阶段最低。M1和M2阶段具有不同的物种组成,M1阶段具有较高的苔藓丰度, 但是其蓝藻和真菌绝对丰度远低于A和AM, 表明M1处于结皮发育的早期阶段。结合M1阶段的三种色素含量显著低于M2的现象(图2), 推测M1不经过藻结皮阶段, 而是苔藓直接在土壤拓殖而形成苔藓结皮, 故结皮中蓝藻丰度较低。而M2阶段蓝藻、真菌和苔藓的绝对丰度都处于较高水平, 表明其处于结皮发育的晚期阶段。
将蓝藻、真菌、苔藓绝对丰度之和视为结皮总生物量, 对结皮中蓝藻、真菌、苔藓丰度比进行计算(图4)。PC阶段蓝藻占结皮整体生物量(蓝藻、真菌、苔藓绝对丰度之和)的比例高达86%—89%, 而BSCs阶段蓝藻比例较低, 为35%—76%。JLS和NTS中随着结皮的演替, 结皮中蓝藻、真菌、苔藓丰度比例呈现相似的规律, 即随着结皮从物理结皮到苔藓结皮的演替, 结皮中蓝藻比例呈逐渐下降趋势, 真菌和苔藓比例呈逐渐上升趋势。
2.3 不同演替阶段生物土壤结皮的微生物群落结构
JLS和NTS尾矿库之间的微生物物种数、物种丰富度指数ACE和chao1均不存在显著性的差异(图5)。wilcox检验表明JLS的Shannon和Simpson多样性指数显著高于NTS(图5,P<0.05)。利用Amova分析进行组间群落结构差异检验, 结果表明JLS和NTS尾矿库之间微生物群落结构存在显著差异(P=0.005)。
分别对JLS和NTS尾矿库中不同演替阶段结皮在门水平上的微生物组成进行分析, 发现变形菌门、蓝藻门、放线菌门、拟杆菌门、绿弯菌门、疣微菌门、酸杆菌门、浮霉菌门、芽孢单菌门、热微菌门为结皮微生物的主要组成部分, 其相对丰度总和达到90%以上(图6)。其中变形菌门相对丰度最高, 达到32.5%—49.8%。JLS中PC阶段蓝藻门相对丰度高于三种生物土壤结皮阶段。随着结皮的发育演替, 变形菌门和蓝藻门相对丰度呈下降趋势, 其他微生物的相对丰度呈上升趋势, 说明随着结皮的演替其微生物的物种组成向多元化方向发展。放线菌门和芽孢单菌门相对丰度在A阶段最高, 随着结皮从A、AM到M阶段演替, 两者相对丰度呈降低趋势, 而绿弯菌门和浮霉菌门相对丰度呈上升趋势。拟杆菌门相对丰度随结皮演替变化不大。在NTS中, 随着结皮从PC、A到AM阶段演替,变形菌门和芽孢单菌门相对丰度逐渐降低, 疣微菌门和浮霉菌门相对丰度逐渐升高, 到M1和M2阶段变形菌门相对丰度有所上升, 疣微菌门和浮霉菌门相对丰度有所下降。与JLS不同, NTS中A阶段蓝藻门相对丰度最高, AM阶段蓝藻门相对丰度最低。M1与M2相比, 变形菌门、拟杆菌门相对丰度较高,而蓝藻门、绿弯菌门相对丰度较低。

图2 JLS和NTS尾矿库中结皮层与土壤层的色素含量Fig. 2 The contents of pigments in the soil crust layers and their underlying soil layers of the two tailings ponds
3 讨论
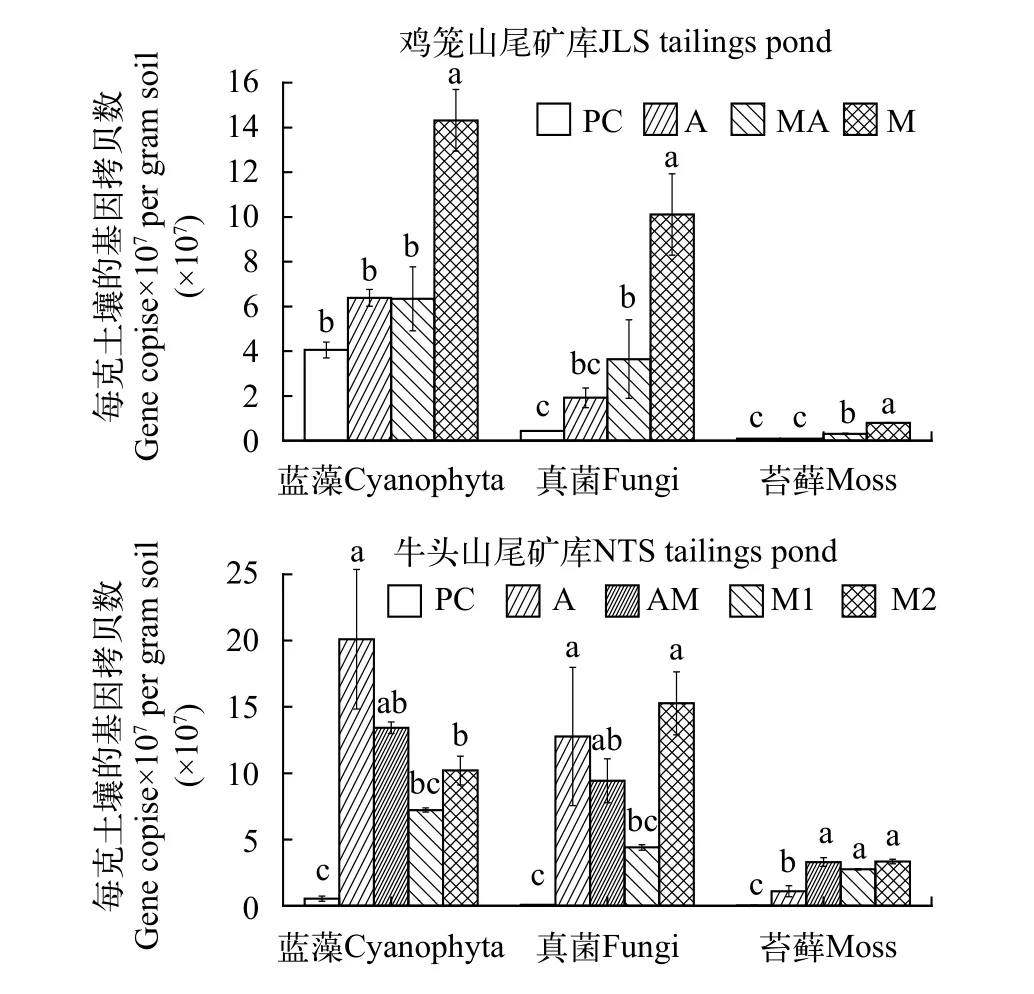
图3 结皮中蓝藻16S rRNA基因、真菌25—28S rRNA基因及苔藓叶绿体rps4基因绝对丰度(小写字母用于表示样品间的差异性, P<0.05)Fig. 3 Gene copies of cyanobacterial 16S rRNA, fungal 25—28S rRNA and moss chloroplast rps4 in crusts, significant differences between samples are marked with lowercase letters (P<0.05)

图4 结皮中苔藓rps4基因、真菌25—28S rRNA基因及蓝藻16S rRNA基因丰度的百分比Fig. 4 The percentage of total gene copies present as gene copies of moss chloroplast rps4, fungal25—28S rRNA and cyanobacterial 16S rRNA
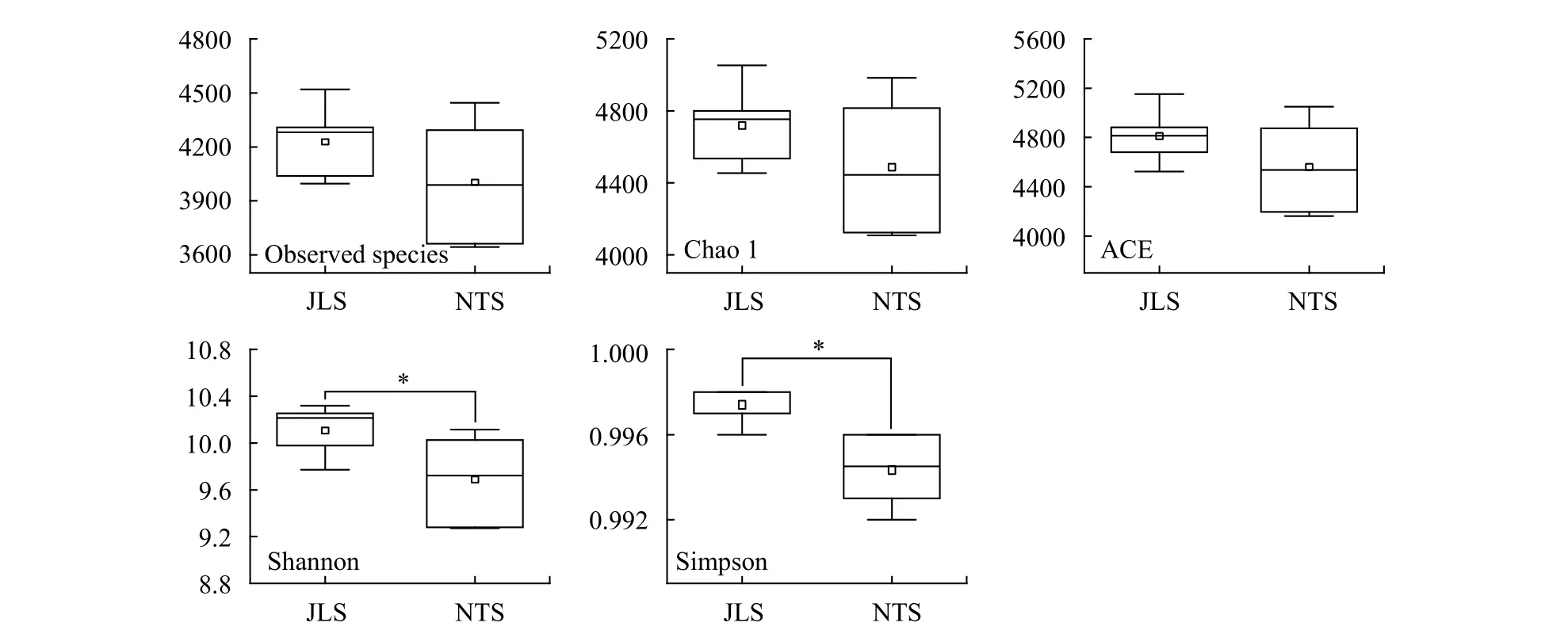
图5 尾矿库水平微生物的物种数、chao1指数、ACE指数、Shannon指数和Simpson指数Fig. 5 Observed species, chao1 index, ACE index, Shannon index and Simpson index between the two tailings ponds
尾矿通常来源于很深的地层, 因此有机质的含量十分稀少。JLS和TLS尾矿库地理位置接近, 且无明显的人类活动干扰, 但土壤的pH和OM、TN、AK等营养指标显著的不同(表3), 这可能是由于生物土壤结皮的自然发育和演替所导致的。尾矿库有机质和营养成分的增加有助于加速向正常土壤的发育[23,24]。以还原性硫化矿物为主的金属尾矿库在经过开采、提取、选矿后, 往往产生大量高浓度的酸性废水, 直接排放会严重污染尾矿库周围环境, 因此常在废水排出前使用碱性中和剂使排出的废水达到基本的排放标准, 所以本研究中发现的尾矿库pH相对较高, 在一定程度上减少了酸性废水的直接污染[25—27]。土壤有机质被普遍认为是保持土壤肥力, 保护土壤免受污染、退化、侵蚀和荒漠化侵害的最重要因素之一, 在半干旱地区尤为重要[2,28]。尽管JLS和NTS尾矿库土壤分别属于重度污染和轻度污染水平, 高等植物难以生存, 但各种类型的生物土壤结皮仍然能在其中生长(图1), 这表明生物土壤结皮能够适应尾矿库这一极端退化环境。随着结皮在尾矿库中的发育与演替, 结皮生物量逐渐的增加(图2), 这与干旱和半干旱地区的研究结果类似[10,29], 但下层土壤所受到的影响较小, 这可能是由于尾矿库土壤结构紧密不利于水分渗透导致的。在废弃时间较久的JLS尾矿库, 对各个类型结皮的基因拷贝数来说蓝藻>真菌>苔藓(图3), 但是随着结皮的逐渐演替, 整体生物量上升的同时, 蓝藻基因丰度所占的比例逐渐减少, 而苔藓与真菌的丰度逐渐增加(图4)。沙漠地区的研究结果也表明随着结皮逐渐发育, BSCs中蓝藻和真菌相对生物量呈下降趋势, 苔藓相对生物量呈上升趋势[21]。而对于废弃时间较短的NTS尾矿库来说, 这一规律同样存在(图3和图4)。而在重金属条件下, 也有研究表明高浓度Cu、Zn、Fe浓度和低营养含量可以抑制土壤藻类的生长, 尾矿中的土壤藻类的种类和丰度随着早期演替过程而增加, 但苔藓和维管植物的出现却抑制了土壤藻类的生长[30]。虽有差异, 这些研究均表明苔藓的出现会在一定程度上抑制藻类的生长, 且在演替后期苔藓是结皮中主要的光合生物[31]。
微生物广泛存在于结皮发育的各个阶段, 对土壤物质循环和能量流动起到重要作用。Janssen[32]在对来自多种类型土壤的32个克隆文库的调查中发现, 土壤细菌至少包含32个门, 健康的土壤中的优势微生物群落有变形菌门、酸杆菌门、放线菌、疣微菌门、拟杆菌、绿弯菌门、浮霉菌门、芽单胞菌门和厚壁菌门, 这9个门的成员平均占土壤微生物克隆文库总丰度的92%。本研究采用高通量测序对结皮的微生物组成进行测定, 共得到了41门的物种, 其中变形菌门、蓝藻门、放线菌门、拟杆菌门、绿弯菌门、疣微菌门、酸杆菌门、浮霉菌门、芽单胞菌门及热微菌门是主要组分, 它们在四个尾矿库的结皮中累计丰度达到90%以上, 说明结皮与土壤中微生物类群存在一定同源性。但是两者优势类群丰度存在一定差异, 本研究中结皮的优势类群为变形菌门和蓝藻门, 两者在结皮中的平均相对丰度分别为43%和11%, 放线菌门和酸杆菌门相对丰度较低, 在结皮中的平均相对丰度分别为9%和7%。而在健康土壤中, 变形菌门平均占土壤总细菌群落的39%, 酸杆菌门平均占20%, 放线菌门占13%[32]。可以看出在结皮和土壤中变形菌门均占据绝对优势, 蓝藻门取代了酸杆菌门优势地位,成为结皮中第二大细菌组分。同样有研究者发现铜陵铜尾矿库废弃地结皮的微生物群落中主要类群为变形菌门、蓝藻门、拟杆菌门和酸杆菌门, 其中蓝藻门在群落中相对丰度也较高, 与本研究的结果较为一致[33]。蓝藻具有较强的环境适应性, 是生物土壤结皮得以拓殖和演替的基础, 广泛存在于各个发育阶段的生物土壤结皮中。另外沙漠地区的生物土壤结皮微生物群落结构表现与尾矿库结皮相似, 而沙漠结皮下流沙层的微生物群落结构则偏向于健康土壤, 这都说明了蓝藻门在结皮的微生物群落结构中不可替代的地位[34]。藻类除了是生物土壤结皮的主要固氮生物和光合生物外, 藻丝体和分泌的胞外多糖的黏结作用也是固定土壤表皮, 增强土壤抵抗风水侵蚀能力的重要因素[35]。微生物Shannon和Simpson多样性指数表现出与演替年代显著的正相关(图5), 表明结皮中微生物群落结构受到结皮发育年代和结皮演替阶段的影响。

图6 结皮中门水平Top10微生物的相对丰度Fig. 6 Relative abundance of the Top10 microorganisms at phylum level in crusts
4 结论
(1) 生物土壤结皮可在金属尾矿库中广泛分布,同时可以起到增加尾矿库土壤养分的作用, 随着结皮的发育演替表层土壤的有机质、总氮和速效钾含量均有所增加。(2) 高通量测定与分析表明结皮的微生物群落组成丰富, Top10的微生物在不同结皮中的累计丰度达均到90%以上。随着结皮的演替, 其微生物多样性有所增加。(3) 金属尾矿库中的生物土壤结皮物种组成及其变化规律与荒漠化地区类似, 且蓝藻在其中具有不可替代的作用。
致谢:
感谢中国科学院水生生物研究所张云博士和郑娇莉博士在样品采集和数据分析中给予的大力支持。

