三七总皂苷对慢性心力衰竭大鼠心功能的改善作用及其机制
高瑞敏,康玲玲
(河北医科大学附属唐山工人医院重症医学科,河北 唐山 063000)
慢性心力衰竭(chronic heart failure, CHF)是各种心血管疾病的终末阶段,是一种复杂性、系统性的临床综合征,具有容易复发和预后差的特点[1]。目前,临床上对CHF的治疗主要采用血管紧张素Ⅱ受体拮抗剂、血管紧张素转化酶抑制剂、醛固酮拮抗剂和β-受体阻滞剂等,但不能从根本上解决其发病率高和死亡率高的状况[2-3]。近年来,中药在防治CHF方面展现出安全、高效和不良反应少的优势。三七总皂苷是中药三七的主要成分之一,具有改善心肌缺血再灌注损伤、增加血液循环和改善血流供应的作用[4-5]。丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号通路主要包括细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)、c-Jun氨基末端激酶(c-Jun NH2-terminal protein kinase, JNK)和p38激酶3个亚族,对心肌保护发挥重要作用[6]。目前国内关于三七总皂苷应用于CHF治疗效果的研究[7-8]表明:三七总皂苷能有效改善CHF患者心功能,降低细胞凋亡相关因子水平,但对其作用机制研究甚少。本研究旨在观察三七总皂苷对CHF模型大鼠心脏功能的影响,探讨其作用机制,为临床治疗CHF提供新思路。
1 材料与方法
1.1 动物、主要试剂和仪器SPD级SD大鼠75只,体质量(220±20) g,购自河北省以岭医药研究院有限公司,动物使用许可证号:SYXK(冀)2015-0064。自由饮水摄食,环境温度(22±3)℃,相对湿度(50±5) %,12 h/12 h昼夜周期照明。卡托普利片购自中美上海施贵宝制药有限公司(国药准字H31022986),TUNEL细胞凋亡检测试剂盒购自美国罗氏公司,二奎啉甲酸(BCA)法蛋白定量试剂盒购自北京泰格美科技有限公司,ERK、p-ERK、JNK、p-JNK、p38和p-p38抗体购自美国 Cell Signaling Technology 公司,肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白细胞介素6(interleukin 6,IL-6)ELISA试剂盒购自武汉博士德生物工程有限公司。色多普勒超声诊断仪(型号Vivid i,美国GE公司),光学显微镜(型号Eclipse 50i,日本Nikon公司),电泳仪 (型号GP200,托摩根生物科技有限公司),酶标仪(型号Multiskan FC,美国赛默飞世尔公司)。
1.2 模型制备和分组[9]大鼠于造模前采用多普勒超声检查心脏,取心功能正常大鼠腹腔注射10%水合氯醛(0.3 mL·100 g-1)麻醉,于左上腹切开上皮,暴露腹并结扎腹主动脉,使腹主动脉管腔形成50%环形缩窄,缝合切口,术后每天肌肉注射40万U青霉素,连续3 d。造模4周后,进行心脏彩超检测,以左室射血分数(left ventricular ejection fraction, LVEF)<45% 视为CHF大鼠模型制备成功。排除死亡大鼠后,共60只大鼠造模成功,将60只造模成功大鼠随机分为模型组、阳性对照组、低、中和高剂量三七总皂苷组,每组12只。另取12只大鼠作为假手术组。阳性对照组大鼠灌胃给予卡托普利(100 mg·kg-1)[10];低、中和高剂量三七总皂苷组大鼠分别灌胃给予三七总皂苷(10、30和60 mg·kg-1)[11]; 假手术组和模型组大鼠分别灌胃给予等量生理盐水,连续给药8周,假手术组大鼠开腹后不结扎腹主动脉。观察各组大鼠一般情况。
1.3 彩色多普勒超声仪检测各组大鼠心脏功能指标末次给药后,麻醉大鼠,仰卧固定于鼠板,采用彩色多普勒超声仪检测各组大鼠左室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)、左室收缩末期内径(left ventricular end-systolic diameter, LVESD)、左室后壁舒张期厚度(left ventricular posterior wall diastolic thickness, LVPWD)和LVEF,连续检测3个心脏周期求得平均值。随后行右颈总动脉插管,将导管从右颈总动脉插入,逆向进入左心室,末端连接血压换能器,测定心输出量(cardiacoutput, CO)、左室舒张压(left ventricular diastolic pressure, LVEDP)、左室收缩压(left ventricular systolic pressuer, LVSP)、左心室压力最大上升速率(maximal rate of increase of left ventricular pressure, +dp/dt max)/左心室压力最大下降速率(maximal rate of decrease of left ventricular pressure, -dp/dt max),连续检测3次取平均值。
1.4 HE染色观察各组大鼠心肌组织病理形态表现取出固定心肌组织,常规制备石蜡切片(5 μm) ,经烘烤、二甲苯脱蜡和梯度乙醇脱水后,HE染色,树脂封片后,置于光学显微镜下观察心肌组织病理形态表现。
1.5 TUNEL法检测各组大鼠心肌细胞凋亡率将切片常规脱蜡水化,3%过氧化氢封闭10 min,加入蛋白酶37℃孵育20 min,山羊血清封闭20 min,加入50 μL TUNEL反应液,37℃孵育60 min,磷酸盐缓冲液(PBS)清洗3次。加入5%辣根过氧化酶47℃孵育30 min,PBS清洗3次,二氨基联苯按(DAB)显色,苏木素复染,封片,显微镜下观察,随机取5个视野记录阳性细胞数和总细胞数,计算细胞凋亡率,细胞凋亡率=阳性细胞数/总细胞数×100%。
1.6 Western blotting法检测各组大鼠心肌组织中ERK、p-ERK、JNK、p-JNK、p38和p-p38蛋白表达水平取各组大鼠心肌组织,加入600 μL RIPA裂解液,12 000 r·min-1、4 ℃离心10 min,提取组织总蛋白,10% SDS-PAGE分离等量蛋白后进行转膜反应,5% 脱脂奶粉封闭,添加抗ERK、p-ERK、JNK、p-JNK、p38、p-p38和 β-actin抗体(1∶500),4 ℃ 过夜孵育,加入二抗(1∶5 000),室温摇床孵育 1 h,采用ECL发光显影后置于凝胶成像仪内观察各蛋白表达,采用Image J软件对各蛋白条带进行量化分析。以β-actin作为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 酶联免疫吸附法检测各组大鼠血清TNF-α和IL-6水平取大鼠腹主动脉血,室温下放置15 min后,2 500 r·min-1离心10 min,分离血清,按照试剂盒说明书采用酶联免疫吸附法检测各组大鼠血清TNF-α和IL-6水平。
2 结 果
2.1 各组大鼠一般情况造模结束后,模型组大鼠死亡2只,死亡原因为CHF发作,假手术组、阳性对照组和低、中及高剂量三七总皂苷组大鼠未出现死亡。
2.2 各组大鼠心脏功能指标与假手术组比较,模型组大鼠LVEDD、LVESD、LVPWD、LVEDP和-dp/dt max明显升高(P<0.05),LVEF、CO、LVSP和+dp/dt max明显降低(P<0.05);与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠LVEDD、LVESD、LVPWD、LVEDP和-dp/dt max明显降低(P<0.05),LVEF、CO、LVSP和+dp/dt max明显升高(P<0.05)。见表1。
表1 各组大鼠心脏功能指标

*P<0.05 compared with sham operation group;△P<0.05 compared with model group.
2.3 各组大鼠心肌组织形态表现假手术组大鼠心肌组织结构清晰,肌纤维排列整齐,细胞核大小一致。模型组大鼠心肌组织结构模糊,心肌细胞肥大,肌纤维排列紊乱,出现肌丝溶解、断裂,细胞核出现核碎裂、核溶解,可见大量炎性细胞浸润。与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠心肌组织结构较完整,心肌细胞肥大减轻,心肌纤维排列较疏松,肌丝部分断裂,可见部分炎性细胞浸润。见图1(插页七)。
2.4 各组大鼠心肌细胞凋亡率假手术组未见阳性心肌细胞,模型组可见大量阳性心肌细胞。与假手术组比较,模型组大鼠心肌细胞凋亡率明显升高(P<0.05);与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠心肌细胞凋亡率明显降低(P<0.05)。见图2(插页八)。
2.5 各组大鼠心肌组织中ERK、p-ERK、JNK、p-JNK、p38和p-p38蛋白表达水平与假手术组比较,模型组大鼠心肌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显升高(P<0.05);与模型组比较,阳性对照组和低、中及高剂量组大鼠胃癌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显降低(P<0.05)。各组大鼠胃癌组织中ERK、JNK和p-38蛋白表达水平比较无明显差异。见表2和图3。
2.6 各组大鼠血清TNF-α和IL-6水平与假手术组比较,模型组大鼠血清TNF-α和 IL-6水平明显升高(P<0.05);与模型组比较,阳性对照组、低、中及高剂三七总皂苷量组大鼠血清TNF-α和IL-6水平明显降低(P<0.05)。见表3。
表2 各组大鼠心肌组织中p-ERK p-JNK和p-p38蛋白表达水平

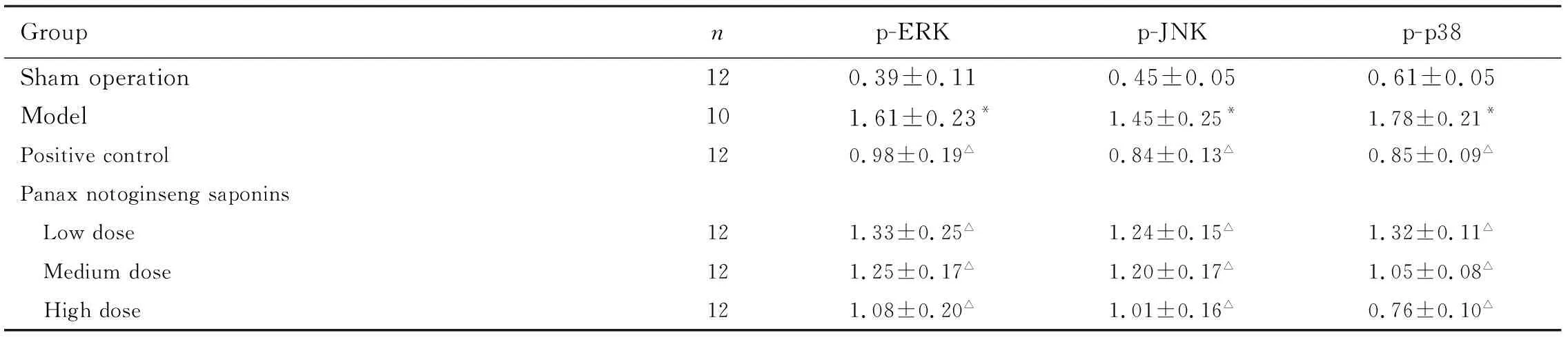
Groupnp-ERKp-JNKp-p38Sham operation120.39±0.110.45±0.050.61±0.05Model101.61±0.23*1.45±0.25*1.78±0.21*Positive control120.98±0.19△0.84±0.13△0.85±0.09△Panax notoginseng saponins Low dose121.33±0.25△1.24±0.15△1.32±0.11△ Medium dose121.25±0.17△1.20±0.17△1.05±0.08△ High dose121.08±0.20△1.01±0.16△0.76±0.10△
*P<0.05 compared with sham operation group;△P<0.05 compared with model group.

Lane 1:Sham operation group;Lane 2: Model group; Lane 3-5: Low, medium and high doses of panax notoginseng saponins groups;Lane 6: Positive control group.
图3 各组大鼠心肌组织中ERK、p-ERK、JNK、p-JNK、p38、p-p38蛋白表达电泳图
Fig.3 Electrophoregram of expressions of ERK, p-ERK, JNK, p-JNK, p38, and p-p38 proteins in myocardium tissue of rats in various groups
表3 各组大鼠血清TNF-α和IL-6水平

*P<0.05 compared with sham operation group;△P<0.05 compared with model group.
3 讨 论
引起CHF发生的基本机制是心肌重塑,而心肌细胞凋亡是CHF从代偿走向失代偿的转折点。研究[12]表明:MAPKs信号通路激活是心肌细胞肥大和由收缩型向合成型演变的最后通路,参与心肌重构的过程。此外,参与心肌重塑的因素还有TNF-α、IL-1β和IL-6等细胞炎性因子[13]。MAPKs是细胞中的一类丝氨酸/苏氨酸蛋白激酶,存在于大多数细胞内,其作用是将细胞外刺激信号转导至细胞及其核内,从而引起细胞增殖、分化、转化和凋亡等反应[14]。MAPKs是心肌细胞增殖、分化、凋亡、坏死、细胞骨架重组和间质纤维化等多条通路的汇聚点[15]。ERK1/2、JNK和p38为MAPKs信号转导通路中最重要的3条亚通路。其中ERKl/2信号通路是经典MAPKs信号转导途径,参与细胞的生长、发育、增殖和分化等多种病理生理过程,是多种促增殖信号转导途径的共同通路。发生CHF时,在压力负荷增加的情况下,心脏牵张刺激、生长因子等与特异G蛋白偶联受体结合,激活蛋白激酶C,启动Ras-Raf-MEK-ERK途径,激活ERK1/2及其介导的信号通路,参与CHF的发展[16]。JNK信号传导通路参与介导心功能不全期代偿性心肌肥厚,在心力衰竭期具有抗心肌细胞调亡作用[17]。p38途径被认为是与细胞增殖、分化或凋亡调控密切相关的细胞信号转导途径,是细胞外信号引起细胞增殖、分化等核反应的共同途径或汇聚点。研究[18]显示:p38信号转导通路被激活可能导致细胞在发生肥大过程后出现凋亡,在心力衰竭期具有促进心肌细胞凋亡作用。本研究结果显示:与假手术组比较,模型组大鼠心肌细胞肥大、坏死,心肌纤维排列不规则,可见大量炎性细胞浸润,出现大量心肌细胞凋亡,表现为细胞质致密化、收缩变小,细胞片段化形成细胞凋亡体,心肌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显增加;与模型组比较,阳性对照组和低、中及高剂量三七总皂苷组大鼠心肌细胞凋亡数明显减少,心肌细胞凋亡率明显降低,心肌组织中p-ERK、p-JNK和p-p38蛋白表达水平明显降低,以高剂量三七总皂苷组效果更明显,上述结果说明磷酸化是ERK、JNK和p38在心肌细胞内的蛋白后修饰方式,p-ERK、p-JNK及p-p38是参与相关生物学活动的重要形式,三七总皂苷可对ERK、JNK和p38的磷酸化产生抑制作用。
TNF-α是由激活的单核-巨噬细胞分泌的细胞因子,在机体免疫反应和炎症反应中作为重要递质,抑制心肌收缩力,导致左心室功能降低,产生急性水肿,血清TNF-α水平可作为判断心功能级别的一个重要指标[19]。TNF-α可促进IL-6表达,这些细胞因子通过增强组织细胞对TNF-α的敏感性,使TNF-α的负性肌力作用进一步加强[20]。IL-6作为一种多功能的细胞因子,主要有免疫调节、刺激造血和应激反应等作用[21]。钱留军[22]的研究表明:CHF患者血清中IL-6水平随病情加重而升高。本研究结果表明:三七总皂苷对CHF大鼠血清炎性细胞因子TNF-α和血清IL-6具有明显的抑制作用,以高剂量三七总皂苷的抑制效果最为显著。
综上所述,三七总皂苷可能通过下调CHF模型大鼠心肌组织中ERK、JNK和p38蛋白磷酸化,抑制血清炎性因子分泌,发挥抑制心肌细胞凋亡的作用。

