RHBDF2基因过表达慢病毒载体的构建和稳定表达RHBDF2细胞系的建立
陈少凤,李胜男,邓 福,朱佩仪,李 友
(1.广东省衰老相关心脑疾病重点实验室,广东 湛江 524002;2.广东医科大学附属医院神经病学研究所,广东 湛江 524002)
非活性菱形蛋白酶(inactive rhomboids,iRhoms)最早在果蝇中被发现[1],是表皮生长因子受体(epidermal growth factor receptor,EGFR)信号传导途径的主要激活因子[2]。哺乳动物主要表达2种菱形蛋白酶[3]:iRhom1和iRhom2。iRhom2也称为RHBDF2,是菱形丝氨酸蛋白酶家族成员之一,但缺乏蛋白水解活性,其编码基因定位于1号染色体长臂(17q25.1),编码856个氨基酸。
研究[4]显示:RHBDF2能控制肿瘤坏死因子α转化酶(tumor necrosis factor-α-converting enzyme,TACE)激活和运输,RHBDF2可以结合TACE并促进其从内质网转运到高尔基体,然后转运到细胞表面。TACE亦称为去整合素-金属蛋白酶17(ADAM metallopeptidase domain 17,ADAM17),是一种多结构域跨膜蛋白分子,能将无活性TNF-α前体(pro-TNF-α)转化成可溶、有活性的可溶性TNF-α(sTNF-α)[5]。TACE底物分子众多,可通过活化TNF-α[6]、肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)、白细胞介素6R(interleukin-6R,IL-6R)、白细胞介素1R(interleukin-1R,IL-1R)、L-选择素(L-selectin)、C-X3-C基序趋化因子配体1(C-X3-C motif chemokine ligand 1,CX3CL1)[7]、细胞间黏附分子1(intercellular adhesion molecule 1,ICAM1)、血管内皮细胞钙黏蛋白(Cadherin in vascular endothelial cells,VE-Cadherin)、内皮细胞黏附分子1(endothelial cell adhesion molecule 1,ECAM-1)、血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecules,PECAM)和连接黏附分子A(junction adhesion molecule A,JAM-A)[8]等广泛表达于脉管系统细胞表面的底物蛋白分子而参与动脉粥样硬化(atherosclerosis,AS)这一血管炎症反应。在载脂蛋白E缺乏(apolipoprotein E deficiency,ApoE-/-)的AS模型大鼠中可见ADAM17高表达于AS斑块表面,且血液中sTNF-α和可溶性TNFR(sTNFR)水平随AS的进展而升高[9]。急性心肌梗死患者的冠状AS斑块表面可见TACE表达水平升高,且TACE表达水平与血液游离TNF-α水平呈正相关关系;自颈动脉和主动脉斑块表面分离的巨噬细胞表面亦可见TACE呈高水平表达[10]。
研究[11]表明:RHBDF2在氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)刺激的巨噬细胞中表达明显升高,抑制RHBDF2表达可减轻ox-LDL诱导的巨噬细胞炎症反应。由此本文作者推测:RHBDF2也可能通过调节TACE转运,促进TNF-α释放而参与AS的进程,因而可能成为预防和治疗AS的潜在靶点。本研究通过构建RHBDF2基因的过表达载体并包装成慢病毒,感染人脐静脉细胞融合细胞(EA.hy926细胞),建立稳定表达RHBDF2的细胞,为进一步研究RHBDF2在AS中的功能作用奠定基础。
1 材料与方法
1.1 细胞、质粒、主要试剂和仪器人胚胎肾HEK293T细胞购于中国科学院上海细胞所,EA.hy926细胞购自美国ATCC公司。慢病毒载体质粒pLV[Exp]-EGFP:T2A:Puro购自广州赛业公司,辅助包装质粒psPAX2(pHelper1)和pMD2G(pHelper2)购自上海复百澳公司,其中pLV[Exp]-EGFP能表达绿色荧光蛋白(green fluorescence protein,GFP)。大肠杆菌DH5α感受态(北京索莱宝公司),NcoⅠ酶和T4 DNA连接酶(美国NEB公司),10×Annealing Buffer(美国OriGene公司),质粒抽提试剂盒和胶回收试剂盒(北京TIANGEN公司)。DMEM高糖培养基、Opti-MEM培养基、0.05%胰蛋白酶、胎牛血清(fetal bovine serum,FBS)、反转录试剂盒和BCA蛋白定量试剂盒(美国Thermo Scientific公司),Lipofectamine 2000和TRIzol试剂盒(美国Invitrogen公司),2×增强型实时荧光定量PCR预混液(中国GenStar公司)。RHBDF2和GAPDH的PCR引物[生工生物工程(上海)股份有限公司],Anti-iRhom2抗体(英国Biorbyt公司),Anti-β-actin抗体(美国Sigma公司),鼠二抗和兔二抗(美国CST公司)。荧光定量PCR仪(瑞士Roche公司),倒置光学显微镜和倒置荧光显微镜(日本Olympus公司),化学发光检测仪(美国Azure公司)。
1.2 细胞培养HEK293T细胞和EA.hy926细胞常规培养于DMEM完全培养基(含10% FBS和1% 青霉素-链霉素),置于37℃、含5% CO2培养箱中培养,待细胞密度大于90%且生长状态良好时用0.05%胰蛋白酶消化传代,每隔2~3 d传代1次。
1.3 引物设计和合成在NCBI上查找目的基因RHBDF2(Gene ID:217344)序列,结合慢病毒过表达载体pLV [Exp]-EGFP阅读框克隆位点,根据引物设计原则,设计并合成1对两端包含attB序列的引物。RHBDF2上游引物为5′-CCAGATCTATGGCCTCAGCTGACAAGAATG-3′,下游引物为5′-CCCAAGCTTTTAGTGTAGCACCTGGTCTAG-3′。引物由生工生物工程(上海)股份有限公司合成。
1.4 pLV[Exp]-EGFP-RHBDF2重组质粒的构建和鉴定将合成1对两端包含attB序列的目的基因引物通过PCR扩增后得到DNA片段,PCR反应体系(20 μL):DNA模板1 μL,上游引物(5 μmol·L-1)2 μL,下游引物(5 μmol·L-1) 2 μL,dNTP(2.5 mmol·L-1)2 μL,10×缓冲液2 μL,Taq酶0.15 μL,加入ddH2O至20 μL。PCR反应程序:95℃变性3 min;35个循环(95℃、1 min,55℃、1 min,72℃、1 min);72℃继续延伸5 min,4℃保存。扩增得到的DNA片段(含attB位点)和包含attP位点的供载体(pDONR Vector)在BP酶的作用下,发生BP反应得到入门克隆(Entry Clone),通过菌落PCR,测序筛选出正确的Entry Clone;然后将测序正确的Entry Clone质粒DNA(含attL位点)与目的载体(含attR位点)进行LR重组反应,同时将启动子EF1A和目标基因RHBDF2连接入受体载体(pLV[Exp]-EGFP),得到插入了启动子和目标序列的表达克隆,即重组慢病毒质粒pLV[Exp]-EGFP-RHBDF2;酶切产物经回收纯化后在T4 DNA连接酶作用下于16℃连接过夜;将连接产物转化至大肠杆菌DH5α感受态细胞,挑取重组阳性克隆,行PCR和酶切鉴定。将鉴定成功的阳性克隆于37℃恒温摇床培养过夜,吸取部分菌液采用50%甘油保菌,剩余菌液抽提质粒用于后续实验。
1.5 pLV[Exp]-EGFP-RHBDF2慢病毒包装和病毒滴度测定选取生长状态良好且汇合度达90%以上HEK293T细胞,采用胰酶消化后重悬细胞液,将细胞接种于10 cm培养皿中,于37℃、5% CO2培养箱中培养至细胞汇合度达60%~70%时开始转染。慢病毒包装系统中3种质粒DNA溶液的配置:10 μg慢病毒重组质粒pLV[Exp]-EGFP-RHBDF2、辅助质粒psPAX2和pMD2G各5 μg;另取1.5 mL Opti-MEM 培养基与50 μL Lipofectamine 2000转染试剂,轻柔混合均匀,室温孵育20 min以形成转染复合物;然后将上述复合物缓慢滴加到细胞培养皿中,混匀后置于37℃细胞培养箱中继续培养,4~6 h后,将转染体系更换为完全培养基。转染48 h后取出实验组pLV[Exp]-EGFP-RHBDF2和对照组pLV[Exp]-EGFP细胞,在倒置荧光微镜下观察2组细胞中GFP的表达情况并计算感染率。感染率=表达GFP细胞数/总细胞数×100%,感染率大于90%即为转染成功,判定转染成功后,收集病毒上清液,4℃、3 000 r·min-1离心5 min,上清液采用0.45 μm滤器过滤,将过滤后的上清于4℃、25 000 r·min-1离心2 h,以500 μL DMEM完全培养基重悬病毒沉淀并于4℃冰箱溶解过夜,部分用于滴度测定,其余分装至1.5 mL离心管保存于-80℃冰箱备用。采用倍数稀释法测定病毒滴度,取对数生长期的HEK293T细胞按照每孔1×104个接种于96孔板,体积为100 μL。培养24 h后加入100 μL 不同浓度梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8)病毒稀释液,准备8个无菌1.5 mL离心管,在每个管中加入90 μL含2% FBS的DMEM培养基,取10 μL待测病毒原液加入到第1个离心管中,混匀后,从中取10 μL加入到第2个管中,依次从前一个离心管中取10 μL加入后一个离心管中,直到最后一个管。在96孔板中选取所需细胞孔,弃去90 μL旧培养基,加入90 μL用培养基稀释好的病毒液,于37℃细胞培养箱中继续培养。24 h后更换为新的DMEM完全培养基100 μL,48~72 h后观察GFP表达情况。正常情况下荧光细胞数随稀释倍数的增加而减少,病毒滴度(TU·mL-1)=绿色荧光细胞数/相应的慢病毒原液加入量。
1.6 筛选和建立稳定过表达RHBDF2的EA.hy926细胞采用病毒原液感染EA.hy926细胞,于感染前1 d,选取生长状态良好的EA.hy926细胞,按照每孔2×105个细胞接种于24孔板,待细胞融合度达50%~70%时开始实验。慢病毒感染实验分为2组:实验组加入200 μL pLV[Exp]-EGFP-RHBDF2慢病毒进行感染,对照组加入200 μL pLV[Exp]-EGFP-control慢病毒进行感染。次日去除含病毒的培养基,更换为DMEM完全培养基。感染48 h后换用含3 mg·L-1嘌呤霉素的新鲜培养基进行目的细胞阳性筛选。感染72 h后在荧光显微镜下观察GFP表达情况,第4天以后隔天换用新鲜的含嘌呤霉素培养基替换含大量死细胞的培养基。待抗性细胞长满后将细胞转移至6孔板,继续用含嘌呤霉素的培养基培养细胞至密度达80%时,收集部分细胞,以备后续实验。
1.7 荧光定量PCR(qPCR)法检测EA.hy926细胞中RHBDF2 mRNA表达水平分别收集对照组和实验组EA.hy926细胞,采用TRIzol试剂提取总RNA,以该RNA为模板按照反转录试剂盒说明书将总RNA逆转录为互补的cDNA。反转录总体系(20 μL):在0.2 mL PCR管中加入1 μg RNA、5×Reaction Buffer 4 μL、10×dNTP Mixture 2 μL、RNase抑制剂1 μL、M-MLV逆转录酶1 μL、Oligo dT逆转录引物1 μL,加入不含RNase的ddH2O至20 μL混匀,后离心,42℃、60 min,70℃、5 min,所得cDNA用于qPCR扩增,以GAPDH为内参照,分别检测对照组和实验组EA.hy926细胞中RHBDF2 mRNA相对表达水平。qPCR反应中RHBDF2和GAPDH的引物序列:RHBDF2-F 5′-TGCTGCTATGACCCCGT-TTT-3′,RHBDF2-R 5′-CTCACGAGTCCACGGACAAA-3′,GAPDH-F 5′-AGGTCAATGAAGGGGTCGTT-3′,GAPDH-R 5′-AAATGGTGAAGGTCGGTGTG-3′。qPCR反应体系(10 μL):cDNA模板1 μL,上、下游引物(10 μmol·L-1)各0.2 μL,2×SYBR Green荧光染料5 μL,无菌蒸馏水补足至10 μL。使用两步法qPCR扩增程序,反应条件:95℃变性10 min,95℃、15 s,60℃、30 s,72℃、30 s,共40个循环。采用2-ΔΔCT法计算RHBDF2 mRNA表达水平,ΔCT值=目的基因Ct值-内参Ct值,ΔΔCT=实验组ΔCT值-对照组ΔCT值。
1.8 Western blotting法检测EA.hy926细胞中RHBDF2蛋白表达水平分别收集对照组和实验组EA.hy926细胞制备蛋白样品,按照BCA蛋白质定量试剂盒操作说明检测并使蛋白样品浓度一致后加入5×Loading buffer使蛋白变性。取30 μg蛋白样品采用SDS-PAGE进行检测,电泳条件为50 V恒压30 min,100 V恒压90 min。待电泳结束后取出凝胶,采用湿转法将蛋白转移至PVDF膜,转膜条件为200 mA恒流100 min。转膜结束后采用含5% 脱脂奶粉的T-BST液室温孵育1 h以封闭膜上的非特异结合,封闭完成后采用T-BST洗膜3次,每次10 min。将膜剪切好后分别加入一抗,置于4 C摇床孵育过夜。次日回收一抗,T-BST洗膜3次,加入与一抗对应种属的二抗,室温下孵育1 h后,T-BST洗膜3次,利用ECL化学发光剂显影,并采用Image J软件对目的条带进行灰度值分析,计算RHBDF2蛋白表达水平。RHBDF2蛋白表达水平=RHBDF2条带灰度值/β-actin条带灰度值。
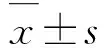
2 结 果
2.1 pLV[Exp]-EGFP-RHBDF2过表达慢病毒载体成功构建通过Gateway技术将目的基因RHBDF2克隆到其受体载体pLV[Exp]-EGFP上,得到pLV[Exp]-EGFP- RHBDF2慢病毒载体(图1 A),该载体上存在NcoⅠ酶的位点(图1B),采用NcoⅠ酶进行切割后通过1%琼脂糖凝胶电泳分析产物片段长度,酶切后电泳结果与预期结果一致(图1C),表明目的基因片段已成功插入到阳性克隆中。测序结果与NCBI数据库RHBDF2序列一致(图2,见插页一),pLV[Exp]-EGFP- RHBDF2慢病毒载体构建成功。

A:Diagram of empty vector pLV[Exp]-EGFP;B:Diagram of recombinant lentiviral vector pLV[Exp]-EGFP-RHBDF2; C:Electrophoregram of enzyme identification of pLV[Exp]-EGFP-RHBDF2 lentiviral vector(M:Marker;Lane 1:Empty vector;Lane 2:Recobinant vector).
图1 pLV[Exp]-EGFP-RHBDF2慢病毒载体的构建和酶切鉴定
Fig.1 Construction of pLV[Exp]-EGFP-RHBDF2 lentiviral vector and enzyme digestion identification
2.2 2组病慢病毒滴度和EA.hy926细胞中GFP表达将构建好的慢病毒表达载体与辅助质粒共转染至HEK293T细胞中,转染48 h后,收集慢病毒并检测病毒滴度,对照组慢病毒滴度为1×108TU·mL-1,实验组慢病毒滴度为3×108TU·mL-1(图3,见插页二)。
2.3 2组EA.hy926细胞中GFP表达感染72 h后荧光显微镜下显示对照组和实验组EA.hy926细胞中均表达GFP(图4,见插页二),感染率达95%以上,表明成功建立并筛选出pLV[Exp]-EGFP-RHBDF2慢病毒稳转细胞系。
2.4 2组EA.hy926细胞中RHBDF2 mRNA表达水平与对照组(1.025±0.072)比较,实验组EA.hy926细胞中RHBDF2 mRNA表达水平(3.024±0.171)升高约2倍,组间比较差异有统计学意义(t=10.76,P<0.01)。
2.5 2组EA.hy926细胞中RHBDF2蛋白表达水平实验组EA.hy926细胞中RHBDF2蛋白表达水平(2.081±0.069)较对照组(1.025±0.153)升高,组间比较差异有统计学意义(t=5.17,P=0.014)。见图5。

Lane 1:Control group;Lane 2:Experiment group.
Fig.5 Electrophoregram of expressions of RHBDF2 protein in EA.hy926 cells in two groups
3 讨 论
AS是一种引起心脑血管疾病的慢性炎症性疾病,为世界范围内的主要致死原因。iRhoms是一种保守的蛋白亚家族,与菱形膜内丝氨酸蛋白酶有关联,其具有独特的结构域,且无催化活性基序,这表明尽管缺乏蛋白酶活性,但这些蛋白仍具有重要的生物学作用[12]。据报道菱形蛋白具有多种功能:比如iRhom2可以控制ADAM17的激活,在分泌途径中TACE的运输需要其与iRhom2结合以促进自身的转运与活化[13];当机体遭受病原体入侵时,巨噬细胞会分泌大量TNF-α,这时iRhom2与TACE相互作用,促进TNF-α从TACE上脱落,使活化的TNF-α从内质网排出[14];如果缺少iRhom2蛋白,TACE则不能离开内质网,因而会明显降低TNF-α释放量,削弱免疫保护炎症反应的强度[15]。此外,iRhom2的磷酸化可调节TACE刺激的蛋白水解脱落,从而从细胞表面释放TNF-α以触发炎症反应[16]。
ADAM17是一种膜表面金属蛋白酶,是主要的脱落酶,负责释放炎性细胞因子TNF-α和表皮生长因子受体(epidermal growth factor receptor,EGFR),参与多种疾病的病理生理过程。蛋白外区脱落对细胞间相互作用至关重要,因为ADAM17控制着sTNF-α和EGFR配体的生物利用度,以及许多其他膜蛋白的释放[17]。MATTHEW[12]发现:ADAM17是对凝血酶、EGFR、溶血磷脂酸和TNF-α刺激的生理信号通路快速反应的分泌酶。细胞表面金属蛋白酶ADAM17协调细胞与细胞之间的相互作用,在炎症、发育、类风湿关节炎和癌症等疾病中发挥关键作用[18]。ADAM17负责将促炎细胞因子TNF-α和大多数EGFR配体从膜锚定中释放出来,从而密切控制TNF-α和EGFR信号通路。LI等[13]发现:iRhom1和iRhom2在小鼠发育过程中是ADAM17依赖性EGFR信号传导的重要上游调节因子。iRhom2调控小胶质细胞中依赖于ADAM17的TNF-α释放,可能导致神经炎症、神经退行性变和睡眠障碍[19]。
目前研究[20]证实:TACE对EGFR配体双调蛋白的胞外域脱落至关重要,iRhom2对TACE的成熟和转运到造血细胞表面起至关重要的作用。iRhom2缺陷的小鼠无法抵御单核细胞增多性李斯特菌的感染,因而认为iRhom2是天然免疫的调节子[21]。DARSHINEE等[22]发现:缺乏iRhom2的小鼠和缺乏TNF-α的小鼠同样获得了对炎症性关节炎的免疫力。进一步的机制研究[23]显示:补体C5a和免疫复合物可以促进iRhom2和TACE依赖的TNF-α释放,表明iRhom2和骨髓表达的TACE在炎症性关节炎中起重要作用,iRhom2可以作为治疗风湿性关节炎的靶标。iRhom2通过氧化应激损伤诱导巨噬细胞炎症进而促进AS,CHENG等[11]发现: ox-LDL刺激引起活性氧(reactive oxygen species,ROS)的产生,伴随着丙二醛(malondialdehyde,MDA)水平的增加和巨噬细胞中谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性的降低,iRhom2在ox-LDL诱导的巨噬细胞中表达明显上调,而抑制iRhom2表达明显降低了ROS的产生和MDA以及氮氧化合物(nitrogen oxide,NOX)水平,同时上调了GSH-px活性,并促进了核因子E2相关因子2/血红素加氧酶 1(nuclear factor-erythroid 2-related factor 2/heme oxygenase 1,Nrf2/HO1)通路的开放,表明抑制iRhom2表达可以减轻氧化应激诱导的细胞损伤,缓解AS的进展,因此iRhom2很可能成为预防和治疗慢性炎症引起AS的潜在靶标。
综上所述,本研究成功构建pLV[Exp]-EGFP-RHBDF2慢病毒载体,并包装成慢病毒感染EA.hy926细胞,建立了稳定上调RHBDF2表达的细胞系。经qPCR法和Western blotting检测验证了稳转细胞系中RHBDF2 mRNA和蛋白表达。本研究结果为进一步深入研究iRhom2/TACE/TNF-α信号通路在AS病理进程中的机制奠定了基础,也为研究AS的预防和治疗提供了新的靶点和方向。

