改性果胶-Fe3O4 磁性微球制备及对Pb2+吸附性能
胡冬婉,马占玲,,马 骁,励建荣
(1.渤海大学化学化工学院,辽宁锦州121013;2.辽宁省食品安全重点实验室)
随着人类社会的不断发展, 弹药制造、 油漆颜料、蓄电池、建筑材料以及电缆护套等行业对铅的利用率越来越多, 部分企业将含有铅的废水不经严格处理直接排放,导致水体污染,水产养殖环境恶化,含铅的有害物质在水生生物体中经富集作用而蓄积,从而导致某些水产品中的铅超标,其中贝类产品尤为严重[1-3]。 铅具有高毒性且以神经毒性为主,主要涉及神经、消化、心血管系统、肾脏和免疫系统等,通过消化道和呼吸道进入人体[4]。 所以研究去除废水中的铅(Ⅱ)和海产品中的超量铅具有深刻的意义。
目前,除铅技术常用的有絮凝、沉淀、吸附、反向渗透、电化学和离子交换等[5]。 其中吸附法应用范围广、成本低、处理效果好且吸附剂能重复使用,从而得到了普遍研究[6]。 果胶是存在于水果和蔬菜中的一种可溶性膳食纤维[7]。据报道,果胶至少包含4 种结构元素,同型半乳糖醛酸聚糖、鼠李半乳糖醛酸聚糖Ⅰ、鼠李半乳糖醛酸聚糖Ⅱ[8],还带有许多不同甲酯化度的羧基[9]。 由于果胶含有大量的—OH、—COOH 等活性基团,因此能够通过螯合、离子交换或形成离子对等方式吸附金属离子。近几年,已经有果胶-Fe3O4微球作为吸附剂的报道,例如:刘岚等[10]、刘义武等[11]以氯化钙为交联剂制备了Fe3O4-果胶磁性微球。 但是,由于果胶中的羧基大部分被甲酯化,影响了其吸附效果。
笔者在碱性条件下用琥珀酸酐改性果胶, 以增加其对铅离子的吸附能力, 制得一种对Pb2+吸附效率高的新型果胶-磁性吸附剂。 这是由于琥珀酸盐中存在可自由旋转的单键, 将与果胶发生异相酯化反应, 使果胶接入更多具有吸附效果的功能基团羧基。 羧基与铅离子发生螯合作用,形成配位键吸附,从而增加吸附剂的吸附能力。 加入磁性离子四氧化三铁和氯化钙后,在偏碱性条件下果胶上的羟基、羧基、 羰基与Ca2+络合成蛋盒结构, 从而形成凝胶微球,以减少果胶的水溶性,增大了吸附容量。
1 实验部分
1.1 原料、试剂和仪器
原料:海产品毛蚶子、扇贝,均购于锦州海鲜批发市场。
试剂:氯化铁、氯化亚铁、十二烷基苯磺酸钠、无水氯化钙、无水碳酸钠、无水乙醇、氨水、果胶、琥珀酸酐、吡啶(阿拉丁)、硝酸、硝酸铅,均为分析纯。
仪器:AA320N 原子吸收分光光度计;SK6210HP超声波清洗器;Scimitar2000 傅里叶变换红外光谱仪;SU-70 扫描电子显微电镜;FE20K pH 计;DZF-6050 真空干燥箱;ZD-85A 气浴恒温振荡器。
1.2 琥珀酸酐改性果胶-Fe3O4 的制备
采用化学共沉淀法[12-13]制备纳米Fe3O4。 按质量比为2∶1 称取6.2 g FeCl3·6H2O、3.1 g FeCl2·6H2O 分别置于装有蒸馏水的100 mL 烧杯中,加热至60 ℃,搅拌使其充分溶解。 将上述溶液同时倒入250 mL烧瓶中并通入N2,在65 ℃水浴中加热30 min,加入25 mL 氨水,高速搅拌产生黑色沉淀,沉淀完全后磁分离,用蒸馏水洗涤,在60 ℃烘干,研磨得到Fe3O4磁性颗粒。
琥珀酸酐改性果胶。 称量1.0 g 果胶,加入60 mL 0.1 mol/L 的NaOH 溶液混合,再加入40 mL 蒸馏水,在30 ℃条件下边通入N2边快速搅拌使其充分溶解。皂化24 h 后转移至60 mL 乙醇溶液中并搅拌成悬浮液,加入10 mL 吡啶、3 g 琥珀酸酐。将该混合物在60~75 ℃连续搅拌24 h,冷却、过滤,用乙醇洗涤,用蒸馏水洗涤。
制备改性果胶-Fe3O4颗粒。 将1.0 g Fe3O4颗粒放入100 mL 去离子水中并用超声波分散30 min,然后与改性果胶混合并置于40~60 ℃的水浴中加热。缓慢滴加0.4 mol/L 的CaCl2溶液15 mL, 加入少量无水碳酸钠和十二烷基苯磺酸钠,搅拌混合,用超声波分散30 min,然后在40~60 ℃加热搅拌4 h。 冷却至室温,磁分离,用蒸馏水洗涤数次,在真空干燥箱中在50 ℃干燥, 研磨后制得琥珀酸酐改性果胶-Fe3O4颗粒。
1.3 产品表征
红外光谱分析: 用溴化钾压片法对材料进行红外光谱表征, 在500~4 000 cm-1的波数范围内进行红外光谱扫描, 根据红外光谱图中的官能团峰对样品进行官能团分析。
X 射线衍射分析: 将装好样品的玻璃片放入X射线衍射仪中,工作电压为40 kV,工作电流为40 mA,扫描区间2θ 为20~70°。
扫描电镜分析:用热场发射扫描电镜观察样品的表面结构。 加速电压为0~20 kV(连续可变),放大倍数为500X~160 000X。
1.4 吸附实验
1.4.1 吸附水溶液中铅的实验
在离心管中加入10 mL 不同pH、不同质量浓度的铅溶液,加入一定量改性果胶-磁性微球吸附剂,在一定温度的恒温气浴振荡器中振荡(150 r/min)吸附一段时间, 然后将强力吸铁石放置在离心管底部将磁性吸附剂吸住,分离出上清液,并测定残留铅离子质量浓度。 按照式(1)(2)计算Pb2+去除率(%)和单位吸附量(mg/g)。

式中:R为Pb2+去除率,%;C0、C分别为Pb2+初始和吸附平衡质量浓度,mg/L。

式中:qe为单位吸附量,mg/g;V为Pb2+溶液体积,L;m为吸附剂质量,mg。
1.4.2 去除海产品中铅的实验
将市售新鲜活毛蚶子、扇贝置于净水中放置24 h,待其吐净泥沙后反复清洗,去壳后用去离子水洗涤,绞碎制得匀浆液。调节浆液pH=2,水浴加热至37 ℃,加入适量胃蛋白酶,反应后冷却至室温,离心取上清液, 即得酶解液。 取一定量酶解液于离心管中,加入改性果胶-Fe3O4微球,在一定条件下吸附,经过消化处理测量吸附前后酶解液中的铅离子质量浓度。
1.4.3 吸附剂脱附再生实验
吸附剂的循环再生能力影响其实际应用价值和成本, 因此探究琥珀酸酐改性果胶-磁性微球脱附再生实验非常必要。 实验选择EDTA 作为脱附剂,EDTA 是一种很强的配体, 能够与铅离子结合形成配合物。 脱附剂浓度为0.1 mol/L,溶液体积为10 mL,振荡脱附时间为4 h。 吸附实验条件:吸附温度为25 ℃,溶液pH 为5,Pb2+质量浓度为200 mg/L,吸附剂添加量为20 mg,吸附时间为2 h。 吸附完成后采用磁分离方法分离出吸附剂, 用去离子水反复清洗至中性,然后真空干燥,备用。 重复上述吸附-脱附实验过程5 次,考察再生吸附效果。
2 结果与讨论
2.1 琥珀酸酐改性果胶-Fe3O4 表征
2.1.1 FT-IR 分析
图1 为Fe3O4(a)、果胶-Fe3O4磁性微球(b)、琥珀酸酐改性果胶-Fe3O4磁性微球(c)的FT-IR 图。 图1a 中,3 429 cm-1处为Fe3O4表面—OH 的伸缩振动峰;576 cm-1处为Fe3O4的特征吸收峰,是由Fe3O4中Fe—O—Fe 的伸缩振动产生的[14]。这两种峰在图1b、c中也有,说明合成的改性吸附剂有Fe3O4粒子。图1b、c 中3 423、3 431cm-1处吸收峰呈现出较宽的特征,是果胶的分子内缔合羟基导致的。通过观察,琥珀酸酐改性果胶-Fe3O4微粒中3 431 cm-1处的吸收峰相对于果胶-Fe3O4微粒的吸收峰有略微的偏移, 这是分子内其他化合键的改变对氢键产生的影响。 与图1b 相比图1c 中离子化的羧基(—COO—)1 604 cm-1处的不对称伸缩振动峰明显增强, 说明经过改性琥珀酸酐改性果胶-Fe3O4磁性微球的羧基增多了,而且在1 105 cm-1处酯官能团上C—O 吸收峰也明显增强,表明琥珀酸酐和果胶之间发生了酯化反应,这表明成功合成了琥珀酸酐改性果胶-Fe3O4磁性微球吸附剂。

图1 Fe3O4(a)、果胶-Fe3O4 磁性微球(b)、改性果胶-Fe3O4 磁性微球(c)的FT-IR 图
2.1.2 XRD 分析
图2 为Fe3O4(a)、果胶-Fe3O4磁性微球(b)、琥珀酸酐改性果胶-Fe3O4磁性微球(c)的XRD 谱图。由图2 看出,3 个样品均在2θ 为30.24、35.44、43.21、53.60、57.13、62.58°处出现XRD 峰, 各衍射峰的峰位基本不变, 表明未改性果胶包覆的Fe3O4和改性果胶包覆的Fe3O4几乎没有改变Fe3O4的尖晶石结构。 在2θ 为28°左右有杂峰,可能是部分Fe2+被氧化。

图2 Fe3O4(a)、果胶-Fe3O4 磁性微球(b)、改性果胶-Fe3O4 磁性微球(c)的XRD 谱图
2.1.3 SEM 分析
图3 为琥珀酸酐改性果胶-Fe3O4磁性微球SEM 照片。 由图3 看出,吸附剂样品为较均匀的微球、分散性好,而且表面凹凸不平、粗糙多孔,有助于吸附反应的发生。

图3 琥珀酸酐改性果胶-Fe3O4 磁性微球SEM 照片
2.2 吸附性能研究
2.2.1 吸附动力学
在溶液体积为10 mL、吸附温度为常温、溶液初始Pb2+质量浓度为200 mg/L、 吸附剂质量为20 mg条件下吸附一定的时间,磁分离后移取上清液,测定吸附后溶液中剩余Pb2+质量浓度, 研究琥珀酸酐改性果胶-Fe3O4磁性微球对Pb2+吸附动力学和内扩散模型。吸附动力学曲线见图4。将该曲线进行准一级动力学、准二级动力学和颗粒内扩散模型拟合,结果见表1。
准一级动力学公式:

准二级动力学公式:

粒内扩散模型方程:

式中:qe、qt分别为平衡时和t时刻的吸附量,mg/g;k1为准一级动力学吸附速率常数,min-1;k2为准二级动力学吸附速率常数,g/(mg·min)。kp为粒内扩散速率常数,mg/(g·min0.5);C为常数。

图4 Pb2+的吸附动力学曲线
由图4 可知, 琥珀酸酐改性果胶-Fe3O4磁性微球吸附剂相比未改性果胶-Fe3O4磁性微球吸附剂对Pb2+的吸附量增大,而且吸附反应迅速。 琥珀酸酐改性果胶-Fe3O4磁性微球吸附剂对Pb2+的吸附量随着吸附时间的延长而增加, 在起初的15~45 min 范围内吸附量增长速度较快,为快速吸附阶段,45 min 时吸附量达到41.91 mg/g, 而此时未改性吸附剂吸附量只有25.56 mg/g;600 min 后为平衡吸附阶段,吸附量为64.21 mg/g。 这是由于,最初的吸附剂有大量吸附活性位点, 在一定Pb2+浓度下Pb2+被快速吸附到吸附剂表面;随着时间的延长,吸附剂的吸附位点逐渐减少,吸附速率减慢,吸附量渐渐达到平衡。表1为对吸附曲线进行准一级动力学、 准二级动力学和颗粒内扩散模型拟合的结果, 准二级动力学拟合方程的R2(0.999 4)明显大于准一级动力学模型的R2(0.737 8),通过计算理论平衡吸附量为64.52 mg/g,与实际平衡吸附量64.21 mg/g 非常接近, 改性吸附剂对铅离子的吸附较好地符合准二级吸附动力学方程。 这表明化学反应控制反应速率,琥珀酸酐改性果胶-Fe3O4磁性微球吸附剂对铅离子的吸附可能与吸附剂和铅离子之间的电子共享或电子交换有关[15]。 改性吸附剂含有大量—OH、—COOH 等活性基团,能够通过螯合作用吸附金属离子。 —OH、—COOH 等活性基团易与铅离子发生螯合反应形成金属配合物,提高吸附容量。粒内扩散模型方程拟合Pb2+动力学曲线,发现R2为0.653 6,表明粒子内扩散模型不合适。 因此限速步骤不是粒子内扩散而是化学吸附。

表1 琥珀酸酐改性果胶-Fe3O4 磁性微球吸附Pb2+动力学模型拟合参数
2.2.2 吸附等温线
吸附等温线可以描述吸附剂和被吸附物质的相互作用并预测出吸附剂的吸附容量。 取20 mg琥珀酸酐改性果胶-Fe3O4磁性微球吸附剂加入到不同质量浓度的Pb2+溶液中,溶液体积为10 mL,吸附温度为25 ℃,振荡转速为150 r/min,恒温振荡时间为2 h,等温吸附曲线见图5。将上述曲线进行Langmuir和Freundlich 方程拟合,结果见表2。

式中:Ce为平衡质量浓度,mg/L;qe为平衡吸附容量,mg/g;qm为 饱 和 吸 附 容 量,mg/g;kL为Langmuir常数,L/mg;kF为经验常数,(mg/g)(L/mg)1/n,用来表示吸附能力的相对大小;n为与吸附分子和吸附剂表面作用强度相关的参数。 其中kF和n均为常数。
由图5 看出, 吸附量随着Pb2+初始质量浓度的增加而增大,而且变化较大。当Pb2+初始质量浓度达到800 mg/L 左右时,吸附几乎达到饱和,吸附量基本趋于平衡,为80.02 mg/g。 这是因为,随着溶液浓度的升高,吸附剂克服固液传质阻力,增加吸附位点与Pb2+碰撞。 由表2 看出,Langmuir 方程的相关系数R2为0.994 3,而Freundlich 方程的相关系数R2为0.958 7。 在Freundlich 模型中,n>1 表明在吸附过程的研究范围内有利于吸附的进行。 Langmuir 等温吸附曲线更加适合描述琥珀酸酐改性果胶-Fe3O4磁性微球对Pb2+的吸附,说明此吸附为单层吸附,并且吸附主要发生在吸附剂表层,理论最大吸附量为94.34 mg/g。模型中,kL在0 和1 之间,表明吸附过程在研究范围内有利于吸附的进行。

图5 Pb2+的等温吸附曲线

表2 Langmuir 和Freundlich 等温线模型参数
2.2.3 温度、吸附剂用量、pH 对吸附性能的影响
图6a、b、c 分别为温度、吸附剂添加量、pH 对琥珀酸酐改性果胶-Fe3O4磁性微球吸附剂吸附Pb2+的影响。 由图6a 可见, 在25~30 ℃范围内吸附剂对Pb2+的吸附量未发生显著的变化,40~70 ℃范围内吸附剂对Pb2+的吸附量大致呈下降趋势。 吸附剂对Pb2+的吸附最适宜的温度为40 ℃。这是由于,随着温度升高,加快了粒子内扩散速度,Pb2+的运动速度和范围变得更快更宽,这增加了吸附的可能性,从而使Pb2+更容易被吸附。当温度高于40 ℃后,由于分子的运动速度加快,Pb2+得到更多的能量来克服其与吸附剂表面之间的静电力,部分离子发生了解析,所以吸附率呈下降趋势。
由图6b 看出,Pb2+的吸附量随着吸附剂用量的增加呈现逐渐下降的趋势。这是由于,随着吸附剂用量的增加吸附位点增多, 当吸附剂吸附Pb2+达到一定量后,吸附与解吸过程达到动态平衡,大量吸附剂微球的存在导致吸附剂之间的碰撞和聚集机会变大,单位质量吸附剂上的活性位点数目减少,即吸附量降低。 当吸附剂用量为20 mg 时,吸附剂对Pb2+的吸附量达到50.24 mg/g,因此吸附剂用量选择20 mg。
由图6c 看出,在pH 为1~5 时,吸附剂对Pb2+的吸附量随着pH 的增加而增大,pH 在6~8 范围内吸附剂对Pb2+的吸附量略有下降。 这可能是H+与Pb2+之间存在竞争吸附作用导致的。 当pH 较低时,吸附剂表面大量的吸附活性位点如—OH、—COOH 等官能团被H+占据,使其质子化,这阻拦了金属离子充分与吸附位点的接触,导致吸附量较小。 随着pH 增大,质子化作用减小,增加了与Pb2+之间的离子交换作用和螯合作用,从而提高了对Pb2+的吸附能力。然而,当pH 过大时,Pb2+开始以氢氧化物[Pb(OH)2]的形式沉积。 因此,选择pH 在5 左右为宜。
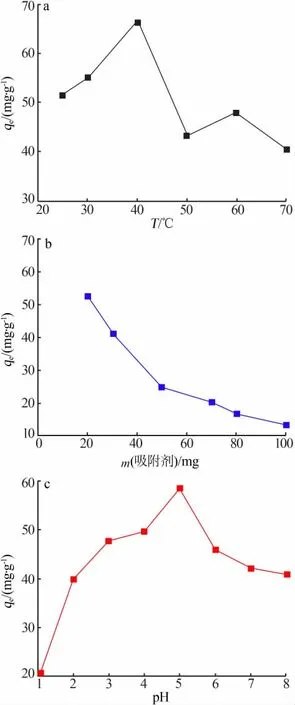
图6 温度、吸附剂用量、pH 对吸附剂吸附Pb2+的影响
2.3 海产品样品的测定
分别取10 mL 毛蚶子、扇贝两种海鲜的酶解液,测出吸附前后酶解液和吸附液中Pb2+的质量浓度并计算去除率,结果见表3。 由表3 看出,吸附后铅浓度明显降低, 吸附剂对贝类组织中Pb2+的去除率分别为76.47%和80.34%。
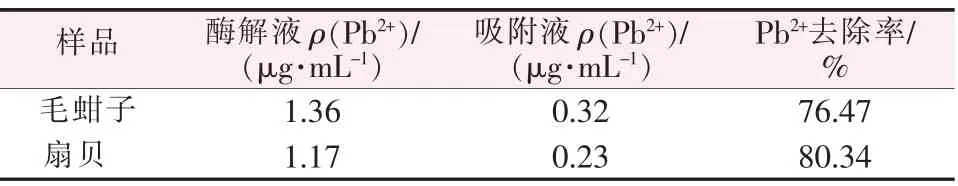
表3 海产品样品中Pb2+去除率
2.4 解吸实验
选择0.1 mol/L 的EDTA 作为脱附剂,洗脱效果见图7。 由图7 看出,琥珀酸酐改性果胶-Fe3O4磁性微球经过对Pb2+的3 次循环吸附去除率达到74%,经过5 次循环吸附仍然具有一定的吸附能力, 说明琥珀酸酐改性果胶-Fe3O4磁性微球具有良好的吸附再生能力。

图7 吸附剂循环再生性能
3 结论
成功制备了琥珀酸酐改性果胶-Fe3O4磁性微球。研究结果表明,琥珀酸酐改性果胶-Fe3O4磁性微球对铅离子的吸附性能明显高于未改性果胶-Fe3O4磁性微球的性能。 这是因为琥珀酸酐交联酯化改性使果胶分子产生较多的吸附基团羧基, 使吸附容量提高。 吸附最佳条件:反应温度为40 ℃,溶液pH 为5,吸附剂添加量为20 mg。琥珀酸酐改性果胶-Fe3O4微球对Pb2+的吸附很好地符合了准二级动力学方程和Langmuir 等温方程,且通过Langmuir 等温方程的拟合计算得到琥珀酸酐改性果胶-Fe3O4微球吸附Pb2+的最大吸附容量为94.34 mg/g。 将其用于去除毛蚶子、 扇贝酶解液中Pb2+的实验, 去除率分别为76.47%和80.34%。而且改性吸附剂具有良好的吸附再生性能。

