直肠癌患者组蛋白甲基转移酶hSETD1A表达水平的临床预后价值
王 淋,贾 静,叶星明,林 露,陈燕坪,陈 颖
1.福建省肿瘤医院,福建医科大学附属肿瘤医院中心实验室,福建 福州 350014;
2.福建省肿瘤医院,福建医科大学附属肿瘤医院病理科,福建 福州 350014
肠癌是最常见的消化道恶性肿瘤,据最新的全球癌症数据统计,2018年全球新增180万的病例并且有超过88万的死亡病例,其全球发病率和死亡率分别升至第3位和第2位[1]。hSETD1A是组蛋白甲基转移酶(histone methyltransferases,HMT)的TrxG家族一员,其甲基化位点为组蛋白H3的第4位赖氨酸(lysine 4 at histone H3 tails,H3K4)[2-3]。H3K4的三甲基化(trimethylation of H3K4,H3K4me3)是基因转录活跃的标志。H3K4me3通常会在激活基因的转录起始位点高度富集,从而控制基因的转录[2,4]。在针对肠癌细胞的研究中,Salz等[5]发现,hSETD1A能够通过与β-catenin的相互作用而被招募到Wnt信号通路的靶基因的启动子上,从而调控肠癌细胞的生物学行为。有限的实体瘤研究数据同时表明,与癌旁组织相比,肠癌、乳腺癌肿瘤组织均存在着hSETD1A mRNA高表达的现象,且在乳腺癌中发现其高表达与患者的预后相关[5-6]。然而关于hSETD1A在肠癌组织中的表达情况以及与临床病理学特征及预后的关系鲜有报道。因此,本研究以直肠癌为研究对象,采用免疫组织化学法检测直肠癌患者中hSETD1A的表达情况,分析其与直肠癌临床病理学特征及预后的关系,以便为更好地评估其临床意义、寻找新的治疗靶点提供理论依据。
1 资料和方法
1.1 研究对象
141例于2012年1月—2014年6月在福建省肿瘤医院行直肠癌手术的患者被纳入该研究。为了解原始状态的hSETD1A表达情况,所纳入的研究对象均为术前未接受任何针对肿瘤治疗的患者。来源于该批患者的组织蜡块标本(含50例癌旁正常直肠组织)及相关临床资料、随访信息被用于本研究。
1.2 实验方法及主要实验仪器和试剂
免疫组织化学法:所有组织标本经3.7%的中性甲醛溶液固定,常规脱水、石蜡包埋、4 μm厚切片。免疫组织化学采用瑞士罗氏公司全自动免疫组织化学分析仪检测,实验步骤参照说明书进行。兔抗人SETD1A抗体(货号PA5-54254,工作浓度1∶200)购自美国Thermo Fisher Scientific公司,用已知阳性组织作为阳性对照,用PBS代替一抗作为阴性对照。
1.3 结果判定
hSETD1A主要表达于细胞核,阳性标记为黄色或棕黄色颗粒样。根据切片中阳性肿瘤细胞占所有肿瘤细胞的百分比评分:无肿瘤细胞阳性为0分,阳性肿瘤细胞占1%~25%为1分,26%~50%为2分,>50%为3分;按照阳性强度评分:微弱阳性为1分,中等强度阳性为2分,强阳性为3分。最后总评分=阳性百分比评分×阳性强度评分。0~1分为阴性;2~4分为弱-中阳性;6~9分为强阳性。
1.4 随访
病例随访从明确诊断开始,总生存期(overall survival,OS)的计算从确诊到最后1次随访或死亡日期,以月为单位。
1.5 统计学处理
数据分析均采用IBM SPSS 23.0统计软件。hSETD1A表达与临床病理学特征的关系采用χ2检验;生存曲线分析采用Kaplan-Meier法,单因素生存曲线比较采用log-rank检验;预后多因素分析采用COX回归比例风险模型。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
141例直肠癌者年龄范围为29~86岁(中位年龄59岁),其中男性83例,女性58例。随访时长为1~70个月,中位随访时间为50个月,其中因肿瘤死亡39例。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版恶性肿瘤TNM分期标准,Ⅰ期29例,Ⅱ期49例,Ⅲ期63例。各临床病理学参数详见表1。

表1 hSETD1A表达与直肠癌患者临床病理学特征的关系Tab.1 The correlation between hSETD1A expression and clinicopathological characteristics in rectal cancer
2.2 hSETD1A的表达与直肠癌临床病理学特征的关系
50例癌旁对照组织中hSETD1A阳性例数为13例(26.0%),141例直肠癌组织中hSETD1A阳性例数为106例(75.2%)(图1)。癌组织的阳性表达率显著高于对照组(P<0.001)。χ2分析显示,hSETD1A阳性表达率与肿瘤的分化程度及患者的性别相关,而与年龄、肿瘤大小、T分期、N分期(淋巴结转移状况)、TNM分期、神经累及、脉管癌栓、CA19-9及癌胚抗原(carcinoembryonic antigen,CEA)表达水平无关(表1)。
2.3 hSETD1A的表达与预后分析
生存分析结果显示,hSETD1A阳性组预后明显比hSETD1A阴性组差(5年生存率:64.4%vs76.5%,P=0.036,图2,表2);hSETD1A阳性组的无病生存期(disease-free survival,DFS)低于阴性组,但差异无统计学意义(97.9%vs100%,P=0.407)。多因素COX回归分析显示,hSETD1A和T分期、N分期及后续治疗可作为直肠癌的独立预后因素(P<0.05,表3)。

图1 hSETD1A在直肠癌中的代表性表达Fig.1 Representative sections of hSETD1A expression in rectal cancer

图2 hSETD1A表达与直肠癌患者生存曲线图Fig.2 Kaplan-Meier analysis for OS in rectal cancer patients according to hSETD1A protein level

表2 影响直肠癌预后的单因素分析Tab.2 Univariate analysis for OS according to preoperative clinical parameters in rectal cancer
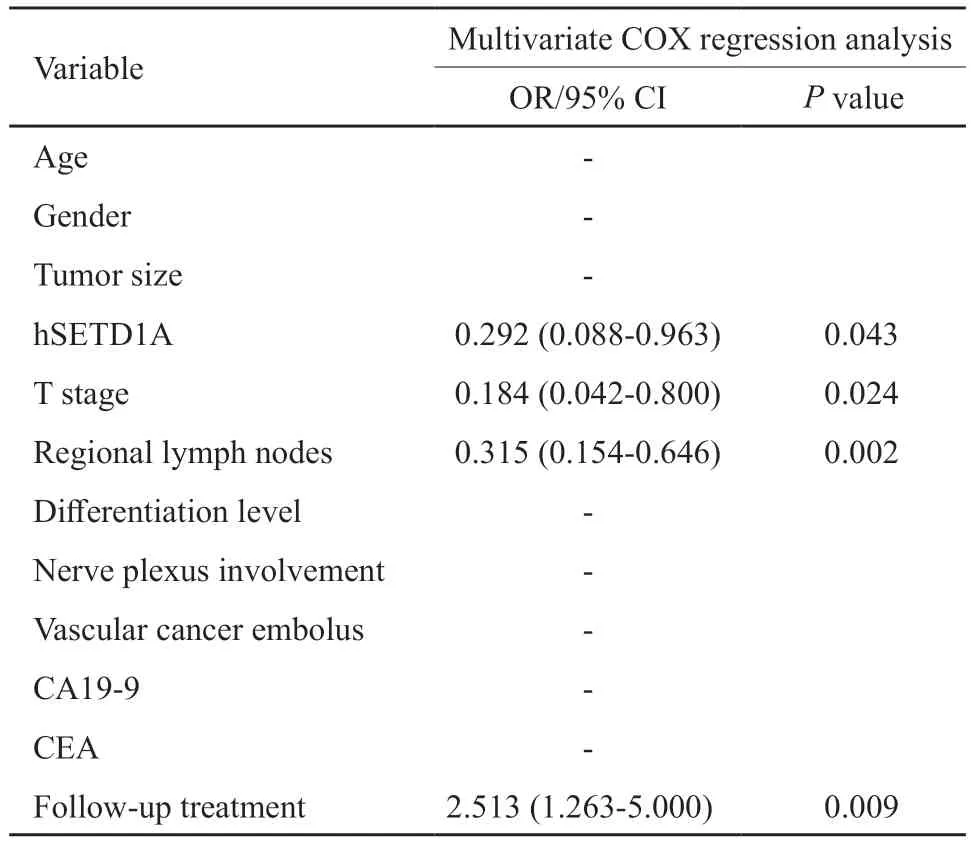
表3 影响直肠癌预后的多因素分析Tab.3 Multivariate analysis for OS according to preoperative clinical parameters in rectal cancer
3 讨 论
hSETD1A是组蛋白甲基转移酶,存在于人体多处组织器官中,主要表达于细胞核内,其甲基化位点为H3K4,主要参与基因的转录调控。近年来,hSETD1A在肿瘤发生、发展过程中的影响作用慢慢开始受到关注,有研究[5,7-8]表明,hSETD1A的mRNA表达和蛋白水平在人肺癌、卵巢癌、乳腺癌、前列腺癌、白血病和肠癌等多种肿瘤细胞系中明显升高。有研究[9-10]表明,在癌症的不同阶段,无论在全身性还是局部的H3K4me3水平都会有所改变,甚至能在一定程度上作为疾病复发的预警。最近有研究[11-12]表明,SETD1A的缺失对全身性的H3K4me3水平和基因表达具有重要的影响。
本研究从临床样本入手,在蛋白水平上发现hSETD1A在直肠癌组织样本中同样存在着高表达(106/141)的现象,印证了Salz等[5]前期观察的结果。Salz等[5]的研究发现,hSETD1A和H3K4me3的mRNA表达在多种肠癌细胞系和62.5%(15/24)的结直肠癌患者样本中明显上调,并且证实组蛋白H3K4me3主要是hSETD1A作用的结果。本研究同时发现,hSETD1A的高表达与直肠癌患者的预后不良相关,且为其独立的预后因素。尽管目前未见hSETD1A表达与直肠癌患者预后关系的相关报道,但在一项乳腺癌的研究中发现,乳腺癌组织中hSETD1A的高表达与患者的不良预后相关[6],该结果在一定程度上印证了本研究结果。
hSETD1A与直肠癌的不良预后相关,可能是通过Wnt信号通路起作用。据报道,70%~90%的结直肠癌都与Wnt信号通路的异常激活有关[13-15]。Salz等[5]研究发现,肠癌细胞中表达异常上调的hSETD1A能够通过与β-catenin的相互作用而被招募到Wnt信号通路的靶基因的启动子上,从而促进启动子的H3K4me3并激活Wnt/β-catenin通路靶基因的表达、调控结直肠癌细胞的生物学行为。此外,本研究还发现,N分期也是直肠癌独立预后因素,这与Chen等[16]的报道一致。
Wiencke等[17]的早期研究曾发现结直肠癌中抑癌基因p16INK4a5’端的CpG岛的甲基化与性别相关,提示在不同性别之间可能存在着基因或表观遗传特性的差异,进而影响到肠癌发生、发展的风险程度。在真实世界中肠癌的发生率及死亡率在不同性别中也存在差异。据中国癌症统计报道,中国男性结直肠癌的发病率及死亡率均高于女性[18]。本研究发现,hSETD1A的阳性表达率与性别相关,以男性患者中阳性比例为高。这种性别的差异也许可以用激素来解释。Slattery等[19]对结肠癌中微卫星不稳定性(microsatellite instability,MSI)的状态与性别、生殖因素及激素暴露情况的相关性进行分析时发现,雌激素可能是一种能够对抗MSI的保护因子;而缺乏雌激素高MSI的年老女性结肠癌风险增加。我们大胆推测性别对hSETD1A组蛋白甲基转移酶表达的影响很可能也是由于雌激素的原因,但这需要更大样本量的数据和进一步的实验来验证。
本研究还观察到肿瘤组织的分化程度与hSETD1A的表达相关的现象。由于本项研究中低分化程度的肿瘤样本占比有限(仅2个),其结果可靠性还有待于进一步的研究证实。另一方面,虽然本研究未观察到hSETD1A的表达与直肠癌其他临床病理学参数(肿瘤大小、T分期、淋巴结转移、TNM分期、神经累及、脉管癌栓、CA19-9及CEA表达等)的相关性,但同样由于本研究的样本量较少,其结果解读亦需要审慎。
此外,本研究对象中包含了部分按现行美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南需要接受术前新辅助放化疗的Ⅲ期肿瘤患者,这部分患者未接受该术前治疗的原因多样,包括有些主诊组习惯采用欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南或日本的指南,有些是因为外科医师在肠镜下观察能够将系膜完整剥离,所以直接进行手术,部分是由于患者家属不接受,要求直接手术,情况不一。这些不一致性也可能在一定程度上影响到了hSETD1A分子在直肠癌预后价值的评估,故而其结论尚需进一步的研究验证。
综上所述,本研究结果证实hSETD1A在直肠癌组织中呈高表达,其阳性组生存率显著低于阴性组,为直肠癌的独立预后因素。锁定组蛋白修饰酶hSETD1A作为调控Wnt信号通路新的突破口,或许能够为直肠癌临床研究和治疗策略提供新的思路或新的治疗靶点,其临床应用价值及相关的分子机制有待进一步研究。

