乳腺癌异质性的研究进展及临床意义
蒋梦怡,陆言巧,王红霞
1.南京医科大学附属上海一院临床医学院肿瘤科,上海 200080;
2.上海交通大学附属胸科医院心内科,上海 200030
乳腺癌居于女性癌症发病率首位,占美国新发女性癌症人群的30%,且呈逐年增长趋势[1]。由于早期诊断和综合治疗策略的进步,近年来乳腺癌患者的预后得到了极大的改善,但仍有20%~30%的乳腺癌患者在诊断和治疗后发生转移。未转移乳腺癌患者5年总生存率大于80%,远处转移患者则下降至25%[2]。
乳腺癌由于基因组学、转录组学和微环境差异,导致不同表型和生物学行为差异,正确认识这种异质性对临床诊断、治疗方案的制订及预后预判具有重要意义。随着分子诊断技术的发展,人们已经意识到乳腺癌并非单一组织、器官发生的简单疾病,而是多种不同分子亚型组成的集合体。本文主要针对乳腺癌异质性的研究进展对临床诊断和治疗的影响进行综述。
1 乳腺癌异质性
1.1 时间和空间异质性
肿瘤细胞存在异质性的先决条件之一就是克隆进化,从正常上皮细胞开始到临床转移,经历了多步骤和多分子改变,表现为时间和空间异质性。时间异质性是指在肿瘤发展过程中,原发灶在不同时间段内肿瘤细胞存在差异,或复发灶和原发灶存在分子分型和生物学行为的差异。例如,原发灶与复发灶雌激素受体(estrogen receptor,ER)变化率为7%~25%[3],孕激素受体(progesterone receptor,PR)变化率为25.8%,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)变化率为14.4%[4]。空间异质性是指在同一肿瘤中不同组织部位细胞之间的差异。例如,KRAS基因扩增水平不同的细胞在同一肿瘤组织中同时并存[5]。灌注磁共振扫描显示同一乳腺肿瘤组织内存在不同比例高、中、低灌注亚区[6]。
1.2 表型和基因异质性
表型异质性是指肉眼可见的形态学和镜下观察到的组织学差异,尤其对于乳腺单侧多源、多灶性肿瘤或双原发性癌等。造成表型异质性的原因可能是癌细胞位置不一(肿瘤中心或周边)、含氧量不均等以及肿瘤微环境中其他细胞(如成纤维细胞、脂肪细胞、巨噬细胞等)的影响[7]。基因异质性表现在乳腺癌内本身具有多个不同基因活化状态的起源细胞或基因在特定压力下(定植转移或化疗)发生突变,例如,剪接体相关基因SNRNP40突变产生SNRNP40表达减少的细胞亚群,导致肿瘤转移效率增强[8]。2012年Cancer Genome Atlas Network[9]公布了约800例乳腺癌患者的基因表达模式、突变、DNA拷贝数、DNA甲基化和miRNA表达的分析结果,表明乳腺癌分子亚型之间存在着巨大差异,不存在单一的乳腺癌致病分子事件。例如,HER2+和基底样乳腺癌的TP53抑癌基因体细胞突变率高(72%~80%),而其他分子亚型TP53基因突变率只有12%~29%。Luminal A、Luminal B和HER2+亚型的PIK3CA基因突变率分别为45%、29%和39%,而基底样乳腺癌为9%。与癌症相关的DNA甲基化改变包括整体低甲基化和基因特异性高甲基化状态[10]。Moelans等[11]研究报道在不同乳腺癌病灶和同一病灶的不同区域存在TP53、RARB、RASSF1A、FHIT、APC、DAPK1、GSTP1、CDH13及BRCA1等显著甲基化修饰差异,这些基因表观修饰变化为乳腺癌异质性贡献了97%的权重。
2 异质性起源
目前有两种模型阐述了异质性起源问题:肿瘤干细胞(cancer stem cell,CSC)模型和克隆进化模型[12-13]。这两个假说不是独立的,而是一个共存、动态的过程。CSC模型认为,肿瘤实际上由一小群具有自我更新及多向分化能力的干细胞样细胞及其分化程度不均的细胞组成。乳腺癌干细胞具有高度可塑性,能够通过上皮-间质转化(epithelialmesenchymal transition,EMT)诱导上皮和间充质状态转化。EMT不是一个从纯上皮细胞向纯间充质细胞表型转变的“全或无”过程,而是具有多个中间阶段的异质性状态。在这些混合上皮/间充质表型中,癌细胞同时具有上皮细胞和间充质细胞特征,形成循环肿瘤细胞簇,从而获得更高侵袭性和治疗抵抗[14]。克隆进化模型认为肿瘤细胞异质性起源于单个肿瘤细胞群在发展中的持续突变。此学说一方面认为肿瘤组织是单克隆起源的,各个肿瘤细胞都拥有一定程度上相同的遗传变异,另一方面认为在肿瘤演进过程中不同细胞亚群拥有各自变异。这种克隆性的扩大不仅来自于基因突变,还可来自于DNA甲基化、组蛋白修饰、非编码RNA干扰等表观遗传学的变化。
3 乳腺癌异质性导致不同分子亚型
浸润性导管癌是乳腺癌最常见的病理学亚型,占浸润性乳腺癌的80%,其他包括浸润性小叶癌(10%)、黏液癌、筛状癌、微乳头状癌、乳头状癌、管状癌、髓样癌、化生癌和炎性癌等[15]。这些常规病理学亚型可根据其分子特征如ER、PR、HER2、人表皮生长因子受体1(human epidermal growth factor receptor 1,HER1)以及各种细胞角蛋白(如CK5/6)表达进一步细分为不同的分子亚型(图1)。约70%的Luminal型乳腺癌表达ER和(或)PR,所以经常观察到ER和PR的差异表达,如ER+/PR-和ER-/PR+型,这种表型多样性提示可能伴随着基因表达模式的相应多样性。多项研究采用DNA微阵列进行谱学分析乳腺癌分子异质性,这些方法通过评估大组队列中乳腺癌样本基因表达谱的相似性,并根据高表达基因进行聚类分析,鉴定了乳腺癌的不同分子亚型,对人类乳腺癌基因表达模式的系统研究为乳腺癌分子分类的改进奠定了基础[16]。
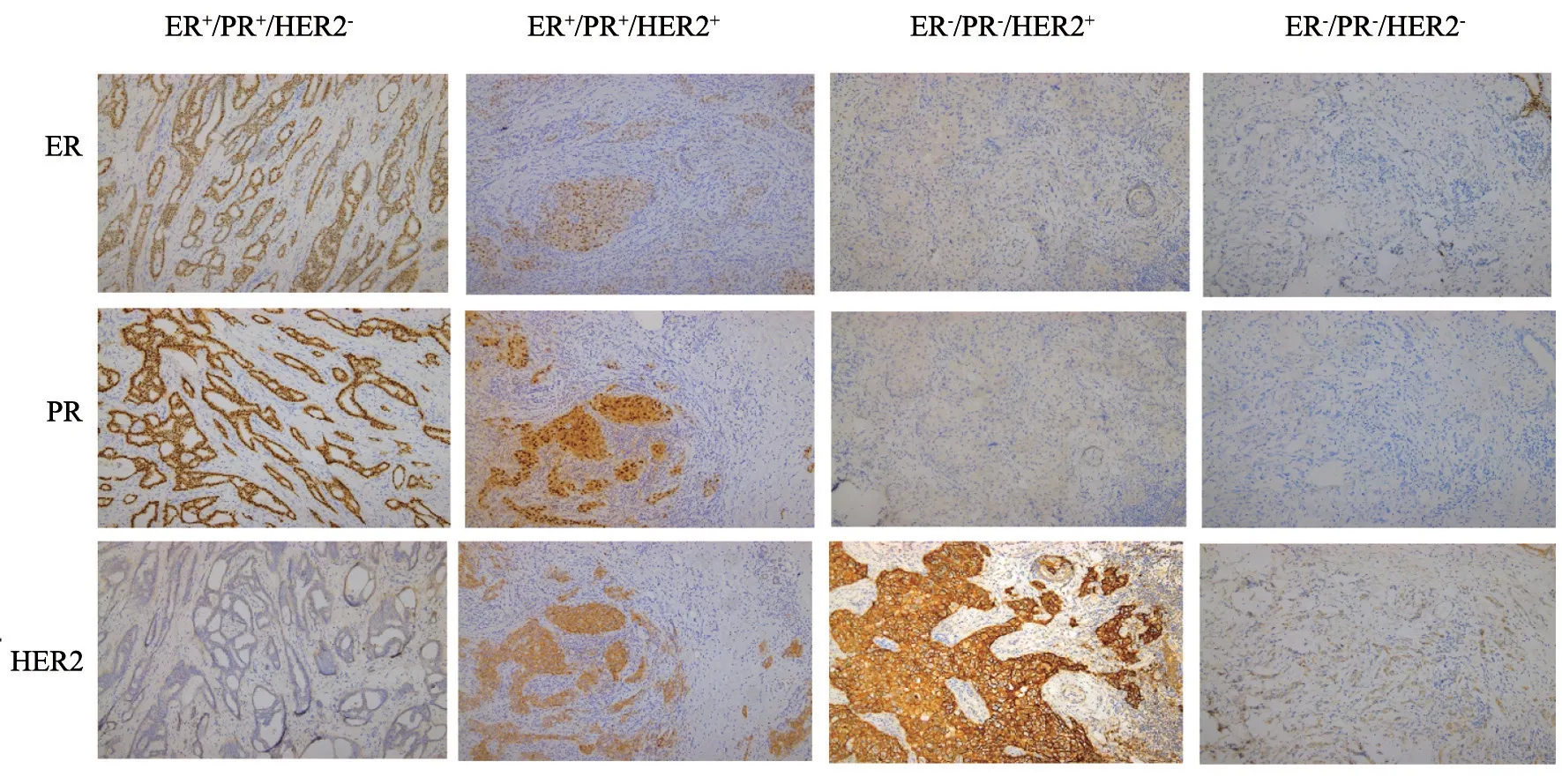
图1 乳腺癌各亚型免疫组织化学染色Fig.1 Immunohistochemistry of breast cancer subtypes
3.1 Luminal型乳腺癌
ER+乳腺癌包括两类:Luminal A型和Luminal B型,通过增殖相关基因以及HER2基因扩增和(或)过度表达区分两者。与HER2+型和三阴性乳腺癌相比,Luminal A型患者具有良好的预后并可获得长期生存,主要归因于抗雌激素内分泌治疗的有效性。内分泌治疗耐药是导致患者治疗失败的原因,而肿瘤内异质性是耐药性产生的主要原因之一。ER+乳腺癌中部分肿瘤细胞高表达KDM5A/B,激活KDM5去甲基化酶,造成转录组异质性高表达,使部分细胞在内分泌治疗前便具有对雌激素的抗性,最终产生耐药性[17]。ESR1突变则是ER+转移性乳腺癌对芳香化酶抑制剂产生耐药的原因之一[18]。STO-3试验显示,肿瘤组织内部ER表达异质性对内分泌治疗敏感性是一个独立的预测因子,高异质性ER+患者长期生存率显著降低[19]。
3.2 HER2+型乳腺癌
HER2+型乳腺癌约占所有乳腺癌患者的17%,与临床预后较差相关,抗HER2靶向药物的出现显著改善了该类患者的预后。然而在某些情况下肿瘤分类是复杂的[20],乳腺癌可以表现为混合表型。图1所示同一患者免疫组织化学染色含有HER2+的组织成分,但也含有HER2-的不同成分。这种混合表型给临床医师带来了挑战,抗HER2药物只能有效地靶向其中的一部分细胞。
3.3 Normal-like型乳腺癌
微阵列研究中该类乳腺癌命名是基于它们倾向于与正常乳腺上皮细胞紧密聚集[21]。目前尚不清楚这是乳腺癌一种独特的分子亚型,还是因为正常乳腺上皮细胞掺入其中而无法归类。
3.4 基底样和claudin-low型乳腺癌
基底样和claudin-low型代表三阴性乳腺癌亚群(免疫组织化学分类):ER-/PR-,ERBB2不扩增(HER2-)。Wetzels等[22]首先在免疫组织化学检测中描述了乳腺癌的基底细胞表型,多项基于转录组学的分子分型重新提到该种亚型存在[23]。基底样亚型通常HER2-且具有乳腺肌上皮细胞的某些特征,增殖活性高、预后差,约占乳腺癌的15%[24]。基底样乳腺癌与基于免疫组织化学定义的其他三阴性乳腺癌区别在于细胞角蛋白5/6和(或)表皮生长因子受体(epidermal growth factor receptor,EGFR)(HER1)的表达。Claudin-low型乳腺癌约占乳腺癌的10%,富集EMT和干细胞样和(或)肿瘤起始细胞的标志物[25],对标准化疗不敏感,无复发生存率和总生存率低。
3.5 乳腺癌临床分型与分子分型的对应性
尽管基因表达模式的乳腺癌分子分型在病理免疫组织化学分型基础上提供了乳腺癌分子生物学特征的进一步细分,但一项基于381例乳腺癌患者的免疫组织化学分型与基因分型对比研究[26]表明,基因分型与免疫组织化学分型之间仍存在一定差异:超过一半的ER+/PR+/HER2-免疫组织化学分型类似于预后差的基因亚型(Luminal B型、HER2+型、基底样和claudinlow型);39%的基因分型为HER2+型的乳腺癌患者免疫组织化学分型为HER2-亚群,而没有接受抗HER2治疗。HER2+型乳腺癌ER表达异质性最强,约56%阳性表达,而基底样和claudin-low型乳腺癌ER表达分别为17%和35%。一项基于400例乳腺癌患者的研究[24]同样表明,免疫组织化学分型中的Luminal A型中存在7%ER+/HER2+、5%ER-/HER2-和2%ER-/HER2+,Luminal B型存在20%的ER+/HER2+、7%的ER-/HER2-和1%的ER-/HER2+,HER2+型存在16%的ER+/HER2-和15%的ER-/HER2-,而三阴性乳腺癌中存在2%的ER+/HER2+、7%的ER+/HER2-和8%的ER-/HER2+。
3.6 三阴性乳腺癌异质性分型
与其他亚型相比,三阴性乳腺癌表现出更显著的基因不稳定性与异质性。2011年Lehmann等[27]将三阴性乳腺癌分为6类:基底样1型(basal-like 1,BL1),该部分肿瘤具有细胞周期信号增多和DNA损伤反应基因的特征以及高增殖潜能;基底样2型(basal-like 2,BL2),表现为生长因子受体和肌上皮标记高表达;间质型(mesenchymal,M)和间质干细胞型(mesenchymal stem-like,MSL),细胞分化和增殖信号通路相关基因高表达;免疫调节型(immunomodulatory,IM),免疫细胞丰富;管腔雄激素受体型(luminal androgen receptor,LAR),表现为雄激素受体信号通路高表达。此后,2015年Burstein等[28]、2016年Lehmann等[29]、2019年Jiang等[30]又进行了不同的研究与亚型划分(表1)。这些研究揭示了三阴性乳腺癌各亚型的特异性(表2),推动了该亚型的精准诊治。但是由于样本量的限制以及所研究人群的种族差异,对于三阴性乳腺癌异质性的全面揭示仍有很多工作要做。
4 肿瘤微环境异质性
乳腺癌组织由复杂的生态系统组成,癌细胞的发生、发展受到周围许多基质因子的影响[31]。通过对1 512例公共数据库中三阴性乳腺癌样本进行基因表达、拷贝数变异和免疫应答的分析,证明几乎每个三阴性乳腺癌分子亚型的肿瘤微环境异质性程度都超过基因组和转录组的多样性[30]。乳腺癌细胞分子亚型的异质性和肿瘤微环境的异质性共同铸造不同的基因表型、生物学行为和临床预后。
4.1 癌相关成纤维细胞(carcinoma-associated fibroblast,CAF)
CAF是肿瘤微环境中的关键组成部分,与乳腺癌的发生、发展密切相关。研究[32]报道,CAF细胞调控乳腺癌的侵袭性生物学行为,促进乳腺癌的复发和治疗抵抗。此外,CAF可引起肿瘤微环境中的免疫抑制状态,与抗PD-L1免疫治疗抵抗相关[33]。但关于CAF在人类肿瘤中的异质性特征还远未完全阐明。Mao等[34]根据CAF的来源对其进行了分类:①活化的常驻成纤维细胞;② 骨髓来源的间充质干细胞;③经历EMT的癌细胞;④ 其他未分类的。Pelon等[35]在乳腺癌转移淋巴结中发现4个CAF亚群(命名为CAF-S1到-S4),其中两个特殊的亚群CAF-S1和CAF-S4在转移性淋巴结中显著积聚,并与癌细胞侵袭有关,这些亚群通过不同方式促进转移,CAF-S1以CXCL12/TGF-β依赖的方式诱导癌细胞迁移和EMT的发生,具有收缩特性的CAF-S4则通过Notch介导的途径促进肿瘤细胞的运动,该研究进一步证实肿瘤组织中的CAF细胞是不同亚型细胞的集合体,对不同亚型CAF细胞的精确分型及分子调控特点的解析有助于未来特异性CAF靶向治疗药物的发展。

表1 三阴性乳腺癌分子分型Tab.1 Molecular typing of triple-negative breast cancer

表2 三阴性乳腺癌分子亚型特征Tab.2 Characteristics of triple-negative breast cancer molecular subtypes
4.2 肿瘤免疫微环境及相关免疫细胞异质性
研究[36]表明,不同分子亚型的乳腺癌具有不同的肿瘤微环境特点,以三阴性乳腺癌为例,基底样亚型肿瘤微环境富含代谢过程、低水平的基质和淋巴管生成特征,IM亚型中免疫信号表达水平高,M亚型中基质和代谢表达水平高,免疫信号表达水平低,而MSL亚型表现为高水平淋巴管生成和低水平代谢,LAR亚型表现为基质和代谢表达水平高,免疫信号表达水平低。Gruosso等[37]根据CD8+的肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的空间分布将肿瘤免疫细胞微环境分为3种亚型:完全炎症型(fully inflamed,FI)、间质受限(stroma restricted,SR)和边缘受限(margin restricted,MR)。BL亚型的免疫微环境为SR亚型,IM亚型的免疫微环境为FI,M、MSL和LAR亚型的表现为MR型。各亚型间肿瘤微环境中的主要免疫应答方式不同,BL和M亚型表现为免疫抑制,预后往往较差,LAR、MSL亚型为固有免疫应答,IM亚型则为较强的获得性免疫应答,这与IM亚型预后较好有关。IM亚型中免疫靶点最多,包括免疫激活性受体4-1BB、OX40、IL2-R和配体ICOS、CD40L以及免疫抑制性受体TIGIT、PD-1、CTLA4;其次为MSL亚型,包括GARP、CD39和CD73细胞外酶;M亚型、LAR亚型和BL亚型免疫靶点最少,M亚型的免疫抑制性受体为B7-H3和B7-H4,BL亚型免疫抑制靶点为B7-H4和CD47,LAR亚型的免疫靶点为GARP。染色体高度不稳定和染色体5q及15q区拷贝数丢失(包括MHC相关基因的丢失)的肿瘤表现出肿瘤微环境中免疫细胞的细胞毒活性降低,如BL亚型和M亚型,这可能是一种免疫逃逸机制。
三阴性乳腺癌亚型异质性与其肿瘤微环境异质性相似,显著的免疫特征和丰富的TIL水平提示较好的无复发生存率。高表达免疫信号和获得性免疫应答的分子亚型IM和肿瘤微环境亚型FI是“热肿瘤”,使用免疫检查点抑制剂治疗,效果较好。而大多数MSL、LAR亚型表现为免疫抑制,靶向调节性T细胞治疗是其特异性治疗方案。低表达免疫信号的M和MR亚型是“冷肿瘤”,免疫检查点抑制剂治疗往往无效(表3)[36]。

表3 肿瘤微环境各亚型的特点Tab.3 Characteristics of tumor microenvironment subtypes
5 总结与展望
乳腺癌是一种异质性疾病,对化疗具有不同的敏感性。乳腺癌亚型的多样性体现了肿瘤的异质性。在乳腺癌中存在不同类型的癌细胞群,这种异质性使疾病亚型的识别复杂化。研究表明,癌细胞间的相互作用及其与肿瘤微环境的相互作用对肿瘤的进展和侵袭具有重要影响。了解乳腺癌异质性,可以预测癌细胞对药物的反应、监测肿瘤进展、评估患者预后,可以为个体化治疗提供参考。

