基于nNOS途径的天麻素注射液改善甲基苯丙胺诱导大鼠神经毒性损伤的作用机制研究
薛凤麟 洪仕君 曾晓峰 杨根梦 周一卿 李利华


中图分类号 R971;R96 文献标志码 A 文章编号 1001-0408(2020)10-1171-08
DOI 10.6039/j.issn.1001-0408.2020.10.04
摘 要 目的:研究天麻素注射液通过神经型一氧化氮合酶(nNOS)途径改善甲基苯丙胺诱导大鼠神经毒性损伤的作用机制。方法:将SD大鼠随机分为对照组、甲基苯丙胺组、常规剂量天麻素组、加倍剂量天麻素组、阴性对照(NC)腺病毒组、NC腺病毒+甲基苯丙胺组、NC腺病毒+天麻素组、nNOS腺病毒+天麻素组,每组10只。对照组大鼠腹腔注射生理盐水,每日2次;甲基苯丙胺组大鼠腹腔注射甲基苯丙胺(7.5 mg/kg),每日2次;常规剂量、加倍剂量天麻素组大鼠提前30 min分别腹腔注射不同剂量天麻素注射液(10、20 mg/kg),每日1次,再按甲基苯丙胺组方法注射甲基苯丙胺。NC腺病毒组大鼠在纹状体一次性注射NC腺病毒(4.8×107 PFU)3 μL+腹腔注射生理盐水,每日2次;NC腺病毒+甲基苯丙胺组大鼠同法注射NC腺病毒,然后腹腔注射甲基苯丙胺(7.5 mg/kg),每日2次;NC腺病毒+天麻素组大鼠同法注射NC腺病毒+甲基苯丙胺,同时在注射甲基苯丙胺之前30 min腹腔注射天麻素注射液(20 mg/kg),每日1次;nNOS腺病毒+天麻素组大鼠同法注射nNOS腺病毒和甲基苯丙胺,同时在注射甲基苯丙胺之前30 min腹腔注射天麻素注射液(20 mg/kg),每日1次。各组大鼠每次腹腔注射体积均为1 mL/100 g,均连续注射给药3 d。观察大鼠刻板行为并评分,检测大鼠纹状体的细胞凋亡率、凋亡相关因子[Bcl-2、Bax、活化胱天蛋白酶-3(Cleaved caspase-3)]蛋白表达量、氧化应激相关因子[丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)]水平,以及一氧化氮(NO)水平和nNOS蛋白表达量。结果:与对照组比较,甲基苯丙胺组大鼠的刻板行为评分和纹状体的细胞凋亡率、Bax、Cleaved caspase-3、nNOS蛋白表达量及MDA、NO水平均显著升高,Bcl-2蛋白表达量及SOD、GPx水平均显著降低(P<0.05或P<0.01);与甲基苯丙胺组比较,常规剂量、加倍剂量天麻素组大鼠的刻板行为评分和纹状体的细胞凋亡率、Bax、Cleaved caspase-3、nNOS蛋白表达量及MDA、NO水平均显著降低,Bcl-2蛋白表达量及SOD、GPx水平均显著升高,且加倍剂量天麻素组大部分上述指标均显著优于常规剂量组(P<0.05或P<0.01)。与NC腺病毒组比较,NC腺病毒+甲基苯丙胺组大鼠纹状体的细胞凋亡率、Bax、Cleaved caspase-3、nNOS蛋白表达量及MDA、NO水平均显著升高,Bcl-2蛋白表达量及SOD、GPx水平均显著降低(P<0.01);与NC腺病毒+甲基苯丙胺组比较,NC腺病毒+天麻素组大鼠纹状体中细胞凋亡率,Bax、Cleaved caspase-3、nNOS蛋白表达量以及MDA、NO水平均显著降低,Bcl-2蛋白表达量以及SOD、GPx水平均显著升高(P<0.01);与NC腺病毒+天麻素组比较,nNOS腺病毒+天麻素组大鼠纹状体中的细胞凋亡率、Bax、Cleaved caspase-3、nNOS蛋白表达量及MDA、NO水平均显著升高,Bcl-2蛋白表达量及SOD、GPx水平均显著降低(P<0.01)。结论:天麻素注射液对甲基苯丙胺诱导的大鼠神经毒性损伤具有明显的保护作用,且这一作用与抑制nNOS介导的细胞凋亡及氧化应激反应有关。
關键词 甲基苯丙胺;天麻素注射液;神经型一氧化氮合酶;细胞凋亡;氧化应激;机制
Study on the Mechanism of Improvement Effects of Gastrodin Injection on Methamphetamine Induced Neurotoxic Damage in Rats via nNOS Pathway
XUE Fenglin1,HONG Shijun2,ZENG Xiaofeng2,YANG Genmeng2,ZHOU Yiqing2,LI Lihua2(1. Dept. of Pathology, the First Affiliated Hospital of Kunming Medical University, Kunming 650032, China; 2. College of Forensic Medicine, Kunming Medical University, Kunming 650500, China)
ABSTRACT OBJECTIVE: To study the mechanism of improvement effects of Gastrodin injection on methamphetamine induced neurotoxic damage in rats via nNOS pathway. METHODS: SD rats were randomly divided into control group, methamphetamine group, regular-dose of gastrodin group, double-dose of gastrodin group, negative control (NC) adenovirus group, NC adenovirus+methamphetamine group, NC adenovirus+gastrodin group and nNOS adenovirus+gastrodin group, with 10 rats in each group. Control group was given normal saline intraperitoneally, twice a day. Methamphetamine group was given methamphetamine intraperitoneally (7.5 mg/kg), twice a day. Regular-dose and double-dose of gastrodin groups were respectively given different doses of Gastrodin injection (10, 20 mg/kg) intraperitoneally 30 min earlier, once a day, and then given methamphetamine intraperitoneally by the same way as methamphetamine group. NC adenovirus group was given NC adenovirus (4.8×107 PFU) 3 μL once in the striatum and normal saline intraperitoneally, twice a day. NC adenovirus+methamphetamine group was given NC adenovirus by the same way and methamphetamine (7.5 mg/kg) intraperitoneally, twice a day. NC adenovirus+gastrodin group was given NC adenovirus+methamphetamine by the same way, meanwhile given Gastrodin injection intraperitoneally(20 mg/kg) 30 min before methamphetamine, once a day. nNOS adenovirus+gastrodin group was given nNOS adenovirus and methamphetamine by the same way, meanwhile given Gastrodin injection intraperitoneally(20 mg/kg) 30 min before methamphetamine, once a day. Each group was given relevant medicine intraperitoneally 1 mL/100 g, for consecutive 3 days. The stereotyped behavior of rats were observed and scored; the apoptotic rate, the protein expression of apoptotic factors (Bcl-2, Bax, Cleaved caspase-3), the levels of oxidative stress factors (MDA, SOD, GPx) and NO, the protein expression of nNOS were detected. RESULTS: Compared with control group, stereotyped behavior score, cell apoptosis rate of striatum, protein expression of Bax, Cleaved caspase-3 and nNOS, the levels of MDA and NO were increased significantly in methamphetamine group; while the protein expression of Bcl-2 and the levels of SOD and GPx were decreased significantly (P<0.05 or P<0.01). Compared with methamphetamine group, stereotyped behavior score, cell apoptosis rate of striatum, protein expression of Bax, Cleaved caspase-3 and nNOS, the levels of MDA and NO were decreased significantly in regular-dose and double-dose of gastrodin groups; while the protein expression of Bcl-2, the levels of SOD and GPx were increased significantly, and most above indexes in double-dose of gastradin group were better than regular-dose of gastrodin group (P<0.05 or P<0.01). Compared with NC adenovirus group, cell apoptosis rate of striatum, protein expression of Bax, Cleaved caspase-3 and nNOS, the levels of MDA and NO were increased significantly in NC adenovirus+methamphetamine group; while the protein expression of Bcl-2, the levels of SOD and GPx were decreased significantly (P<0.01). Compared with NC adenovirus+methamphetamine group, cell apoptosis rate of striatum, protein expression of Bax, Cleaved caspase-3 and nNOS, the levels of MDA and NO were decreased significantly in NC adenovirus+gastrodin group; while the protein expression of Bcl-2, the levels of SOD and GPx were increased significantly (P<0.01). Compared with NC adenovirus+gastrodin group, cell apoptosis rate of striatum, protein expression of Bax, Cleaved caspase-3 and nNOS, the levels of MDA and NO were increased significantly in nNOS adenovirus+gastrodin group; while the protein expression of Bcl-2, the levels of SOD and GPx were decreased significantly (P<0.01). CONCLUSIONS: Gastrodin injection can protect rats against neurotoxic damage induced by methamphetamine, and the effect is related to the inhibition of nNOS-mediated apoptosis and oxidative stress.
KEYWORDS Methamphetamine; Gastrodin injection; nNOS; Cell apoptosis; Oxidative stress; Mechanism
甲基苯丙胺俗称“冰毒”,是在世界范围内广泛使用、对公共卫生造成严重危害的毒品之一,属于苯丙胺类神经兴奋剂,具有神经毒性。近年来的研究证实,甲基苯丙胺的神经毒性与多种机制有关,其中氧化应激反应及细胞凋亡途径是被广泛认可的机制[1-3]。纹状体是目前与甲基苯丙胺神经毒性相关性研究最集中的脑区[4],徐静涛等[5]通过动物实验证实,甲基苯丙胺能够使大鼠纹状体中的氧化应激及细胞凋亡加剧,增加神经型一氧化氮合酶(nNOS)的表达,而给予nNOS抑制剂能够减轻甲基苯丙胺引起的氧化应激及细胞凋亡,表明nNOS激活在甲基苯丙胺的神经毒性中起到关键作用,抑制nNOS则是减轻其神经毒性的有效靶点。
天麻素是我国传统名贵药材天麻中的活性成分,现代药理学研究证实,天麻素能够扩张椎基底动脉、增加脑血流量,并可改善脑缺血、头晕等症状[6-7]。章正祥等[8]的研究发现,在血管舒缩功能异常模型大鼠中,天麻素对其内皮型一氧化氮合酶(eNOS)及诱导型一氧化氮合酶(iNOS)的表达均具有抑制作用,但天麻素是否能够抑制nNOS的表达并起到神经保护作用尚未见报道。为此,本研究在甲基苯丙胺诱导大鼠神经毒性损伤的基础上,采用以现代制剂手段开发的天麻素单体注射剂,即天麻素注射液进行干预,拟探索天麻素注射液通过nNOS途径减轻甲基苯丙胺诱导的大鼠神经毒性损伤的作用机制,为临床治疗甲基苯丙胺引起的神经损害提供新思路。
1 材料
1.1 仪器
90i型正置显微镜(日本Nikon公司);ChemiDoc MP型凝胶成像仪(美国Bio-Rad公司);TGL16M型高速冷冻离心机(湖南恒诺仪器设备有限公司);EPS-100型电泳仪(上海天能科技有限公司);Synergy2型多功能酶标仪(美国BioTek公司);DW-2000/2000D型脑立体定位仪(成都泰盟软件有限公司)。
1.2 药品、病毒与试剂
天麻素注射液(西安博森生物制药有限责任公司,批号:2018C92E,规格:1 mL ∶ 0.1 g);盐酸甲基苯丙胺对照品(中国食品药品检定研究院,批号:171218- 201806,纯度:>99%);过表达nNOS的重组腺病毒、陰性对照(NC)腺病毒(上海闪晶分子生物科技有限公司,病毒滴度均为1.6×1010 PFU/mL);丙二醛(MDA)检测试剂盒(硫代巴比妥酸法)、超氧化物歧化酶(SOD)检测试剂盒(羟胺法)、谷胱甘肽过氧化物酶(GPx)检测试剂盒(微板法)、一氧化氮(NO)检测试剂盒(比色法)(南京建成生物工程研究所,批号分别为A003-1-2、A001-3-2、A005-1-2、A012-1-2);兔Bax单克隆抗体、兔Bcl-2单克隆抗体、兔活化胱天蛋白酶3(Cleaved caspase-3)单克隆抗体、兔nNOS单克隆抗体、兔β-肌动蛋白(β-actin)单克隆抗体(英国Abcam公司,批号分别为ab182733、ab185002、ab32042、ab76067、ab179467);辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗(武汉艾美捷科技有限公司,批号:6170-05);TUNEL染色试剂盒、RIPA裂解液、BCA蛋白定量试剂盒、上样缓冲液、转膜缓冲液、ECL化学发光试剂盒(上海碧云天生物技术有限公司);其余试剂均为分析纯或实验室常用规格,生理盐水为自制,水为去离子水。
1.3 动物
SPF成年SD大鼠,雄性,体质量250~300 g,购自昆明医科大学实验动物学部,动物生产许可证号:SCXK(滇)K2015-0002。动物均自由饮水摄食,自然节律光照。
2 方法
2.1 分组、造模与给药
2.1.1 天麻素注射液对甲基苯丙胺诱导大鼠神经毒性损伤的改善作用考察 将大鼠随机分为对照组、甲基苯丙胺组、常规剂量天麻素组、加倍剂量天麻素组,每组10只。对照组大鼠腹腔注射生理盐水,每日2次;甲基苯丙胺组大鼠腹腔注射甲基苯丙胺(7.5 mg/kg,用生理盐水制成药液;剂量参照徐静涛等[5]的研究设定),每日2次;常规剂量、加倍剂量天麻素组大鼠提前30 min腹腔注射天麻素注射液(10、20 mg/kg,用生理盐水制成药液;剂量参照吴锋等[9]的研究设定),每日1次,然后按照甲基苯丙胺组方法腹腔注射甲基苯丙胺。各组大鼠每次腹腔注射给药体积均为1 mL/100 g,均连续注射给药3 d。
2.1.2 nNOS在天麻素注射液改善甲基苯丙胺诱导大鼠神经毒性损伤中的作用考察 将大鼠随机分为NC腺病毒组、NC腺病毒+甲基苯丙胺组、NC腺病毒+天麻素组、nNOS腺病毒+天麻素组,每组10只;同时以“2.1.1”项下对照组大鼠作为对照。NC腺病毒组大鼠根据脑立体定位图谱定位至纹状体,用微量进样器一次性注射NC腺病毒3 μL(病毒数量:4.8×107 PFU,以下各组相同),然后腹腔注射生理盐水,每日2次;NC腺病毒+甲基苯丙胺组大鼠在纹状体一次性注射NC腺病毒3 μL,然后腹腔注射甲基苯丙胺(7.5 mg/kg),每日2次;NC腺病毒+天麻素组大鼠在纹状体一次性注射NC腺病毒3 μL,然后提前30 min腹腔注射天麻素注射液(20 mg/kg),每日1次,再腹腔注射甲基苯丙胺(7.5 mg/kg),每日2次;nNOS腺病毒+天麻素组大鼠在纹状体一次性注射nNOS腺病毒3 μL,然后提前30 min腹腔注射天麻素注射液(20 mg/kg),每日1次,再腹腔注射甲基苯丙胺(7.5 mg/kg),每日2次。甲基苯丙胺、天麻素注射液的药液配制方法及腹腔注射给药体积均同“2.1.1”项下方法,均连续注射给药3 d。
2.2 大鼠刻板行为评价
评价“2.1.1”项下各组大鼠的刻板行为。每次注射完甲基苯丙胺后(对照组为注射生理盐水后),立刻观察各组大鼠的行为,并按文献标准[5]进行评分:大鼠静止不动或几乎没有活动,记为0分;大鼠正常活动,偶有向前运动,记为1分;大鼠活动且伴有频繁向前探索行为,记为2分;大鼠活动且伴有持续向前探索行为,记为3分;大鼠出现重复抬头、摇头或旋转的背腹运动,记为4分;大鼠出现迅速抬头、摇头或旋转的背腹运动,记为5分。得分越高,则表明大鼠刻板行为越严重。
2.3 大鼠纹状体标本采集
在“2.1.1”“2.1.2”项下各组大鼠给药完毕并末次观察“2.1.1”项下各组大鼠的刻板行为后,处死并剖取其脑组织中的纹状体。一侧脑半球的纹状体经4%多聚甲醛溶液固定、石蜡包埋后制作切片,室温下保存;另一侧脑半球的纹状体用液氮冷冻30 min后,置于-80 ℃条件下保存。
2.4 大鼠纹状体细胞的凋亡率检测
采用TUNEL染色法进行检测。取“2.3”项下室温保存的纹状体切片,采用TUNEL染色试剂盒进行染色,以二甲苯封片后在显微镜下观察,随机选择3个视野,并记录TUNEL阳性细胞(镜下阳性细胞呈棕黄色)总数,并计算细胞凋亡率:细胞凋亡率=TUNEL阳性细胞数/全部细胞数×100%。
2.5 大鼠纹状体中MDA、SOD、GPx、NO水平检测
取“2.3”项下于-80 ℃下保存的大鼠纹状体组织适量,用RIPA裂解液进行裂解、提取蛋白,用BCA蛋白定量试剂盒测定蛋白含量。然后,按相应试剂盒说明书操作,采用多功能酶标仪分别检测MDA、SOD、GPx、NO水平。
2.6 大鼠纹状体中Bax、Bcl-2、Cleaved caspase-3、nNOS蛋白表达量检测
采用Western blotting法进行检测。取“2.3”项下于-80 ℃下保存的大鼠纹状体组织适量,按“2.5”项下方法进行裂解、蛋白提取和定量。取蛋白样本30 μg,与上样缓冲液混合,然后煮沸使蛋白变性,采用十二烷基磺酸钠-聚丙烯酰胺凝胶进行电泳,再电转膜至硝酸纤维素膜上。将膜以5%脱脂牛奶在室温下封闭2 h后,分别加入Bax、Bcl-2、Cleaved caspase-3、nNOS一抗(稀释度均为1 ∶ 1 000)以及β-actin抗体(稀释度为1 ∶ 5 000),于4 ℃孵育过夜;次日加入二抗(稀释度为1 ∶ 2 000),在室溫下孵育1 h。加入ECL化学发光试剂后,采用凝胶成像仪进行曝光,采用Image J V1.8.0软件分析蛋白条带灰度值,以目标蛋白与内参β-actin的灰度值比值作为目标蛋白的表达量。
2.7 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料采用x±s表示,经方差齐性检查符合方差齐性后,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 天麻素注射液对大鼠刻板行为的影响
与对照组比较,甲基苯丙胺组大鼠的刻板行为评分均显著升高(P<0.05)。与甲基苯丙胺组比较,常规剂量、加倍剂量天麻素组大鼠的刻板行为评分均显著降低(P<0.05),且加倍剂量天麻素组大鼠在第2次、第5次注射甲基苯丙胺后即刻的刻板行为评分均显著低于常规剂量天麻素组(P<0.05)。天麻素注射液对大鼠刻板行为的影响见图1。
3.2 天麻素注射液对大鼠纹状体中NO水平和nNOS蛋白表达量的影响
与对照组比较,甲基苯丙胺组大鼠纹状体中NO水平和nNOS蛋白表达量均显著升高(P<0.01)。与甲基苯丙胺组比较,常规剂量、加倍剂量天麻素组大鼠纹状体中NO水平和nNOS蛋白表达量均显著降低(P<0.01);且加倍剂量天麻素组NO水平显著低于常规剂量天麻素组(P<0.01),但两组nNOS蛋白表达量比较差异无统计学意义(P>0.05)。天麻素注射液对大鼠纹状体中nNOS蛋白表达影响的电泳图见图2,对NO水平和nNOS蛋白表达量的影响见表1。
3.3 天麻素注射液对纹状体中细胞凋亡情况的影响
与对照组比较,甲基苯丙胺组大鼠纹状体中的TUNEL阳性细胞明显增多,其细胞凋亡率及Bax、Cleaved caspase-3蛋白的表达量均显著升高,Bcl-2蛋白的表达量显著降低(P<0.01)。与甲基苯丙胺组比较,常规剂量、加倍剂量天麻素组大鼠纹状体中的TUNEL阳性细胞均有所减少,其细胞凋亡率及Bax、Cleaved caspase-3蛋白的表达量均显著降低,Bcl-2蛋白的表达量均显著升高(P<0.01);且加倍剂量天麻素组的细胞凋亡率及Bax、Cleaved caspase-3蛋白的表达量均显著低于常规剂量天麻素组(P<0.05),但两组Bcl-2蛋白的表达量比较差异无统计学意义(P>0.05)。天麻素注射液对大鼠纹状体中细胞凋亡影响的显微图见图3,对凋亡相关因子蛋白表达影响的电泳图见图4,对细胞凋亡率及凋亡相关因子蛋白表达量的影响见表2。
3.4 天麻素注射液对大鼠纹状体中氧化应激因子水平的影响
与对照组比较,甲基苯丙胺组大鼠纹状体中MDA水平显著升高,SOD、GPx水平均显著降低(P<0.01)。与甲基苯丙胺组比较,常规剂量、加倍剂量天麻素组大鼠纹状体中MDA水平均显著降低,SOD、GPx水平均显著升高(P<0.05或P<0.01);且加倍剂量天麻素组大鼠纹状体中MDA水平显著低于常规剂量天麻素组,SOD、GPx水平均显著高于常规剂量天麻素组(P<0.05)。天麻素注射液对大鼠纹状体中氧化应激相关因子水平的影响见表3。
注:与对照组比较,**P<0.01;与甲基苯丙胺组比较,#P<0.05,##P<0.01;与常规剂量天麻素组比较,ΔP<0.05
Note:vs. control group,**P<0.01;vs. methamphetamine group,#P<0.05,##P<0.01;vs. regular-dose of gastrodin group,ΔP<0.05
3.5 天麻素注射液对过表达nNOS大鼠纹状体中NO水平及nNOS蛋白表達量的影响
与对照组比较,NC腺病毒组大鼠纹状体中NO水平和nNOS蛋白表达量差异无统计学意义(P>0.05)。与NC腺病毒组比较,NC腺病毒+甲基苯丙胺组大鼠纹状体中NO水平和nNOS蛋白表达量均显著升高(P<0.01)。与NC腺病毒+甲基苯丙胺组比较,NC腺病毒+天麻素组大鼠纹状体中NO水平和nNOS蛋白表达量均显著降低(P<0.01)。与NC腺病毒+天麻素组比较,nNOS腺病毒+天麻素组大鼠纹状体中NO水平和nNOS蛋白表达量均显著升高(P<0.01)。天麻素注射液对过表达nNOS大鼠纹状体中nNOS蛋白表达影响的电泳图见图5,对NO水平和nNOS蛋白表达量的影响见表4。
注:与NC腺病毒组比较,**P<0.01;与NC腺病毒+甲基苯丙胺组比较,##P<0.01;与NC腺病毒+天麻素组比较,ΔΔP<0.01
Note:vs. NC adenovirus group,**P<0.01;vs. NC adenovirus+methamphetamine group,##P<0.01;vs. NC adenovirus+gastrodin group,ΔΔP<0.01
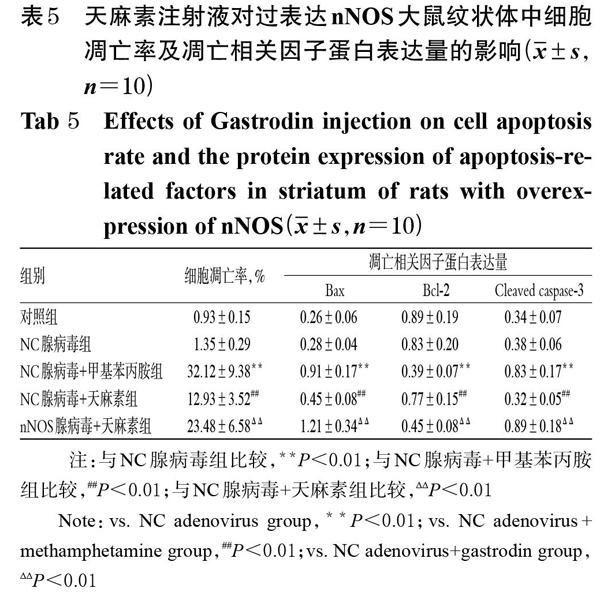
3.6 天麻素注射液对过表达nNOS大鼠纹状体中细胞凋亡情况和氧化应激相关因子水平的影响
与对照组比较,NC腺病毒组大鼠纹状体中的TUNEL阳性细胞数量相当,其细胞凋亡率,Bax、Bcl-2、Cleaved caspase-3蛋白表达量以及MDA、SOD、GPx水平差异均无统计学意义(P>0.05)。与NC腺病毒组比较,NC腺病毒+甲基苯丙胺组大鼠纹状体中的TUNEL阳性细胞明显增多,其细胞凋亡率,Bax、Cleaved caspase-3蛋白表达量以及MDA水平均显著升高,Bcl-2蛋白表达量以及SOD、GPx水平均显著降低(P<0.01)。与NC腺病毒+甲基苯丙胺组比较,NC腺病毒+天麻素组大鼠纹状体中的TUNEL阳性细胞有所减少,其细胞凋亡率,Bax、Cleaved caspase-3蛋白表达量以及MDA水平均显著降低,Bcl-2蛋白表达量以及SOD、GPx水平均显著升高(P<0.01)。与NC腺病毒+天麻素组比较,nNOS腺病毒+天麻素组大鼠纹状体中的TUNEL阳性细胞明显增多,其细胞凋亡率,Bax、Cleaved caspase-3蛋白表达量及MDA水平均显著升高,Bcl-2蛋白表达量以及SOD、GPx水平均显著降低(P<0.01)。天麻素注射液对过表达nNOS大鼠纹状体中细胞凋亡影响的显微图见图6,对Bax、Bcl-2、Cleaved caspase-3蛋白表达影响的电泳图见图7,对细胞凋亡率及凋亡相关因子蛋白表达量的影响见表5,对氧化应激相关因子水平的影响见表6。
4 讨论
甲基苯丙胺是一类新型合成毒品,不仅会产生药物依赖性和成瘾性,还会产生神经毒性,引起神经功能损害。纹状体是神经系统中与甲基苯丙胺作用关系最为 密切的脑区,多项研究证实,甲基苯丙胺能够引起纹状体中的神经递质改变、细胞凋亡增加及氧化应激反应激活[10-12]。nNOS是主要分布在中枢神经系统内的一氧化氮合酶,能够催化精氨酸分解并产生NO:在正常生理条件下,NO能够起到神经递质的作用,调节神经元的可塑性及学习记忆过程;而在NO持续大量产生的病理条件下,NO可以成为有活性的自由基,引起细胞凋亡及氧化应激反应的激活[5]。已有动物实验证实,甲基苯丙胺能够升高纹状体中的细胞凋亡率、氧化应激产物水平及nNOS表达量;而在使用nNOS抑制剂后,细胞凋亡率及氧化应激产物水平均降低[5]。本研究采用与该研究相同的方法注射甲基苯丙胺后发现,大鼠纹状体中NO水平和nNOS蛋白表达量均显著升高,与该研究结果一致。这表明纹状体中nNOS的过度激活与甲基苯丙胺诱导的神经毒性密切相关。
天麻素是从中药材天麻中分离提取的活性成分,已经被证实在大脑、心肌、肝脏等组织中具有抗细胞凋亡及抗氧化作用[13-15]。有研究报道,天麻素对血管舒缩功能异常模型大鼠的NO通路具有抑制作用,能显著下调eNOS和iNOS的表达[8]。基于此,本研究将天麻素用于甲基苯丙胺诱导的神经毒性损伤模型大鼠,结果显示,腹腔注射不同剂量天麻素注射液后,大鼠纹状体中NO水平和nNOS蛋白表达量均显著降低。这说明天麻素注射液对甲基苯丙胺引起的nNOS激活具有抑制作用。
nNOS激活后可导致NO大量产生,后者能够起到促凋亡及促氧化应激的作用:其促凋亡作用与调控抗凋亡因子Bcl-2及促凋亡因子Bax、Cleaved caspase-3的表达有关[16];其促氧化应激作用与自身的氧化活性有关,能够直接造成氧化产物MDA生成以及抗氧化酶SOD、GPx消耗增加[17-18]。本研究通过进一步考察了nNOS下游凋亡相关因子及氧化应激相关因子的变化可知,甲基苯丙胺组大鼠纹状体中的细胞凋亡率,Bax、Cleaved caspase-3蛋白表达量以及MDA水平均显著升高,而Bcl-2蛋白表达量及SOD、GPx水平均显著降低,这与以往其他学者报道的甲基苯丙胺促进细胞凋亡及氧化应激的结果[10-12]吻合,也与甲基苯丙胺致nNOS过度激活的生物学活性吻合。在腹腔注射不同剂量天麻素注射液后,大鼠纹状体中的细胞凋亡率,Bax、Cleaved caspase-3蛋白表达量以及MDA的水平均显著降低,而Bcl-2蛋白表达量及SOD、GPx水平均显著升高,说明天麻素注射液对甲基苯丙胺引起的细胞凋亡及氧化应激反应过度激活均具有抑制作用,进而也提示该注射液对甲基苯丙胺诱导的大鼠神经毒性损伤具有保护作用。
在证实天麻素注射液的神经保护作用及其对nNOS的调控作用后,本研究通过腺病毒注射的方式进一步探讨了天麻素注射液的上述神经保护作用是否与抑制nNOS直接相关。结果显示,在大鼠纹状体中注射NC腺病毒后,与对照组比较,其纹状体的细胞凋亡率、凋亡相关因子表达及氧化应激均无明显变化,说明NC腺病毒不会影响大鼠纹状体中的細胞凋亡及氧化应激反应;而在纹状体中注射NC腺病毒后继续腹腔注射甲基苯丙胺后发现,NC腺病毒+甲基苯丙胺组大鼠纹状体的细胞凋亡率、凋亡相关因子表达及氧化应激相关因子的变化趋势与甲基苯丙胺组一致,NC腺病毒+天麻素组大鼠纹状体中细胞凋亡率、凋亡相关因子表达及氧化应激相关因子的变化趋势与加倍剂量天麻素组一致,说明NC腺病毒的注射不会影响甲基苯丙胺的神经毒性损伤作用以及天麻素注射液的神经保护作用。而nNOS腺病毒+天麻素组大鼠纹状体中NO水平及nNOS蛋白表达量均显著高于NC腺病毒+天麻素组,说明nNOS腺病毒注射后能够上调nNOS的表达并拮抗天麻素注射液对nNOS过表达的抑制作用;进一步观察细胞凋亡率、凋亡相关因子及氧化应激相关因子的变化可知,nNOS腺病毒+天麻素组大鼠纹状体中的细胞凋亡率,Bax、Cleaved caspase-3蛋白表达量以及MDA水平均显著升高,而Bcl-2蛋白表达量及SOD、GPx水平均显著降低,说明上调nNOS的表达后,天麻素注射液的神经保护作用明显减弱,进而证明天麻素注射液的神经保护作用与抑制nNOS的表达直接相关。
综上所述,天麻素注射液对甲基苯丙胺诱导的大鼠神经毒性损伤具有明显的保护作用,且这一作用与抑制nNOS介导的细胞凋亡及氧化应激反应有关。
参考文献
[ 1 ] NGUYEN PT,DANG DK,TRAN HQ,et al. Methiopropamine,a methamphetamine analogue,produces neurotoxicity via dopamine receptors[J]. Chem Biol Interact,2019. DOI:10.1016/j.cbi.2019.03.017.
[ 2 ] SHARIKOVA AV,QUAYE E,PARK JY,et al. Methamphetamine induces apoptosis of microglia via the intrinsic mitochondrial-dependent pathway[J]. J Neuroimmune Ph- armacol,2018,13(3):396-411.
[ 3 ] SHIN EJ,TRAN HQ,NGUYEN PT,et al. Role of mitochondria in methamphetamine-induced dopaminergic neurotoxicity:involvement in oxidative stress,neuroinflammation,and pro-apoptosis:a review[J]. Neurochem Res,2018,43(1):66-78.
[ 4 ] XIE XL,HE JT,WANG ZT,et al. Lactulose attenuates METH-induced neurotoxicity by alleviating the impaired autophagy,stabilizing the perturbed antioxidant system and suppressing apoptosis in rat striatum[J]. Toxicol Lett,2018. DOI:10.1016/j.toxlet.2018.03.015.
[ 5 ] 徐静涛,张付,杨幸怡,等.甲基苯丙胺所致的大鼠神经毒性损伤及nNOS抑制剂的保护作用[J].中国药理学通报,2014,30(8):1101-1106.
[ 6 ] 马聪,韩莎莎,刘贤秀.天麻素胶囊联合氟桂利嗪对椎基底动脉迂曲扩张症合并后循环缺血性眩晕患者血管内皮功能、 hs-CRP及FIB的影响[J].现代中西医结合杂志,2019,28(28):3163-3166.
[ 7 ] 徐浩锋,黄黎,史东明,等.天麻素对缺血性眩晕大鼠脑损伤保护的作用研究[J].中华危重症医学杂志:电子版,2017,10(4):261-263.
[ 8 ] 章正祥,曹克刚,王春丹,等.天麻素对多巴胺、硝酸甘油诱发的血管舒缩异常模型大鼠神经肽、一氧化氮系统的影响[J].中华中医药学刊,2013,31(7):1514-1517.
[ 9 ] 吴锋,李怀斌,赵健,等.电针结合天麻素对局灶性脑缺血大鼠神经功能、额叶皮质勿动蛋白A及其受体表达的影响[J].针刺研究,2016,41(1):65-69.
[10] SABRINI S,WANG GY,LIN JC,et al. Methamphetamine use and cognitive function:a systematic review of neuroimaging research[J]. Drug Alcohol Depend,2019.DOI:10.1016/j.drugalcdep.2018.08.041.
[11] CHEN C,HSU FC,LI CW,et al. Structural,functional,and neurochemical neuroimaging of methamphetamine-associated psychosis:a systematic review[J]. Psychiatry Res:Neuroimaging,2019. DOI:10.1016/j.pscychresns.2019.
06.002.
[12] ZOUBKOV? H,TOM??KOV? A,NOHEJLOV? K,et al. Prenatal exposure tomethamphetamine:up-regulation of brain receptor genes[J]. Front Neurosci,2019. DOI:10.3389/fnins.2019.00771.
[13] 黄春华,韦玲芝,钟良,等.天麻素对缺氧缺糖星形胶质细胞氧化损伤的影响[J].中国老年学杂志,2019,39(9):2211-2215.
[14] 张玲,杨萍,姜永良,等.天麻素通过蛋白激酶B/p38丝裂原活化蛋白激酶信号通路抑制H9c2心肌细胞凋亡[J].解剖学报,2019,50(1):40-48.
[15] 袁博,瞿思铭,吴朴,等.天麻素对小鼠肝脏缺血再灌注损伤的保护作用[J].中华肝胆外科杂志,2018,24(9):625-629.
[16] DAWSON TM,DAWSON VL. Nitric oxide signaling in neurodegeneration and cell death[J]. Adv Pharmacol,2018. DOI:10.1016/bs.apha.2017.09.003.
[17] GER?NIMO-OLVERA C,TRIST?N-L?PEZ L,MART- ?NEZ-LAZCANO JC,et al. Striatal protection in nnos knock-out mice after quinolinic acid-induced oxidative damage[J]. Neurochem Res,2019,44(2):421-427.
[18] ZHU X,DONG J,HAN B,et al. Neuronal nitric oxide synthase contributes to PTZ kindling epilepsy-induced hippocampal endoplasmic reticulum stress and oxidative damage[J]. Front Cell Neurosci,2017. DOI:10.3389/fncel.2017.00377.
(收稿日期:2019-09-23 修回日期:2020-03-31)
(編辑:段思怡)

