复合酶法辅助提取无患子总皂苷的工艺
余美琼,朱金环 ,杨金杯,陆文敬,陈玲玲
(福建技术师范学院海洋与生化工程学院,福建福清 350300)
无患子(Sapindus mukorossi Gaertn.)又名油患子、油罗树和洗手果,属于亚热带植物,原产我国长江流域以南及中南半岛、印度和日本.在我国主要分布在淮河流域以南各省(广东、福建、浙江、广西、浙江等)的丘陵山区[1,2].无患子提取液在中国传统文化中常常被用来清洗头发和身体,《本草纲目》中记载用无患子浸提液洗发去头屑、洗脸增白祛斑.无患子皂苷是无患子中重要的活性成分之一,主要存在于果实部位,是一种天然的非离子型表面活性剂[3],具有良好的起泡和去污性能.无患子皂苷是很好的农药乳化剂[4].药理研究表明,无患子果皮所含皂苷成分具有抗菌作用[5]、抑制乳腺癌作用[6]等多种生物活性.
目前,无患子总皂苷的提取方法很多,如水溶剂减压提取[7]、乙醇浸提[8]、丙酮浸提[9]、复合酶法提取[10]、超声波提取[11]、大孔树脂吸附提取[12]、水提醇沉[13]等等.但现有无患子总皂苷提取方法普遍存在提取步骤多、耗时长、能耗高、提取率低等问题,有待进一步研究.笔者在前期分别采用乙醇浸提法、乙醇-超声提取法提取无患子总皂苷,在最佳提取条件下,提取率分别为 5.67% 和 7.02% ,提取效果不佳.酶法辅助提取是近年来用于植物功能性成分提取的一项生物工程技术[14],是利用纤维素酶、果胶酶、蛋白酶等处理植物原料后,将细胞壁内的蛋白、果胶等酶解掉,使得目标物得到纯化,具有操作时间短、成本低、作用条件温和等优点.复合酶集合了纤维素酶和果胶酶,两种酶共同发挥作用,破坏植物组织细胞壁的致密性[15],改变细胞壁的通透性[16],可以有效降解细胞壁及细胞间质中的果胶、纤维素等,利于活性成分溶出,提取效果明显优于单独使用纤维素酶、果胶酶[17].考虑到无患子假种皮细胞壁组成主要为纤维素和果胶质,基于酶具有高效性和特异性.本研究采用纤维素酶和果胶酶组成的复合酶制剂,辅助提取无患子总皂苷.
1 实验部分
1.1 材料、试剂和仪器
无患子粉末(福建源华林业生物科技有限公司);纤维素酶(10万U/g)、果胶酶(5万U/g),均购自宁夏和氏璧生物技术有限公司;齐墩果酸标准品98%(HPLC级,上海如吉生物科技发展有限公司);香草醛、高氯酸、冰醋酸、无水乙醇、甲醇,均为分析纯,均购自国药集团化学试剂有限公司.
THZ-82A 回旋式恒温水浴振荡器(浙江省绍兴市苏珀仪器有限公司),DHG-9075A电热鼓风干燥箱(上海精宏实验设备有限公司),UV-1800PC-DS2型紫外分光光度计(上海美谱达仪器有限公司),抽滤机(巩义市予华仪器有限公司),电子分析天平(精仪达盛电子公司,日本岛津AVY220).
1.2 实验方法
1.2.1 无患子总皂苷的提取方法
将无患子粉末过80目筛,在60 ℃烘箱中干燥至恒重,备用.准确称取无患子粉末2.0 g于150 mL具塞锥形瓶中,加入50 mL蒸馏水,室温下浸泡24 h.在锥形瓶中加入一定质量比(具体见结果与讨论部分)的由果胶酶和纤维素酶组成的复合酶制剂(总酶用量为6%,以无患子粉末质量为基准),调节溶液的pH值,将锥形瓶放置于一定温度(具体见结果与讨论部分)的恒温水浴振荡器中酶解一定时间(具体见结果与讨论部分).提取液趁热抽滤,将滤渣放入三口烧瓶中,加入50 mL 70%的乙醇溶液回流提取1 h,抽滤;滤渣重复提取2次,合并滤液并定容至250 mL的容量瓶,取0.1 mL滤液采用分光光度法测定无患子总皂苷含量.每个提取实验平行三次,实验结果取平均值.
1.2.2 无患子总皂苷含量的测定
由于目前市面上没有纯的无患子皂苷标准品,而无患子总皂苷主要为齐墩果酸型的三萜皂苷,因此选择齐墩果酸作为标准品,用香草醛-高氯酸比色法进行皂苷浓度测定.在文献测试方法[18-21]的基础上,做了一定的改进.
对照品溶液的制备 精密称取齐墩果酸标准品0.100 g,加甲醇溶解,定容至100 mL,得浓度为1.0 mg/mL的标准溶液.
显色剂溶液配制 精密称取香草醛0.50g置于10mL容量瓶中,加入冰醋酸使其溶解,定容并摇匀,制得质量分数5%的香草醛-冰醋酸显色溶液,显色剂现用现配.
最大吸收波长的确定 取标准溶液和无患子皂苷提取液各 0.20 mL于具塞试管中,置于80 ℃烘箱中烘干,准确加入 5%香草醛-冰醋酸溶液0.40 mL,高氯酸1.60 mL,摇匀,于60℃恒温水浴中加热15 min后取出在流水下冷却至室温,加冰醋酸定容至10 mL,摇匀,静置20 min.以蒸馏水为空白对照,用紫外分光光度计在400~700 nm范围内测两者最大吸收波长,其最大吸收波长均为553 nm.
标准曲线的绘制 分别精密吸取1.0 mg/mL标 准溶液 0、20.0、40.0、 80.0、120.0、160.0、200.0 、240.0μL于10mL具塞试管中,在80 ℃烘箱中烘干,加入5%香草醛-冰醋酸溶液0.40 mL,高氯酸1.60 mL,摇匀,于60 ℃恒温水浴中加热15 min后取出在流水下冷却至室温,加冰醋酸定容至10 mL,摇匀,静置20 min.以空白溶液为参比,于553 nm波长处测定各组的吸光度值.以吸光度(A)为纵坐标y,以对照品溶液溶度(μg/mL)为横坐标x绘制标准曲线,得线性回归方程为:y=0.0283 x -0.0103, R2= 0.9995.
无患子总皂苷含量测定 准确吸取0.10 mL滤液(样品)于具塞试管中,按标准曲线测定方法,测定滤液的浓度,并计算无患子总皂苷的提取率.
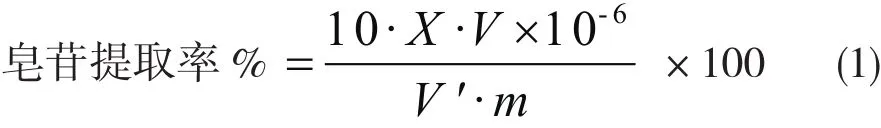
式中:X,皂苷质量浓度(μg/mL);
V,滤液总体积(mL);
V',样品体积(0.10 mL);
m,无患子粉末的质量2.0 g.
1.2.3 正交实验的设计
在单因素实验基础上,为了进一步优化提取工艺参数,设计L9(34)正交实验(见表1),按1.2.1提取方法,以总皂苷提取率为指标,来确定复合酶法提取无患子总皂苷的优化实验条件.利用正交设计助手Ⅱ进行数据统计分析.

表1 正交实验因素水平表
2 结果与讨论
2.1 单因素实验
2.1.1 酶配比对无患子总皂苷提取率的影响
按1.2.1提取方法,加入不同配比的复合酶制剂(m果胶酶∶ m纤维素酶=0∶1、1∶0、1∶1、2∶1、3∶1、4∶1 和 5∶1),调节溶液 pH 值为 4.0,在50 ℃下恒温震荡90 min.不同复合酶配比对无患子总皂苷的提取率影响见图1.
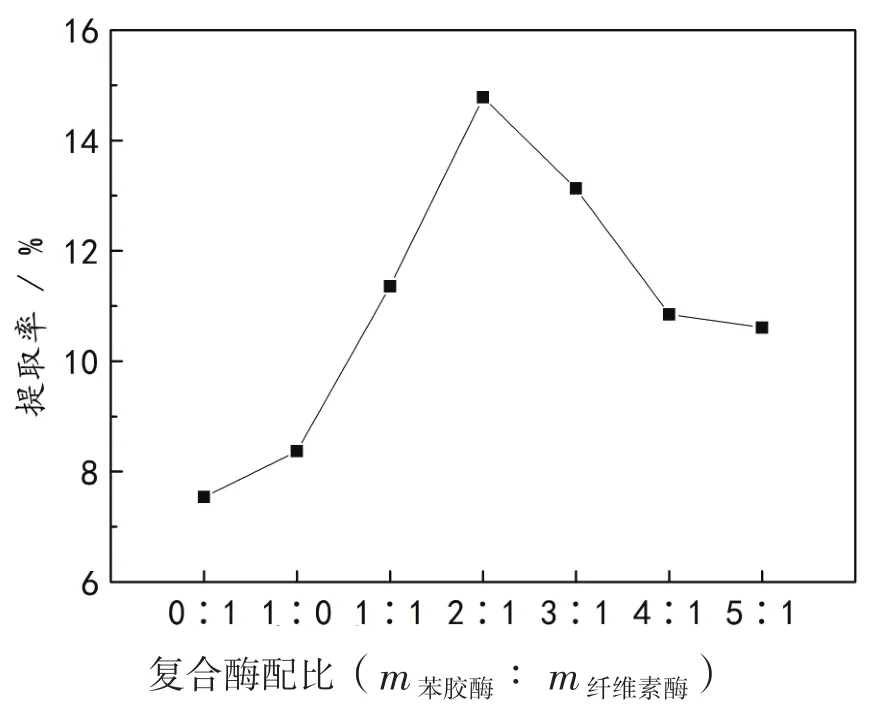
图1 复合酶配比对总皂苷提取率的影响
由图1分析知,只添加单一的纤维素酶(0∶1)或果胶酶(1∶0),总皂苷的提取率较低,添加果胶酶的提取率略高于添加纤维素酶的提取率,复合酶制剂的提取率高于单一酶的作用,这可能是由于复合酶制剂间具有协同作用.无患子假种皮细胞壁组成主要为纤维素和果胶质,纤维素酶和果胶酶复合酶促进了细胞壁的分解,加快了皂苷向溶剂的扩散传质[16].随着复合酶配比的增大,提取率先上升后下降,可能是由于随着复合酶配比的增加,果胶酶含量增加,细胞间的果胶质降解了,有利于总皂苷的提取;但是同时纤维素酶含量减少了,细胞壁的通透性下降,又使得总皂苷提取率下降.因此,取最佳复合酶配比2∶1继续后续试验.
2.1.2 酶解时间对无患子总皂苷提取率的影响
按1.2.1提取方法,加入配比为2∶1的复合酶制剂,调节溶液pH为4.0,分别在50℃下恒温震荡30、60、90、120、150 min.不同酶解时间对无患子总皂苷的提取率影响见图2.
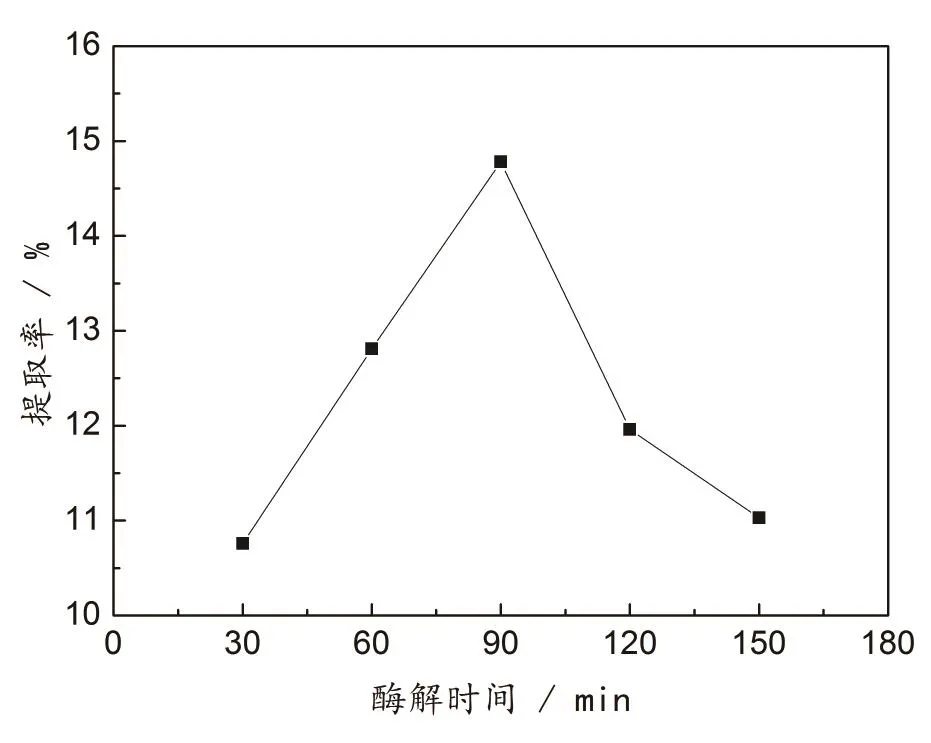
图2 酶解时间对总皂苷提取率的影响
由图 2可知,酶解初期,随着酶解时间延长,提取率逐渐增加,在酶解时间为90 min 时,提取率最高,之后随着酶解时间的增加,总皂苷的提取率反而减小.这可能是因为时间短,酶的活性没有被充分利用,随着酶解时间的延长,在一定范围内,可促进皂苷的溶出[22];而时间过长会导致部分酶失去活性,还有部分皂苷发生水解[9],使得总皂苷提取率降低.
2.1.3 酶解温度对无患子总皂苷提取率的影响
按1.2.1提取方法,加入配比为2∶1的复合酶制剂,调节溶液pH为4.0,分别在30、40、50、60、70 ℃下恒温震荡90 min.不同酶解温度对无患子总皂苷的提取率影响见图3.
由图3可知,总皂苷提取率随着酶解温度的上升先增加后减小.由30 ℃升至60 ℃时,提取率随酶解温度增大而增大,说明温度升高有利于提高酶的活性,促进酶对无患子假种皮细胞壁中纤维素及果胶质等物质的分解,同时温度升高分子运动速度加快,能够促使皂苷快速溶解出来[10,22].但是当温度超过60℃时,总皂苷的提取率反而下降,这可能是由于超过一定温度,导致酶活性降低或部分失活[22].
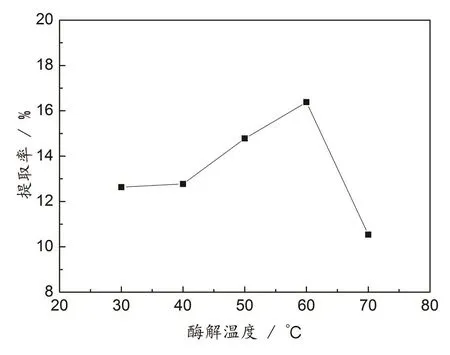
图3 酶解温度对总皂苷提取率的影响
2.1.4 pH值对无患子总皂苷提取率的影响
按1.2.1提取方法,加入配比为2∶1的复合酶制剂,分别调节溶液pH为2.0、3.0、4.0、5.0、6.0,在60 ℃下恒温震荡90 min.不同pH值对无患子总皂苷的提取率影响见图4.

图4 pH值对总皂苷提取率的影响
由图4可知,无患子总皂苷的提取率随pH值的升高先增大后减小.这可能是由于pH值不在酶的最适宜pH 范围内时会导致酶活性降低[16],从而使得纤维素降解、果胶分解不彻底.因为不同酶在不同pH 范围活性不同[23],纤维素酶在pH为5.0~6.5时具有最佳活性,而果胶酶在pH 为4.0~4.8时具有最佳活性.复合酶最适合的pH值为5.0.
2.2 正交实验结果
在单因素实验基础上,设计L9(34)正交实验进一步优化提取工艺参数,实验结果见表2和表3.

表2 正交实验结果表

表3 无患子总皂苷提取率方差分析表
由表2和表3分析可见:各因素对无患子总皂苷提取率的影响顺序为D>C>A>B,即pH值>酶解温度>复合酶配比>酶解时间.从k值判断可以得出无患子皂苷的提取最优工艺为A3B3C2D1,即复合酶配比为3∶1、酶解时间120 min、酶解温度50 ℃、pH值为4.0,也正是正交实验表中的9号实验.9号实验条件下的3次平行实验,无患子总皂苷的提取率分别为:19.42%、19.46%、19.45%,平均值为19.44%,标准偏差为0.0208,相对标准偏差为0.11%,说这明复合酶解提取工艺具有良好的稳定性.
3 结论
采用果胶酶和纤维素酶复合酶辅助乙醇提取无患子总皂苷,通过单因素实验和正交实验,得出复合酶法辅助提取无患子总皂苷的最佳条件为:复合酶配比为3∶1、酶解时间120 min、酶解温度50 ℃、pH值为4.0,在此条件下无患子总皂苷的提取率为19.44%.与 水溶剂减压提取(15.43%)[7]、丙酮浸提(5.72%)[9]、超声波提取(3.41%)[11]、水提醇沉法(3.66%)[13]、乙醇浸提(14.26%)[24]提取无患子总皂苷相比,提取率有较大的提高.

